他克莫司抑制脂质过氧化对大鼠脊髓的保护效应观察
2013-08-02潘峰程艳香范里陈安民郭风劲李章华陶凤华陶海鹰孙虹
潘峰,程艳香,范里,陈安民,郭风劲,李章华,陶凤华,陶海鹰,孙虹
他克莫司抑制脂质过氧化对大鼠脊髓的保护效应观察
潘峰,程艳香,范里,陈安民,郭风劲,李章华,陶凤华,陶海鹰,孙虹
目的探讨大鼠脊髓损伤后早期应用他克莫司对脊髓的保护效应。方法健康成年雄性Wistar大鼠40只,随机分为他克莫司组(n=20)和损伤组(n=20)。采用Allen′s法建立大鼠脊髓损伤模型,他克莫司组在脊髓损伤后5min一次性经尾静脉注射他克莫司0.3mg/kg,损伤组以相同方法给予等量生理盐水。伤后3、7、14、21d应用BBB评分法进行后肢运动功能评价,并分别采用黄嘌呤氧化酶法和硫代巴比妥酸法测定血浆超氧化物歧化酶(SOD)活性和丙二醛(MDA)含量变化,免疫组织化学染色检测脊髓组织诱导型一氧化氮合酶(iNOS)的表达。结果与损伤组比较,他克莫司组各时间点行为学评分明显改善(P<0.05或P<0.01),血浆MDA含量降低、SOD活性升高(P<0.05或P<0.01)。损伤组和他克莫司组iNOS蛋白表达均于伤后3d升高,7d达峰值,且他克莫司组各时间点阳性细胞率均明显低于损伤组(P<0.05或P<0.01)。结论他克莫司可减少大鼠脊髓损伤后iNOS的表达和自由基生成,从而抑制脂质过氧化损伤,改善神经功能。
脊髓损伤;自由基;脂质过氧化作用;他克莫司
创伤性脊髓损伤的病理生理改变是在原发性机械创伤和继发性损伤共同作用下产生的,就治疗时序而言,临床干预仅限于继发性损伤过程。近年研究发现,一氧化氮(nitric oxide,NO)等自由基大量生成导致的氧化应激损伤与继发性脊髓损害密切相关,通过药物干预自由基诱导的脂质过氧化反应治疗脊髓损伤已成为当前的研究热点之一[1]。我们的前期研究证实,大环内酯类免疫抑制剂他克莫司对脊髓损伤具有神经保护作用,但其机制尚未完全阐明[2]。本研究旨在探讨他克莫司对大鼠脊髓损伤后血浆超氧化物歧化酶(superoxide dismutase,SOD)活性、丙二醛(malondialdehyde,MDA)含量及诱导型一氧化氮合酶(inducible nitric oxide synthase,iNOS)表达的影响,以明确他克莫司能否通过抑制脂质过氧化反应发挥脊髓保护效应。
1 材料与方法
1.1 动物及分组 成年雄性健康Wistar大鼠40只,体重200~260g,由武汉大学实验动物中心提供。随机分为2组:①他克莫司组(n=20),脊髓损伤后5min一次性经尾静脉注射他克莫司0.3mg/kg;②损伤组(n=20),脊髓损伤后5min一次性经尾静脉注射等量生理盐水。
1.2 脊髓损伤模型的制备 大鼠经1%戊巴比妥钠(30mg/kg)腹腔注射麻醉,损伤组和他克莫司组采用Allen′s法建立脊髓损伤模型:切除T9-T10椎板,用质量为10g的金属棒从4.0cm高处自由落下撞击硬膜囊,损伤直径约3.0mm,金属棒下落后大鼠迅速出现摇尾反射,双后肢及躯体回缩扑动后双后肢呈弛缓性瘫痪,表明撞击成功,止血后缝合切口。术后小心饲养,每8h人工按压排尿。
1.3 脊髓功能评分 采用脊髓运动功能BBB(Basso Beattie and Bresnahan)评分法[3]对各组大鼠脊髓损伤后的后肢运动功能进行评定,包括后肢髋、膝、踝关节主动活动范围,后足负重状况,前后肢运动协调性,后爪抬起和触地时脚趾的动作,尾部运动,躯干稳定性等项目,满分为21分。损伤组和他克莫司组分别在术后3、7、14、21d进行评分,每个时间点各5只。两名评分者为非本实验组人员且熟知评分标准,每人分别对一侧后肢独立进行评估,共测定3次,取平均值,若两人所得分值不等,则再取平均值。
1.4 血浆SOD活性及MDA含量测定 损伤组和他克莫司组各5只大鼠在上述各时间点进行脊髓功能评分结束后经腹腔内麻醉后开胸,经右心室取血3ml,在预冷肝素抗凝试管中混匀,4℃下2000r/ min离心10min,取上清液,–80℃保存。SOD和MDA测定试剂盒均购自南京建成生物研究所。SOD活性采用黄嘌呤氧化酶法测定,测定波长550nm,MDA含量采用硫代巴比妥酸法测定,测定波长532nm,具体操作方法按试剂盒说明书进行。721型可见光分光光度计为上海医用仪器厂产品。
1.5 脊髓标本取材及切片制备 每组5只大鼠在上述各时间点取血完毕后,立即切取以伤段为中心长约8mm的脊髓组织,横断为两等份,任取一半组织投入4%多聚甲醛固定24h,常规石蜡包埋,5μm连续切片。
1.6 免疫组化检测大鼠脊髓iNOS蛋白表达 兔抗大鼠iNOS多克隆抗体及SABC试剂盒均购自武汉Boster生物工程公司。从各组术后各时间点每只大鼠脊髓组织连续切片中随机抽取3张,脱蜡至水,3%过氧化氢室温孵育10min灭活内源性过氧化物酶,正常山羊血清室温封闭20min,加入兔抗大鼠一抗(1:80稀释)后4℃过夜,然后滴加生物素化羊抗兔二抗37℃孵育20min,滴加试剂SABC 37℃孵育20min,DAB显色,苏木素复染,依次脱水、透明,封固后在光镜下观察。以PBS代替一抗作阴性对照。结果判断:阳性细胞胞质呈棕黄色。计算每张切片的阳性细胞百分比。
1.7 统计学处理 采用SPSS 13.0软件进行统计分析,计量资料结果以±s表示,组间比较采用单因素方差分析(one-way ANOVA),进一步两两比较采用LSD-t法,P<0.05为差异有统计学意义。
2 结 果
2.1 脊髓功能评分 损伤组和他克莫司组大鼠伤后短时间内双后肢功能完全丧失,动物俯卧位行走,尿潴留。损伤组伤后3d时BBB评分为3.41±1.33;他克莫司组伤后3d时脊髓功能即有所恢复,BBB评分为5.38±1.29,显著高于损伤组。损伤组和他克莫司组伤后7d大鼠后肢肌力逐渐开始恢复,14d和21d时两组脊髓功能明显恢复,但组间差距也增加,至伤后21d两组评分分别为13.69±1.55和18.44±1.92(表1)。他克莫司组伤后各时间点BBB评分均显著高于损伤组(P<0.05或P<0.01)。
2.2 血浆SOD活性及MDA含量检测结果 伤后3d损伤组与他克莫司组SOD活性均降至最低点,损伤组下降更为明显,伤后7~14d逐渐回升,损伤组与他克莫司组间差距增大,至伤后21d,损伤组血浆SOD活性仍未恢复至正常水平,而他克莫司组SOD活性已远高于损伤组(表1),各时间点两组间差异均有统计学意义(P<0.05或P<0.01)。损伤组血浆MDA水平在伤后3d即有明显升高,至伤后7d达峰值,然后逐步回落;他克莫司组伤后3d血浆MDA含量升高,但低于损伤组,3~7d维持在相对稳定的水平,然后回落(表1),两组在伤后3、7、14d时比较差异有统计学意义(P<0.05或P<0.01)。
2.3 脊髓组织iNOS蛋白表达水平 iNOS阳性表达主要分布在脊髓前角和中央管周围的大多角形细胞以及后角的小圆细胞中,根据其形态和分布规律推测主要为神经元和小胶质细胞,另有部分血管内皮细胞亦可见iNOS阳性表达。损伤组伤后3d即可见较多细胞表达iNOS,至7d达峰值,阳性细胞百分比为61.41%±5.36%,之后缓慢下降,至21d仍可观察到明显表达。他克莫司组iNOS表达水平低于损伤组,高峰亦发生在伤后7d,阳性细胞百分比为49.03%±5.91%,然后逐步回落(表1,图1)。两组在各时间点比较差异均有统计学意义(P<0.05或P<0.01)。
表1 大鼠伤后不同时间点BBB评分、血浆SOD活性和MDA含量、脊髓组织iNOS表达情况(±s, n=5)Tab. 1 Profiles of BBB score, SOD activity and MDA level in plasma, expression of iNOS in spinal cord-injured rats at different time points (±s, n=5)

表1 大鼠伤后不同时间点BBB评分、血浆SOD活性和MDA含量、脊髓组织iNOS表达情况(±s, n=5)Tab. 1 Profiles of BBB score, SOD activity and MDA level in plasma, expression of iNOS in spinal cord-injured rats at different time points (±s, n=5)
(1)P<0.05, (2)P<0.01 compared with injury group; (3)P<0.05, (4)P<0.01 compared with 3d; (5)P<0.05, (6)P<0.01 compared with 7d; (7) P<0.01 compared with 14d
14 21 BBB score Injury group 3.41±1.33 7.64±0.88(4) 12.49±1.71(4)(6) 13.69±1.55(4)(6)Tacrolimus group 5.38±1.29(1) 10.05±1.42(1)(4) 17.27±1.85(2)(4)(6) 18.44±1.92(2)(4)(6)SOD activity (U/ml) Injury group 36.65±12.11 82.57±11.01(4) 112.38±14.10(4)(6) 127.43±10.85(4)(6)Tacrolimus group 54.85±8.26(1) 143.78±17.09(2)(4) 175.62±18.18(2)(4)(6) 186.46±19.48(2)(4)(6)MDA level (nmol/ml) Injury group 7.87±0.62 8.51±0.76 6.13±0.56(4)(6) 3.89±0.60(4)(6)(7)Tacrolimus group 6.55±0.40(2) 6.42±1.11(2) 5.30±0.44(1)(4)(5) 3.17±0.21(4)(6)(7)Expression of iNOS protein (%) Injury group 52.70±6.33 61.41±5.36(3) 45.47±6.24(6) 30.13±5.16(4)(6)(7)Tacrolimus group 39.74±4.87(2) 49.03±5.91(2)(3) 31.48±5.74(2)(3)(6) 21.09±4.22(1)(4)(6)(7)Item Time after operation (d) 3 7
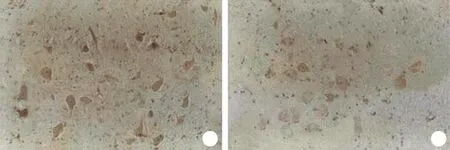
图1 两组大鼠伤后3d脊髓组织中iNOS的表达情况(免疫组化染色 ×200)Fig. 1 iNOS expression in myeloid tissue 3 days after rat injury (Immunohistochemistry staining ×200)
3 讨 论
哺乳动物体内有3种NOS亚型。Ⅰ型和Ⅲ型在体内恒定表达,称为固有型NOS(constitutive NOS,cNOS),其活性依赖于Ca2+浓度。Ⅱ型即iNOS,在各种刺激下诱导生成[4],其活性不依赖于Ca2+浓度,在正常生理状态下含量极低[5],但脊髓损伤后,随着中性粒细胞等炎症细胞的浸润及炎症因子的产生,iNOS表达逐渐增加。由于iNOS不依赖于Ca2+即可与钙调蛋白紧密结合,通过级联放大作用产生大量NO,远超过cNOS作用下产生的NO量。NO与氧及活性氧中间产物、巯基化合物相互作用产生其他生物活性分子,如ONOO-、NO+及,导致脂质过氧化反应增强,引起严重的细胞氧化损伤[1]。同时NO本身也可通过多种方式诱导细胞凋亡[6]。Xu等[7]应用免疫组化和Western blotting方法检测脊髓损伤后iNOS及蛋白氧化应激代谢产物亚硝基酪氨酸的表达发现,两者均于损伤后1d增加,7d达峰值,且iNOS表达水平与其活性水平在时间变化上相一致。Moon等[8]发现当归根提取物通过抑制iNOS的表达,可减轻脊髓损伤后氧化应激导致的神经细胞凋亡,促进神经功能恢复。本实验结果显示,脊髓损伤后iNOS表达明显增加,于伤后7d达峰值,至21d仍维持在较高水平,而伤后早期给予他克莫司可显著降低iNOS表达,提示iNOS表达上调可能在脊髓损伤的发生发展中起重要作用,iNOS表达受抑可能参与了他克莫司的神经保护作用。
脊髓损伤后组织缺血、缺氧,iNOS表达上调,产生并释放大量包括活性NO族在内的自由基。自由基含有不配对电子,性质极不稳定,极易攻击生物膜上多价不饱和脂肪酸的丙烯双链,形成连锁式的铁离子依赖性脂质过氧化反应,破坏膜结构的通透性和完整性,其中NO与超氧负离子相互作用产生高反应活性的-OH和ONOO-,引发更为严重的细胞氧化损伤[1]。MDA为脂质过氧化的代谢终产物,可反映体内自由基的生成和脂质过氧化水平,SOD为自由基的清除剂,通过催化歧化反应,保护细胞免受过氧化损伤,两者是目前公认的反映自由基生成及脂质过氧化反应程度的指标[9]。Kanter等[10]研究证实脊髓损伤后MDA含量增高,SOD活性下降,二者呈负相关,与本研究损伤组的测定结果一致,提示脊髓损伤后自由基生成增加、脂质过氧化反应增强。Fan等[11]研究发现提高SOD活性对脊髓损伤有明显的保护作用,本实验他克莫司组SOD活性高于损伤组、脊髓功能BBB评分优于损伤组亦为其提供了佐证,说明脊髓损伤早期应用他克莫司抑制和清除自由基可促进后期功能恢复。此外,本研究选择SOD和MDA作为衡量脊髓损伤后自由基生成及脂质过氧化反应程度的指标,而未直接检测血浆或脊髓组织中NO自由基的生成水平,这主要是基于如下考虑:①NO的半衰期极短,生成后即与活性氧族相互作用生成其他活性分子[12],因而难以准确测量;②NO引起的氧化损伤并不仅仅限于其本身,前已述及,NO与氧及活性氧中间产物等相互作用产生的ONOO-、NO+等可导致更为严重的细胞氧化损伤,因此NO及其衍生物共同参与了脊髓继发性损伤过程,仅对NO水平进行检测有失偏颇,而SOD和MDA含量测定则能全面反映脊髓损伤后自由基的生成水平及其引发的脂质过氧化损伤的程度。
本课题组前期研究证实他克莫司可减少脊髓损伤后的神经细胞凋亡[2]。Yousuf等[13]在大鼠脊髓背侧柱缺氧损伤模型中发现,他克莫司可通过抗氧化作用保护线粒体功能,减少梗死面积。本实验结果显示,他克莫司组脊髓损伤后iNOS表达和血浆MDA含量明显低于损伤组,而SOD活性显著高于损伤组,表明他克莫司可抑制伤后iNOS表达,减少NO等自由基的生成,提高SOD活性,减轻脂质过氧化反应,而进一步的脊髓功能评分显示,伤后各时间点他克莫司组BBB评分均显著高于损伤组,表明脊髓损伤后早期应用他克莫司可有效抑制自由基生成及脂质过氧化反应,减轻其对神经细胞的氧化损伤,促进脊髓损伤后的功能恢复。同时本研究还发现,脊髓损伤后SOD活性最低点与MDA含量最高点之间存在一个时间差,提示他克莫司提高SOD活性只能减轻而不能完全阻止脂质过氧化反应,因此,还需通过其他途径从多个方面抑制自由基产生及其导致的细胞氧化损伤。
[1] Hall ED. Antioxidant therapies for acute spinal cord injury[J]. Neurotherapeutics, 2011, 8(2): 152-167.
[2] Pan F, Chen AM, Guo FJ, et al. Effect of tacrolimus on apoptosis and expression of heat shock protein 70 after acute spinal cord injury in rats[J]. Chin J Surg, 2006, 44(24): 1708-1712. [潘峰,陈安民, 郭风劲, 等. 他克莫司对大鼠急性脊髓损伤后细胞凋亡及热休克蛋白70表达的影响[J]. 中华外科杂志, 2006, 44(24): 1708-1712.]
[3] Basso DM, Beattie MS, Bresnahan JC. A sensitive and reliable locomotor rating scale for open field testing in rats[J]. J Neurotrauma, 1995, 12(1): 1-21.
[4] Shang Y, Zi Y, Zhang YJ, et al. Influence of propofol on the expression of iNOS after spinal cord injury in rat[J]. Med J Chin PLA, 2006, 31(6): 587-589. [尚宇, 訾英, 张雅金, 等. 异丙酚对大鼠脊髓损伤后诱导型一氧化氮合酶表达的影响[J]. 解放军医学杂志, 2006, 31(6): 587-589.]
[5] Mallei A, Aden SA, Bachis A, et al. The nitrosteroid NCX 1015, a prednisolone derivative, improves recovery of function in rats after spinal cord injury[J]. Brain Res, 2005, 1062(1-2): 16-25.
[6] Impellizzeri D, Esposito E, Mazzon E, et al. The effects of a polyphenol present in olive oil, oleuropein aglycone, in an experimental model of spinal cord injury in mice[J]. Biochem Pharmacol, 2012, 83(10): 1413-1426.
[7] Xu J, Kim GM, Chen SW, et al. iNOS and nitrotyrosine expression after spinal cord injury[J]. J Neurotrauma, 2001, 18(5): 523-532.
[8] Moon YJ, Lee JY, Oh MS, et al. Inhibition of inflammation and oxidative stress by Angelica dahuricae radix extract decreases apoptotic cell death and improves functional recovery after spinal cord injury[J]. J Neurosci Res, 2012, 90(1): 243-256.
[9] Ilhan N, Halifeoglu I, Qzercan HI, et al. Tissue malondialdehyde and adenosine triphosphatase level after experimental liver ischaemia-reperfusion damage[J]. Cell Biochem Funct, 2001, 19(3): 207-212.
[10] Kanter M, Coskun O, Kalayci M, et al. Neuroprotective effects of Nigella sativa on experimental spinal cord injury in rats[J]. Hum Exp Toxicol, 2006, 25(3): 127-133.
[11] Fan LH, Wang KZ, Cheng B. Effects of Ginkgo biloba extract on lipid peroxidation and apoptosis after spinal cord ischemia/ reperfusion in rabbits[J]. Chin J Traumatol, 2006, 9(2): 77-81.
[12] Macleod MR, Butcher SP. Nitric-oxide-synthase-mediated cyclic guanosine monophosphate production in neonatal rat cerebellar prisms is resistant to calcineurin inhibition[J]. Neurosci Lett, 2002, 322(1): 41-44.
[13] Yousuf S, Atif F, Kesherwani V, et al. Neuroprotective effects of Tacrolimus (FK-506) and Cyclosporin (CsA) in oxidative injury[J]. Brain Behav, 2011, 1(2): 87-94.
Neuroprotective effect of tacrolimus on injured spinal cord of rats via attenuating lipid peroxidation
PAN Feng1, CHENG Yan-xiang2, FAN Li1, CHEN An-min3, GUO Feng-jing3, LI Zhang-hua1, TAO Feng-hua1, TAO Haiying1, SUN Hong1
1Department of Spine Surgery,2Department of Gynaecology and Obstetrics, Renmin Hospital of Wuhan University, Wuhan 430060, China
3Department of Orthopaedics, Tongji Hospital, Huazhong University of Science and Technology, Wuhan 430030, China
This work was supported by the Provincial Natural Science Foundation of Hubei (2012FFB04406)
ObjectiveTo study the neuroprotective effect of tacrolimus on early injury of rats′ spinal cord and its underlying mechanism.MethodsForty-five healthy male Wistar rats were randomly divided into injury group (n=20) and tacrolimus group (n=20). The rats in the two groups were subjected to contusion of spinal cord injury (SCI) at the T10level with weight-drop impact (Allen′s method). Animals in tacrolimus group were administered with tacrolimus (0.3mg/kg) 5min intravenously after SCI, while those in the injury group
equal volume of normal saline. BBB scales were used to assess the neurological function of hind limbs 3, 7, 14, and 21 days after SCI. Superoxide dismutase (SOD) activity and malonaldehyde (MDA) level in the plasma were measured by xanthine oxidase and thiobarbituric acid (TBA) method respectively. The expression of inducible nitric oxide synthase (iNOS) in spinal cord was detected by immunohistochemistry staining.ResultsThe BBB score was significantly higher, the plasma MDA level was obviously lower and SOD activity was remarkably higher in tacrolimus group than those in injury group (P<0.05, P<0.01). The expression of iNOS protein in spinal cord began to increase on the 3rd day after SCI and reached the peak at the 7th day in both injury and tacrolimus group, and the iNOS positive cell rate was significantly lower in tacrolimus group than in injury group at each time point (P<0.05, P<0.01).ConclusionTacrolimus may inhibit the expression of iNOS and decrease the generation of free oxygen radicals after SCI, thus attenuate lipid peroxidation and improve neurological function.
spinal cord injuries; free radicals; lipid peroxidation; tacrolimus
R651.21
A
0577-7402(2013)04-0279-04
2012-10-15;
2013-02-21)
(责任编辑:胡全兵)
湖北省自然科学基金(2012FFB04406)
潘峰,医学博士,主治医师。主要从事脊柱脊髓损伤的基础与临床研究
430060 武汉 武汉大学人民医院脊柱外科/骨一科(潘峰、范里、李章华、陶凤华、陶海鹰、孙虹),妇产科(程艳香);430030 武汉 华中科技大学附属同济医院骨科(陈安民、郭风劲)
