骨形成蛋白家族成员2、7对小鼠胚胎肝干细胞分化的体外研究
2013-08-02陈聪康权罗庆迭小红田雯
陈聪,康权,罗庆,迭小红,田雯
骨形成蛋白家族成员2、7对小鼠胚胎肝干细胞分化的体外研究
陈聪,康权,罗庆,迭小红,田雯
目的探讨骨形成蛋白2、7(BMP2、BMP7)对小鼠胚胎肝干细胞(HP14.5)定向诱导分化为肝细胞样细胞的影响。方法将表达BMP2、BMP7、肝细胞生长因子(HGF)和绿色荧光蛋白(GFP)的重组腺病毒作为4个组分别感染HP14.5,诱导其分化,在病毒感染后的第1、4、7天通过检测荧光素酶报告基因读数,在第7天通过细胞免疫荧光染色,观察肝细胞标志物白蛋白(ALB)的表达情况;并在第4、7、10天通过PAS染色、尿素氮合成功能检测,观察诱导后HP14.5向肝细胞方向的分化成熟度。结果BMP2组、HGF组荧光素酶读数较GFP对照组明显上升;免疫荧光染色显示,诱导7d后BMP2组、HGF组细胞质内表达肝细胞特有的ALB,而GFP对照组几乎无表达;糖原染色可见BMP2组、HGF组胞质存在紫红色颗粒,呈阳性反应;尿素合成功能检测显示BMP2组、HGF组培养液中尿素氮随时间而升高。BMP7组诱导后,细胞免疫荧光染色、荧光素酶活性、PAS染色和尿素合成检测均呈阴性或弱阳性反应。结论BMP2具有一定的诱导HP14.5向成熟肝细胞分化的作用,并初步具备肝细胞的合成分泌功能,而BMP7对其无诱导作用。
骨形态发生蛋白质类;胚胎肝干细胞;细胞分化;重组腺病毒
自Wilson等[1]在小鼠营养性肝损伤修复机制研究中提出肝内可能存在肝干细胞的假说以来,有关肝干细胞的研究受到了广泛关注。目前认为肝干细胞主要包括肝卵圆细胞[2]、小肝细胞和胚胎肝干细胞(hepatic progenitor cells,HP)。胚胎肝干细胞是肝脏生长发育、再生的重要细胞来源,在小儿先天性肝病、代谢性肝病的终末期治疗中具有广阔的应用前景。因为HP的表型特征更接近肝细胞,在肝细胞的生长发育、重建再生方面具有一定优势[3]。本课题组在成功分离出小鼠胚胎肝干细胞的基础上,使其达到了永生化。本研究进一步探讨骨形成蛋白(bone morphogenetic proteins,BMP)家族成员BMP2、BMP7基因对小鼠胚胎肝干细胞诱导分化的影响,以筛选优化小鼠胚胎肝干细胞体外培养的最佳诱导因素,建立有效的诱导肝干细胞定向分化为晚期成熟肝细胞的体外培养体系,为临床肝细胞移植提供新的思路。
1 材料与方法
1.1 主要试剂及材料 永生化和含有白蛋白启动子修饰的细胞株HP14.5(美国芝加哥大学医学分子肿瘤实验室分离鉴定)、293细胞(重庆医科大学附属儿童医院干细胞实验室保存)。DMEM培养基、胎牛血清(Gibco公司),荧光素酶检测试剂盒(NEB公司),白蛋白(ALB)抗体及二抗(Santa Cruz公司),Polybrene、糖原染色试剂盒、尿素氮检测试剂盒(Sigma公司)。重组腺病毒Ad-BMP2、Ad-BMP7和Ad-HGF的构建由本课题组完成、保存,测序工作由芝加哥大学分子实验中心完成,上述病毒均经RT-PCR验证有目的基因的表达[4],Ad-BMP2、Ad-BMP7和Ad-HGF带GFP标签蛋白,可以在荧光显微镜下观察病毒的感染情况。
1.2 细胞培养及实验分组 小鼠胚胎肝干细胞HP14.5培养于含10%胎牛血清的DMEM中,于37℃、5 % CO2条件下培育,间隔48h,0.25%胰酶消化传代,备用。实验分4组:BMP2组、BMP7组、肝细胞生长因子(HGF)组和绿色荧光蛋白(GFP)对照组,每组设置复孔,实验重复3次,于病毒感染HP14.5细胞后第1、4、7、10天4个时间点对其行特异性标志物及合成分泌功能检测。
1.3 病毒感染HP14.5细胞滴度的确定 将HP14.5细胞接种于24孔板中,接种密度为1.5×105,待细胞贴壁后,倍比稀释病毒上清,分别感染HP14.5细胞,继续培养48h后用荧光显微镜观察GFP荧光阳性的细胞数,按下式计算其病毒滴度,筛选出感染复数(multiplicity of infection,MOI)为100的最合适的病毒滴度。病毒滴度(pfu/ml)=GFP荧光阳性细胞数×病毒上清稀释倍数/0.4。
1.4 荧光素酶活性检测 将携带ALB-Gluc报告基因的HP14.5细胞接种于24孔板上,分别加入表达GBMP2、BMP7和HGF重组腺病毒,分别在感染后的第1、4、7、10天取上清液检测荧光素酶活性。每组设置复孔,重复3次实验,读数取均值,按照说明书操作配置工作液,每20μl检测工作液加入细胞上清液50μl,混匀后在波长为470nm的酶标仪上读数。
1.5 细胞免疫荧光染色 将状态良好的HP14.5细胞传代接种于24孔培养板,至细胞密度约为1.5×105时,各组细胞分别加入重组腺病毒后继续培养7d。细胞用PBS洗涤2~3次,4%多聚甲醛固定20min,含TritonX-100洗涤液漂洗3次后血清封闭,ALB一抗37℃孵育过夜,漂洗3次后标记二抗37℃孵育2h,漂洗3次后DAPI染核10min,漂洗3次,倒置荧光显微镜下观察荧光染色情况。
1.6 糖原染色 HP14.5细胞加入重组腺病毒培养,在第4、7、10天3个时间点行糖原染色。先弃掉培养基,采用磷酸盐缓冲液(PBS)漂洗3次后,每孔加入250μl的4%多聚甲醛,室温固定20min;PBS漂洗后加入高碘酸溶液500μl,室温放置5min;PBS冲洗后加入Schiff溶液500μl染色15min,流水冲洗2min;再用苏木素500μl染色1min,流水冲洗2min,加入1%氨水10s左右,流水冲洗后显微镜下观察染色情况,用于反映细胞的糖原合成功能。
1.7 比色法检测 4组细胞分别加入表达BMP2、BMP7、HGF诱导因子的重组腺病毒后进行分化培养,行比色法检测尿素氮含量,并对第4、7、10天3个时间点的尿素氮含量进行对照分析,严格按照尿素氮检测试剂盒说明书进行操作,孵育后在分光光度仪上选择520nm波长检测,获取吸光度(A)读数,计算待测样品浓度。
1.8 统计学处理 采用SPSS 13.0统计软件分析,实验数据以±s表示,组间比较采用两样本均数的t检验,P<0.05为差异有统计学意义。
2 结 果
2.1 重组腺病毒对HP14.5细胞的感染 重组腺病毒经包装细胞293细胞扩增纯化后,再加入5μl Polybrene试剂,可有效感染小鼠胚胎肝干细胞HP14.5。最适病毒感染滴度如下,BMP2:1.2μl;BMP7:0.8μl;HGF:1μl;GFP:1μl。图1为病毒感染48h后荧光显微镜下感染细胞的荧光量对比,可见4组细胞的病毒感染滴度近似,感染率约为70%,为后续分化实验的可行性和均一性奠定了基础。
图1 病毒感染HP14.5细胞48h后的荧光表达(×100)Fig. 1 HP14.5 cells 48 hours after infection of recombinant adenovirus (Fluorescence microscope×100)

图2 细胞因子诱导HP14.5细胞不同时间点荧光素酶活性Fig. 2 Luciferase activity in HP14.5 cells induced by different cytokine at different time-points
2.2 荧光素酶活性检测结果 如图2所示,与GFP对照组比较,BMP2组、HGF组ALB-Gluc表达水平在诱导后均有所增加,且随着时间的延长而增加,在第7天达到峰值。BMP2组荧光素酶A值读数接近HGF组,提示BMP2和HGF一样,有诱导肝干细胞向成熟肝细胞样细胞分化的作用。组间对比发现,BMP7组对HP14.5无诱导作用(P>0.05)。
2.3 免疫细胞荧光染色结果 BMP7组、GFP对照组几乎无红色荧光,提示无肝细胞特征性标志物ALB的表达,即细胞未向肝细胞方向分化;而BMP2组和HGF组均出现明显的红色荧光,说明均有ALB表达,提示BMP2、HGF均可诱导肝干细胞向肝细胞样细胞分化(图3)。

图3 细胞免疫荧光染色后ALB的表达情况(荧光显微镜 ×200)Fig. 3 ALB expression after cell immunofluorescence staining (Fluorescence microscope ×200)
2.4 PAS染色结果 诱导后第4、7、10天,BMP2组、HGF组均可见胞质内存在紫红色颗粒,呈阳性反应,并且随着时间的延长明显加深,在第10天最明显,而BMP7组和GFP对照组无明显变化,染色呈弱阳性或阴性,无糖原合成功能(图4)。
2.5 比色法检测结果 加入重组腺病毒诱导分化第4、7、10天,尿素合成功能读数显示,BMP2组和HGF对照组培养液内均可见尿素氮的读数逐渐升高,说明细胞具有尿素的合成和分泌功能,而BMP7组和GFP对照组读数升高不明显,提示没有肝细胞的类似功能(图5)。
3 讨 论
肝干细胞又称肝前体细胞,因其表形特征更接近肝细胞而具有增生分化的潜能,逐渐成为研究热点[5-6]。近年来的研究显示,肝干细胞对小儿先天性肝病终末期的治疗具有重要的临床应用价值,为临床细胞肝移植治疗提供了新的思路[7]。肝干细胞的分化是一个复杂的变化过程,一些调控因子在促进分化的过程中起到关键性的调控作用[8]。本实验采用胶原酶消化法从胎龄14d的小鼠胚胎肝脏中分离提取细胞,经鉴定为小鼠胚胎肝干细胞,作为我们实验研究的种子细胞[9-10]。

图4 诱导后不同时间点PAS染色(×200)Fig. 4 PAS staining resulted post inducement at different time points (×200)
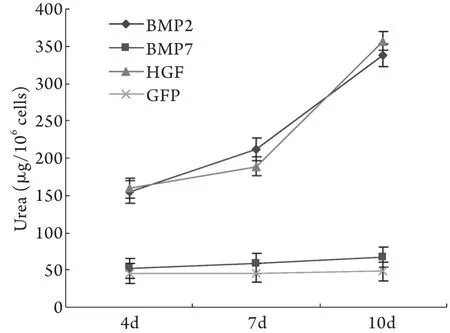
图5 尿素合成功能的测定Fig. 5 Determination of urea synthesis function
在胚胎肝脏早期的发育过程中,BMP家族是非常重要的信号分子[11]。从Urist[12]在1956年首次发现并报道BMP以来,其功能早已超越了早期人们所认识的范围,从促进骨生成扩展为涉及胚胎发育、骨骼发生、神经发育和修复、精子发生及胎盘形成等多个领域。大量文献报道BMP2、BMP7在促进干细胞分化方面有重要作用,例如Bai等[13]研究发现BMP7可促进胚胎干细胞分化为软骨细胞,Sánchez-Camacho等[14]提出BMP7为脑胼胝体分化形成的必需因子,而BMP2为诱导胚胎干细胞定向分化为成骨细胞公认的诱导因子。也有文献报道BMP2、BMP7在肝脏再生方面发挥了重要作用[15-16],提示其在肝脏分化阶段扮演着重要角色。我们前期课题组成功将BMP2-15基因克隆并构建入重组腺病毒载体中[4],获得了高滴度的重组腺病毒表达,并且已发现BMP9在成骨方面有巨大作用[17-18],因此进一步选择了与肝脏联系比较紧密的BMP家族成员BMP2、BMP7,探究其与肝干细胞之间的关系。
肝细胞生长因子HGF在促进肝细胞分化、生长发育中起作用,至今仍被认为是最强有力的致分裂增殖子[19]。HGF能有效促进诱导肝细胞的成熟分化,是最早被认识在肝再生过程中起重要作用的细胞因子之一,其作用机制是通过HGF/C-met系统相互作用而促进多种细胞的有丝分裂及形态形成,在肝脏的发育成熟、再生和组织重建中发挥着重要作用[20]。本实验选用细胞因子HGF作为HP14.5细胞诱导的阳性对照组,通过与HGF诱导效果的对比,观察实验组BMP2、BMP7对肝干细胞的诱导情况。
ALB是反映肝干细胞向成熟肝细胞样细胞分化活性和功能的良好指标,成熟的肝细胞表达ALB。本实验选取BMP2、BMP7、HGF作为诱导因子分别感染小鼠胚胎肝干细胞,通过ALB-Gluc报告基因荧光素酶检测和免疫荧光等方法,检测成熟肝细胞特异性指标ALB的表达情况,发现随着诱导时间的延长,BMP2组、HGF组ALB的表达增加,而BMP7组和GFP对照组变化不明显,进一步进行PAS染色和尿素合成检测,发现BMP2对HP14.5有诱导作用,这与文献报道的BMP2在肝脏再生方面具有一定作用有相关性[15]。本研究还发现BMP2对肝干细胞具有定向诱导作用,但目前对其诱导肝脏分化的信号途径的下游事件还不清楚,但BMP7诱导后在肝细胞标志物及合成分泌的功能检测中和GFP对照组差异无统计学意义,提示BMP7虽然在诱导成骨、软骨方向有一定作用,但BMP7对于肝干细胞无明显诱导作用。BMP2是诱导肝干细胞定向分化为肝细胞的重要细胞因子,而BMP7是否通过其他信号分子介导而对肝干细胞产生诱导作用目前仍不清楚,下一步我们将研究BMP2与HGF的协同作用,在后续实验中进一步验证其对HP14.5的诱导作用。
[1] Wilson JW, Leduc EH. Experimental alterations of theergastoplasm of the mouse liver[J]. Rev Int Hepatol, 1967, 17(8): 883-893.
[2] Zhou GS, Zhang ZS, Liu SD, et al. Derivation, characterization and differentiation in vitro of hepatic oval cells of adult rats[J]. Med J Chin PLA, 2007, 32(5): 467-469. [周高速, 张振书, 刘思德, 等. 大鼠肝卵圆细胞体外分离培养和诱导分化为肝细胞的初步研究[J]. 解放军医学杂志, 2007, 32(5): 467-469.]
[3] Kamiya A, Nakauchi H. Enrichment and clonal culture of hepatic stem/progenitor cells during mouse liver development[J]. Methods Mol Biol[J]. 2013, 945: 273-286.
[4] Kang Q, Sun MH, Cheng H, et al. Characterization of the distinct orthotopic bone forming activity of 14 BMPs using recombinant adenovirus-mediated gene delivery[J]. Gene Ther, 2004, 11(17): 1312-1320.
[5] Soyama A, Eguchi S, Hamada T, et al. The impact of hepatic denervation on the accumulation of hepatic progenitor cells during liver regeneration in rats[J]. Hepatogastroenterology, 2012, 59(117): 1577-1579.
[6] Guo J, Li J, Lu Y, et al. A novel technique for hepatic progenitor cell isolation from normal adult rat livers[J]. ASAIO J, 2012, 58(1): 73-78.
[7] Hughes RD, Mitry RR, Dhawan A. Current status of hepatocyte transplantation[J]. Transplant, 2012, 93(4): 342-347.
[8] He ZJ, Fang CH, Ma JX, et al. Rat mesenchymal stem cells differentiate into hepatocyte-like cells induced hepatocyte growth factor plus epidermal growth factor in vitro[J]. Med J Chin PLA, 2006, 31(5): 446-449. [何忠杰, 方驰华, 马俊勋,等. 肝细胞生长因子与表皮细胞生长因子联合诱导大鼠骨髓间充质干细胞分化为类肝细胞[J]. 解放军医学杂志, 2006, 31(5): 446-449.]
[9] Bi Y, Huang J, He Y, et al. Wnt antagonist sfrp3 inhibits the differentiation of mouse hepatic progenitor cells[J]. J Cell Biochem, 2009, 108(1): 295-303.
[10] Huang J, Bi Y, Zhu GH, et al. Retinoic acid signalling induces the diffrentiation of mouse fetal liver-derived hepatic progenitor cells[J]. Liver Int, 2009, 29(10): 1569-1581.
[11] Zhao R, Duncan SA. Embryonic development of the liver[J]. Hepatology, 2005, 41(5): 956-967.
[12] Urist MR. Bone: formation by autoinduction[J]. Science, 1965, 150(3698): 893-899.
[13] Bai X, Li G, Zhao C, et al. BMP7 induces the differentiation of bone marrow-derived mesenchymal cells into chondrocytes [J]. Med Biol Eng Comput, 2011, 49(6): 687-692.
[14] Sánchez-Camacho C, Ortega JA, Ocaña I, et al. Appropriate Bmp7 levels are required for the differentiation of midline guidepost cells involved in corpus callosum formation[J]. Dev Neurobiol, 2011, 71(5): 337-350.
[15] Nakatsuka R, Taniguchi M, Hirata M, et al. Transient expression of bone morphogenic protein-2 in acute liver injury by carbon tetrachloride[J]. J Biochem, 2007, 141(1): 113-119.
[16] Sugimoto H, Yang C, LeBleu VS, et al. BMP-7 functions as a novel hormone to facilitate liver regeneration[J]. FASEB J, 2007, 21(1): 256-264.
[17] Peng Y, Kang Q, Cheng H, et al. Transcriptional characterization of bone morphogenetic proteins (BMPs)-mediated osteogenic signaling[J]. J Cell Biochem, 2003, 90(6): 1149-1165.
[18] Luther G, Wagner ER, Zhu G, et al. BMP-9 induced osteogenic differentiation of mesenchymal stem cells: molecular mechanism and therapeutic potential[J]. Curr Gene Ther, 2011, 11(3): 229-240.
[19] Forte G, Minieri M, Cossa P, et al. Hepatocyte growth factor effects on mesenchymal stem cells: proliferation, migration, and differentiation[J]. Stem Cells, 2006, 24(1): 23-33.
[20] Lee BS, Park M, Cha HY, et al. Hepatocyte growth factor induces delayed STAT3 phosphorylation through interleukin-6 expression[J]. Cell Signal, 2009, 21(3): 419-427.
The effecf of bone morphogenetic proteins 2, 7 in inducing murine embryonic stem cells into hepatic cells in vitro
CHEN Cong, KANG Quan*, LUO Qing, DIE Xiao-hong, TIAN Wen
Ministry of Education Key Laboratory of Child Development and Disorders, Key Laboratory of Pediatrics in Chongqing, Chongqing International Science and Technology Cooperation Center for Child Development and Disorders, Department of Hepatobiliary Surgery, Children's Hospital of Chongqing Medical University, Chongqing 400014, China
*
, E-mail: kq1028@yahoo.com
This work was supported by the National Natural Science Foundation of China (30973062, 81172545), the Natural Science Foundation of Chongqing Province (CSTC2012jjA10120) and the Key Subject of Chongqing Medical University (XBZD201015)
ObjectiveTo explore the effect of recombinant adenovirus-mediated bone morphogenetic proteins 2, 7 (Adv-BMP2, Adv-BMP7) in inducing transformation of murine embryonic hepatic progenitor cells to mature hepatic-like cells.MethodsHP14.5 cells were divided into 4 groups, and then infected by recombinant adenovirus expressing BMP2, BMP7, hepatocyte growth factor (HGF), and green fluorescent protein (GFP), respectively. For investigating the differential regulation of HP14.5 cells, the luciferase report gene was detected at the 1st, 4th and 7th day post infection, the expression of hepatocyte marker albumin (ALB) was detected at the 7th day after infection by cellular immunofluorescence assay. The maturation and differentiation of HP14.5 cells were examined by PAS staining and urea nitrogen synthesis of the cells at day 4, 7 and 10 post-infection.ResultsThe expression of ALB with BMP2 and HGF increased significantly compared to that in GFP control group tested by luciferase report gene; cellular immunofluorescence assay indicated that the specific marker of mature hepatocyte ALB was strong expressed at day 7 post-infection, while a negative result was observed in the GFP control group; HP14.5 cells infected with BMP2 and HGF have also acquired functional characteristics of hepatocytes which synthesized and secreted urea nitrogen, and stored glycogen. However, less inductive activity was found in BMP7 group.ConclusionBMP2 may induce the differentiation of HP14.5 cells into mature hepatocyte-like cells with initial synthesis and secretion, but BMP7 may have no such a capability.
bone morphogenetic proteins; hepatic progenitor cells; cell differentiation; recombinant adenovirus
R329.21;R329.28;R394.2
A
0577-7402(2013)04-0260-05
2012-09-07;
2013-01-10)
(责任编辑:张小利)
国家自然科学基金(30973062、81172545);重庆市自然科学基金(CSTC2012jjA10120);重庆医科大学校际重点课题(XBZD201015)
陈聪,住院医师,硕士研究生。主要从事肝脏干细胞诱导分化方面的研究
400014 重庆 儿童发育疾病研究省部共建教育部重点实验室、儿科学重庆市重点实验室、重庆市儿童发育重大疾病诊治与预防国际科技合作基地、重庆医科大学附属儿童医院肝胆外科(陈聪、康权、罗庆、迭小红、田雯)
康权,E-mail:kq1028@yahoo.com
