衣霉素对顺铂诱导人宫颈癌细胞凋亡的影响
2013-04-01徐冶李质馨曹慧玲于洋刘师兵王晓军
徐冶,李质馨,曹慧玲,于洋,刘师兵,王晓军
顺铂(cisplatin,CDDP)是临床广泛用于治疗实体瘤的有效化疗药物之一,但其毒副作用和治疗中的获得性耐药限制了其应用[1]。顺铂通过损伤DNA杀死肿瘤细胞的机制已被普遍认可[2-4],但有报道认为顺铂能诱导内质网应激和非核依赖的凋亡信号活化[5-7]。本课题组在用人宫颈癌HeLa细胞进行的研究中也发现了明显的内质网应激 (endoplasmic reticulum stress,ER stress)现象,但其与顺铂化疗作用之间的关系还不清楚。为此,本研究采用内质网应激诱导剂衣霉素(tunicamycin,TUNI)与顺铂合用,观察增加内质网应激水平对顺铂诱导HeLa细胞凋亡的影响,探讨顺铂诱导的内质网应激在肿瘤化疗中的作用,为临床应用提供实验依据。
1 材料与方法
1.1 实验材料和试剂 顺铂为山东齐鲁制药有限公司产品(批号∶ 705021CF),用生理盐水配制成1000mg/L的储存液,过滤除菌,4℃保存,用时采用IMDM培养基(Gibco公司)稀释至所需浓度。前Caspase-3(pro-Caspase-3)、活化Caspase-3(active-Caspase-3)兔单克隆抗体及Caspase-4兔多克隆抗体购自英国Abcam公司,磷酸化H2AX组蛋白(ɣ-H2AX)兔单克隆抗体购自美国Cell Signalling公司,蛋白质二硫键异构酶(PDI)小鼠单克隆抗体、β-actin小鼠单克隆抗体、FITC标记的山羊抗兔抗体、Texas-red标记的山羊抗小鼠抗体均购自美国Santa Cruz公司,辣根酶标记山羊抗兔抗体、辣根酶标记山羊抗小鼠抗体购自北京中杉金桥生物公司,Hoechst 33342荧光染料、二氨基联苯胺(DAB)购于北京鼎国公司,四甲基偶氮唑蓝(MTT)、衣霉素(tunicamycin,TUNI)购自美国Sigma公司。
1.2 实验方法
1.2.1 细胞培养 人宫颈癌HeLa细胞株由吉林大学白求恩医学院病理生理学系惠赠,用含10%小牛血清(杭州四季青生物工程材料有限公司)的IMDM培养基(青、链霉素各100U/ml)于37℃、5%CO2、饱和湿度的培养箱中培养,0.25%胰蛋白酶消化传代,取对数生长期细胞用于实验。
1.2.2 MTT法检测 取对数生长期细胞以5×104/ml密度接种于96孔板,每孔100μl,培养24h。实验分组设置:衣霉素(5mg/L)组、顺铂(6mg/L)组、衣霉素(5mg/L)与顺铂(6mg/L)联合给药组、阴性对照组(不加药物),同时设单加培养液的空白对照,每组设3个复孔。药物作用12h后每孔加入MTT 20μl,作用4h,吸去培养液,每孔加入DMSO 150μl,震荡10min,于Model 680型酶标仪(美国Bio-Rad公司)490nm波长处测定光密度(A490)值,每孔测3次,取平均值。细胞生长抑制率=1-(实验组A490值-空白组A490值)/(阴性对照组A490值-空白组A490值)×100%。
1.2.3 Hoechst 33342荧光染色检测细胞核形态高压消毒后无菌盖玻片置于24孔板,取对数生长期细胞,调整细胞密度为1×105/ml,每孔500μl接种过夜,次日细胞生长至80%融合,实验分组及处理同1.2.2。药物作用12h后,弃培养基,加入200μl固定液(4%多聚甲醛)作用10min,吸去固定液,加0.01mol/L PBS洗涤后,吸尽液体,加200μl Hoechst 33342染色液染色5min,再用0.01mol/L PBS洗涤,抗荧光淬灭剂封固,激光共聚焦显微镜观察。每组随机选取6个视野,计数核碎裂细胞比例,重复3次,取平均值。
1.2.4 免疫印迹法检测凋亡蛋白Caspase-3、Caspase-4活化 细胞分组及处理同1.2.2。提取细胞总蛋白,定量,取60μg蛋白进行电泳(SDS-PAGE胶浓度12%),电转至PVDF膜,用5%脱脂奶粉室温封闭1h,分别加入1∶200稀释前Caspase-3兔单克隆抗体、活化Caspase-3兔单克隆抗体、Caspase-4兔多克隆抗体和β-actin小鼠单克隆抗体,4℃孵育过夜后,用TBST洗3次,再分别加入1∶1000稀释的相应二抗(辣根酶标记山羊抗兔抗体、辣根酶标记山羊抗小鼠抗体),室温孵育1h,TBST洗3次,DAB显色。上海天能凝胶成像系统(Tanon 2500R)采集图像,SPSS 16.0软件定量分析实验结果。
1.2.5 间接免疫荧光法检测PDI、ɣ-H2AX表达细胞爬片及给药方法同1.2.3。爬片经4%多聚甲醛固定,用含0.1% Triton的PBS作用5min,0.01mol/L PBS洗涤,非免疫山羊血清封闭30min,分别加入一抗(ɣ-H2AX 兔单克隆抗体、PDI小鼠单克隆抗体,1∶200)4℃过夜,0.01mol/L PBS洗涤,分别加入荧光二抗(FITC标记的山羊抗兔抗体、Texas-red标记的山羊抗小鼠抗体,1∶400)作用30min,0.01mol/L PBS洗涤,抗荧光淬灭剂封固,激光共聚焦显微镜观察。FITC的激发波长488nm,发射波长525nm,呈现绿色荧光;Texas-red的激发波长589nm,发射波长615nm,呈现红色荧光。
1.3 统计学处理 采用SPSS 16.0软件进行统计学分析,组间比较采用One-way ANOVA法,进一步两两比较采用Tamhane法,P<0.05为差异有统计学意义。
2 结 果
2.1 顺铂及衣霉素对HeLa细胞的生长抑制作用 衣霉素组、顺铂组、联合给药组和阴性对照组的细胞增殖抑制率分别为2.65%±2.71%、19.60%±4.34%、44.69%±7.07%、0,组间比较差异有统计学意义(P<0.05)。进一步两两比较显示,联合给药组细胞增殖抑制率显著高于顺铂组(P=0.011)、衣霉素组(P=0.003)和阴性对照组(P=0.006),顺铂组的细胞增殖抑制率显著高于衣霉素组(P=0.007)和阴性对照组(P=0.017),而衣霉素组与阴性对照组比较差异无统计学意义。
2.2 细胞核形态学改变 Hoechst 33342荧光染色结果显示,活细胞所发荧光较弱且均匀,顺铂组和联合给药组部分HeLa细胞核明显变小并呈现致密强荧光,部分细胞核呈碎块状,且联合给药组核碎裂细胞比例(44.5%±5.1%)显著高于顺铂组(22.7%±3.9%,P<0.05,图1)。
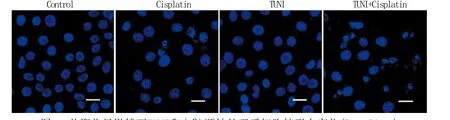
图1 共聚焦显微镜下TUNI和(或)顺铂处理后细胞核形态变化(Bar=20μm)Fig. 1 Morphological changes of nuclear after cisplatin and/or TUNI treatment (Confocal microscope, Bar=20μm)
2.3 凋亡蛋白Caspase-3、Caspase-4的表达改变免疫印迹法检测显示,顺铂组即可见裂解Caspase-3、裂解Caspase-4蛋白表达明显增加,而联合给药组裂解Caspase-3、裂解Caspase-4蛋白表达显著高于顺铂组(P<0.05,图2)。
2.4 PDI和ɣ-H2AX的表达改变 间接免疫荧光法检测显示,阴性对照组胞质内无明显PDI表达,荧光较弱;衣霉素组、顺铂组的PDI蛋白均呈颗粒状,分布于核周,荧光较强;联合给药组可见大部分细胞内PDI呈现明显强荧光,荧光强度明显高于衣霉素组和顺铂组(图3)。
对细胞核DNA断裂标志物ɣ-H2AX进行检测显示,阴性对照组及衣霉素组细胞核内未见明显荧光,顺铂组与联合给药组均可见部分细胞核内出现明显绿色荧光,但两组无明显差别(图4),表明衣霉素并未增加顺铂对核DNA的损伤。

图2 TUNI对顺铂诱导HeLa细胞裂解Caspase-3、Caspase-4蛋白表达的影响Fig. 2 Effects of TUNI on the protein expression of Cleaved caspase-3 and Cleaved caspase-4 in cisplatin-induced HeLa cells(1)P<0.05 compared with control group; (2)P<0.05 compared with cisplatin group; (3)P<0.05 compared with TUNI group
3 讨 论
顺铂是治疗宫颈癌的常用化疗药物之一,但后续的耐药和毒副作用限制了其使用。虽然顺铂对各种实体瘤具有良好的治疗效果,但作用机制还不十分清楚。作为细胞毒性药物,普遍认为顺铂杀伤肿瘤的作用机制是通过损伤DNA和抑制DNA合成激活多种信号途径,从而导致细胞死亡[2]。内质网应激是细胞应答环境因素作用的关键反应,研究表明,肿瘤的微环境变化(葡萄糖耗竭、缺氧)[8]或抗肿瘤药物可诱导内质网应激,表现为内质网腔内错误折叠、未折叠蛋白质聚集以及细胞内Ca2+平衡紊乱等[9-11]。许多参与执行内质网应激反应的成分既能促进细胞存活,又能触发细胞死亡。内质网应激反应的初始作用是通过建立稳态或使损伤效果弱化而实现对应激细胞的保护,但其稳态维持作用并非无限,当内质网应激变得更严重时,这一系统转为发挥促凋亡调节作用,从而触发细胞死亡[12]。
在多种细胞凋亡诱导途径中均存在凋亡执行蛋白Caspase-3的激活,裂解形式的Caspase-3可通过裂解特异性底物促进凋亡[13-14]。已有报道证实,顺铂可诱导内质网应激[5-7]。发生内质网应激时,内质网腔内的PDI表达增加[15-16]。Caspase-4被认为是内质网应激介导凋亡的特异性标志分子之一[17]。本研究证实,顺铂可诱导HeLa细胞发生凋亡,其中有内质网应激途径凋亡的参与;衣霉素可增加凋亡蛋白Caspase-3、Caspase-4的活化,可能也可通过内质网应激途径促进凋亡。
为了明确顺铂诱导的内质网应激在肿瘤细胞凋亡中的作用,本研究联合应用内质网应激诱导剂衣霉素及顺铂,结果表明顺铂可诱导HeLa细胞发生内质网应激,衣霉素与顺铂联合应用提高了细胞的内质网应激水平,此外,衣霉素增加了内质网应激标志物PDI的表达,但不影响细胞核DNA损伤情况,表明衣霉素是通过提高内质网应激水平而不是通过增加细胞核DNA损伤促进顺铂诱导的细胞凋亡。
最近有研究发现,内质网和线粒体之间存在物理性和功能性的联系,内质网上的某些凋亡调节蛋白可以调节这两个凋亡调节关键细胞器的功能状态,从而决定细胞的生存或死亡[18-19]。既往观点认为,内质网应激可以启动促存活机制及死亡程序,特别是在存在持久的内质网应激和细胞器损伤的条件下,这种未折叠蛋白反应 (unfolded Protein response,UPR)信号可以阻止或促进药物介导的细胞杀伤作用,并且其效果可能取决于肿瘤的类型及所使用的细胞毒性药物种类。考虑到治疗效果,那些能够激活UPR促凋亡途径同时抑制其促存活功能的药物,可能获得最大的治疗优势。
综上所述,用内质网应激诱导剂衣霉素增加内质网应激水平,可显著增加顺铂诱导的HeLa细胞凋亡,表明内质网应激调节的凋亡途径在顺铂诱导的HeLa细胞死亡中具有重要作用,该结果为进一步明确顺铂杀伤宫颈癌细胞的作用机制提供了新的线索,也为临床化疗方案的制定提供了实验依据。
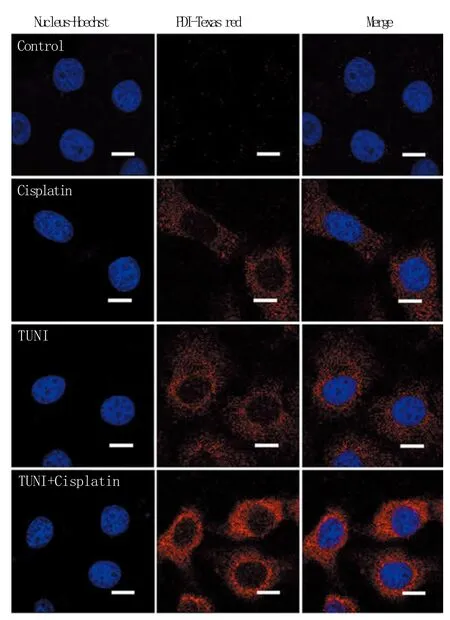
图3 TUNI对顺铂诱导Hela细胞PDI蛋白表达的影响Fig. 3 Expression of PDI after cisplatin and/or TUNI treatment Texas red-conjugated secondary antibody, bar=10μm
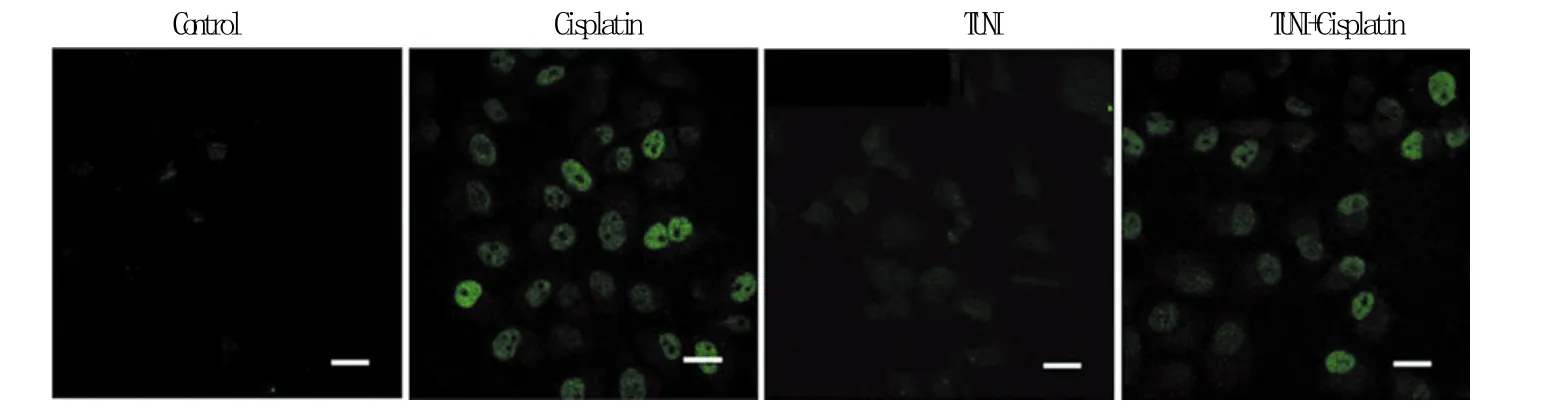
图4 TUNI和(或)顺铂对Hela细胞中ɣ-H2AX蛋白表达的影响Fig.4 Effects of cisplatin and/or TUNI on the expression of ɣ-H2AX FITC-conjugated secondary antibody, bar=20μm
[1] Shen DW, Pouliot LM, Hall MD, et al. Cisplatin resistance∶a cellular self-defense mechanism resulting from multiple epigenetic and genetic changes [J]. Pharmacol Rev, 2012, 64 (3)∶706-721.
[2] Basu A, Krishnamurthy S. Cellular responses to Cisplatininduced DNA damage [J]. J Nucleic Acids, 2010∶ 201367.
[3] Hao XQ, Zhang LX, Sun L, et al. Effects of NS-398 combined with cisplatin on apoptosis and proliferation of Eca-109 cells[J].J Zhengzhou Univ (Med Sci), 2010, 45(5)∶ 713-716. [郝秀轻,张林西, 孙黎, 等. NS-398联合顺铂对Eca-109细胞增殖及凋亡的影响[J]. 郑州大学学报(医学版), 2010, 45(5)∶ 713-716.]
[4] He CR, Zhong M, Sun AM, et al. Expressions of zinc-finger protein 217(ZNF217)in DDP-sensitive and-resistant human ovarian cancer cell lines[J]. Med J Chin PLA, 2009, 34(8)∶ 980-982. [何春容, 钟梅, 孙爱民, 等. 卵巢癌细胞系顺铂化疗敏感株与耐药株中ZNF217的表达[J]. 解放军医学杂志, 2009,34(8)∶ 980-982.]
[5] Mandic A, Hansson J, Linder S, et al. Cisplatin induces endoplasmic reticulum stress and nucleus-independent apoptotic signaling[J]. J Biol Chem, 2003, 278 (11)∶ 9100-9106.
[6] Yu F, Megyesi J, Price PM. Cytoplasmic initiation of cisplatin cytotoxicity[J]. Am J Physiol Renal Physiol, 2008, 295 (1)∶F44-F52.
[7] Chen R, Dai RY, Duan CY, et al. Unfolded protein response suppresses cisplatin-induced apoptosis via autophagy regulation in human hepatocellular carcinoma cells [J]. Folia Biol (Praha),2011, 57(3)∶ 87-95.
[8] Yang HY, Liu XW, Ma YF, et al. Effects of acidic reperfusion fluid on myocardial endoplasmic reticulum stress and apoptosis after ischemia/reperfusion in rabbits[J]. Med J Chin PLA, 2011,36(1)∶ 31-34. [杨海燕, 刘新伟, 马亚飞, 等. 低pH液复灌对兔缺血再灌注心肌内质网应激与细胞凋亡的影响研究[J]. 解放军医学杂志, 2011, 36(1)∶ 31-34.]
[9] Rasheva VI, Domingos PM. Cellular responses to endoplasmic reticulum stress and apoptosis[J]. Apoptosis, 2009, 14 (8)∶ 996-1007.
[10] Luo B, Lee AS. The critical roles of endoplasmic reticulum chaperones and unfolded protein response in tumorigenesis and anticancer therapies[J]. Oncogene, 2013, 32 (7)∶ 805-818.
[11] Zhong JT, Xu Y, Yi HW, et al. The BH3 mimetic S1 induces autophagy through ER stress and disruption of Bcl-2/Beclin 1 interaction in human glioma U251 cells[J]. Cancer Lett, 2012,323 (2)∶ 180-187.
[12] Woehlbier U, Hetz C. Modulating stress responses by the UPRosome∶ a matter of life and death[J]. Trends Biochem Sci,2011, 36 (6)∶ 329-337.
[13] Alenzi FQ, Lotfy M, Wyse R. Swords of cell death∶ caspase activation and regulation[J]. Asian Pac J Cancer Prev, 2010, 11(2)∶ 271-280.
[14] Estaquier J, Vallette F, Vayssiere JL, et al. The mitochondrial pathways of apoptosis[J]. Adv Exp Med Biol, 2012, 942∶157-183.
[15] Lee AS. GRP78 induction in cancer∶ therapeutic and prognostic implications[J]. Cancer Res, 2007, 67(8)∶ 3496-3499.
[16] Xu Y, Yu HM, Qin HJ, et al. Inhibition of autophagy enhances cisplatin cytotoxicity through endoplasmic reticulum stress in human cervical cancer cells[J]. Cancer Lett, 2012, 314 (2)∶ 232-243.
[17] Hitomi J, Katayama T, Eguchi Y, et al. Involvement of caspase-4 in endoplasmic reticulum stress-induced apoptosis and Abetainduced cell death[J]. J Cell Biol, 2004, 165(3)∶ 347-356.
[18] Iwasawa R, Mahul-Mellier AL, Datler C, et al. Fis1 and Bap31 bridge the mitochondria-ER interface to establish a platform for apoptosis induction[J]. EMBO J, 2011, 30(3)∶ 556-568.
[19] Grimm S. The ER-mitochondria interface∶ the social network of cell death[J]. Biochim Biophys Acta, 2012, 1823(2)∶ 327-334.
