调节性树突细胞对皮肤移植小鼠IL-10+调节性B细胞的影响
2013-08-02魏玉香周文强肖漓郑德华齐帜蔡明钱叶勇于涛廖珂石炳毅
魏玉香,周文强,肖漓,郑德华,齐帜,蔡明,钱叶勇,于涛,廖珂,石炳毅
调节性树突细胞对皮肤移植小鼠IL-10+调节性B细胞的影响
魏玉香,周文强,肖漓,郑德华,齐帜,蔡明,钱叶勇,于涛,廖珂,石炳毅
目的探讨吞噬了供者凋亡淋巴细胞的未成熟树突细胞(imDC)对皮肤移植受体小鼠外周血IL-10+CD19+调节性B细胞(Breg)比例及移植物存活时间的影响。方法以C57BL/6小鼠作为受者,BALB/c小鼠为供者,建立小鼠皮肤移植模型。分离C57BL/6小鼠骨髓细胞,经小鼠重组白细胞介素4(IL-4)和粒-巨噬细胞集落刺激因子(GM-CSF)共同诱导,制备并培养imDC。分离BALB/c小鼠脾淋巴细胞(SP),经光化学照射方法(PUVA)处理,得到供者小鼠脾淋巴细胞(PUVA-SP)。在体外将PUVA-SP与C57BL/6小鼠骨髓来源的imDC共同培养,得到PUVA-SP DCs。根据受体小鼠术前接受的静脉输注成分将其随机分为4组(n=14):PUVA-SP DC组、imDC组、成熟树突细胞(maDC)组和PBS对照组。于手术前7d分别从尾静脉注入1×l06个(0.2ml)PUVA-SP DC、imDC、maDC或0.2ml PBS。于移植术后观察受体小鼠的移植物存活时间、外周血IL-10+CD19+Breg比例及IL-10的表达情况。结果移植术后,受体小鼠外周血IL-10+CD19+Breg细胞占CD19+B细胞的比例在PUVA-SP DC组为7.48%,明显高于imDC组(4.12%)、maDC组(3.01%)和PBS对照组(2.37%)。PUVA-SP DC组小鼠血清中IL-10表达水平为58.2±0.9ng/ml,与maDC组(20.1±1.6ng/ml)、imDC组(26.2±1.3ng/ml)及PBS对照组(19.0±0.6ng/ml)比较显著升高(P<0.01)。PUVA-SP DC组移植物存活时间为62.3±2.6d,显著长于maDC组(20.7±1.9d)、imDC组(12.1±1.0d)和PBS对照组(11.0±1.3d,P<0.01)。结论移植术前输注PUVA-SP DCs可显著延长移植物存活时间,增加受者体内IL-10的表达水平,诱导产生较多分泌IL-10的调节性B细胞。
树突细胞;皮肤移植;调节性B细胞
树突细胞(dendritic cells,DC)作为体内最有效的抗原呈递细胞,不但具有免疫激活作用,而且在一定状态下可诱导免疫耐受[1-2]。本课题组前期制备了一种未成熟的树突状细胞(immature dendritic cells,imDC),在吞噬了异基因供体大鼠凋亡淋巴细胞后仍然维持不成熟状态,由于采用了光化学照射的方法(如PUVA)处理异基因供体大鼠淋巴细胞促使其发生凋亡,故将这种imDC命名为PUVA-SP DC。给移植受者输注这种PUVA-SP DC能诱导受者T细胞的免疫低反应性,使受者CD4+CD25+Foxp3+Treg比例明显增加,移植物存活时间明显延长[3],提示其具有负向免疫调节作用。B细胞除了能通过产生抗体在体液免疫中发挥中心作用以外,还具有免疫调节作用。为了探讨皮肤移植受体小鼠接受具有独特调节功能的PUVA-SP DC会对小鼠体内B细胞产生何种效应,本实验建立了小鼠皮肤移植模型,研究负载供者PUVA-SP的受者imDC对移植小鼠产生分泌IL-10的调节性B细胞的影响。
1 材料与方法
1.1 实验动物 BALB/c(H-2d)、C57BL/6(H-2Kb)近交系小鼠,4~6周龄,雄性,SPF级,由北京维通利华实验动物有限公司提供。
1.2 实验器材与试剂 长波紫外线(UVA)光源为北京电光源研究所研制。紫外线照射仪购自北京师范大学。autoMACS细胞分选仪为德国Miltenyi Biotec产品。FACS Calibur流式细胞仪为美国Bacton Dickinson产品。小鼠重组白细胞介素4(rmIL-4)和重组粒-巨噬细胞集落刺激因子(rmGM-CSF)购自Peprotech公司。小鼠淋巴细胞分离液为天津市TBD生物技术发展中心产品。胎牛血清、RPMI 1640培养基均购自PAA Laboratories。脂多糖(LPS)、光敏剂8-甲氧基补骨脂素(8-methoxypsoralen,8-MOP)购于Sigma公司。抗CD11c 磁珠购自Miltenyi Biotec公司。荧光素标记的单抗CD19、IL-10以及同型对照抗体购自BD PharMingen公司。细胞因子IFN-γ、IL-10 ELISA检测试剂盒为R&D公司产品。
1.3 C57BL/6小鼠未成熟树突细胞(imDC)和成熟树突细胞(maDC)的培养 骨髓来源的小鼠树突细胞的培养参考Inaba等[4]的方法并稍作改进:颈椎脱位法处死C57BL/6小鼠,无菌取股骨和胫骨,用注射器反复冲洗,收集得到骨髓细胞悬液,1 000×g离心5min,弃上清,加入2ml无菌Tris-NH4Cl溶液裂解红细胞,1 000×g离心5min,弃上清。洗涤后的细胞用含10% 胎牛血清(FCS)、20ng/ml rmGM-CSF、10ng/ml rmIL-4的RPMI 1640培养基悬浮,分至6孔培养板中,每孔加入约4ml培养基,细胞密度2×106/ml。细胞在37℃、含5%CO2的孵箱中培养48h后,轻轻吹洗除去悬浮细胞,仅保留疏松贴壁细胞,加入新鲜的含10% FCS、20ng/ml rmGM-CSF、10ng/ml rmIL-4的RPMI 1640培养基,取5~6d时的未成熟imDC在低浓度LPS(10ng/ml)刺激下继续培养至第8天以达到成熟状态。用吸管轻轻吹打后收集所有悬浮细胞,无菌条件下用抗CD11c磁珠进行分选,可得到实验所需骨髓来源的小鼠imDC和maDC。
1.4 BALB/c小鼠脾淋巴细胞悬液(SP)的制备及PUVA处理 颈椎脱位法处死BALB/c小鼠,无菌切取脾脏,移入4℃ PBS中,剪碎后经100目筛网充分研磨,200目筛网过滤去除残渣,获单细胞悬液,采用淋巴细胞分离液Ficoll密度梯度法,以1 600r/min离心20min,取单个核细胞层,加RPMI 1640液重复洗涤2次,并悬浮细胞,置塑料平皿中,在37℃、5%CO2孵箱中孵育30min后,除去贴壁的单核细胞,获得悬浮的脾淋巴细胞,台盼蓝染色法计算活细胞百分率,活细胞>90%用于实验。
采用8-MOP联合A波段长波紫外线(UVA)照射的体外光化学方法(psoralen+UVA treatment for eczema,psoriasis,graft-versus-host disease,PUVA)处理鼠脾淋巴细胞。向上述脾淋巴细胞中加入200ng/ml 8-MOP,在37℃、5%CO2、饱和湿度孵箱中孵育20min,然后在距离UVA光源20cm处直接照射9min,照射强度2J/cm2。照射结束后,用RPMI 1640重复洗涤2次;用含10%FCS的RPMI 1640完全培养液悬浮细胞,在37℃、5%CO2、饱和湿度孵箱中继续培养过夜,即得到PUVA处理后的供者小鼠脾淋巴细胞(PUVA-SP)。
1.5 吞噬经PUVA处理的异基因淋巴细胞的树突细胞(PUVA-SP DC)的制备 在DC培养的第6天,加入经PUVA处理的小鼠脾淋巴细胞(PUVA-SP),以PUVASP:DC=5:1的比例,共培养16h,去除悬浮细胞,即可得到吞噬PUVA-SP的imDC,称为PUVA-SP DC。
1.6 小鼠皮肤移植排斥模型的建立 以BALB/c小鼠为供体,C57BL/6小鼠为受体。供体鼠剪毛后,浸入0.5%新洁尔灭溶液中消毒15min,取躯干部全层皮肤,清除皮下组织,制成直径18mm的圆形皮片,保存于4℃生理盐水中备用。受体鼠在戊巴比妥钠(60mg/kg)麻醉下,剪去背部相应面积的皮肤,彻底止血后植入供皮皮片。
1.7 实验分组及处理 在皮肤移植前将受体鼠分为4组(n=14):PUVA-SP DC组、imDC组、maDC组和PBS对照组,根据分组在移植手术前7d经尾静脉分别注射1×l06个PUVA-SP DC、imDC、maDC或等体积(0.2ml)PBS。
1.8 外周血细胞因子检测 于术后6d取尾静脉血,分离血清,ELISA法检测受者外周血中IL-10和IFN-γ浓度,具体操作按试剂盒说明书进行。
1.9 IL-10+CD19+调节性B(Breg)细胞比例的检测对CD19+B细胞进行染色,计算IL-10+CD19+Breg细胞的比例。染色参考Yanaba等[5]的方法并稍作改进:将纯化的外周血淋巴细胞(2×106/ml)重悬于RPMI 1640培养基,加入刺激剂LPS(10μg/ml)、佛波酯(PMA,50ng/ml)、离子霉素(ionomycin,500ng/ml),同时加入布雷菲德菌素(abrefeldin A,10μg/ml),置37℃、5%CO2、饱和湿度的培养箱中培养6h,收集细胞,使用BD Cytofix/CytopermTM试剂盒进行细胞内染色,具体操作按试剂盒说明书进行,最后应用流式细胞仪对IL-10+CD19+Breg细胞进行计数。
1.10 统计学处理 应用SPSS 15.0软件进行统计分析,计量资料以±s表示,组间比较采用单因素方差分析。P<0.05为差异有统计学意义。
2 结 果
2.1 受体鼠血清IL-10的表达水平 PUVA-SP DC组、maDC组、imDC组和PBS对照组小鼠血清IL-10水平分别为58.2±0.9、20.1±1.6、26.2±1.3和19.0±0.6ng/ml。maDC组与PBS对照组比较差异无统计学意义(P>0.05)。imDC组略高于PBS对照组和maDC组,但差异仍无统计学意义(P>0.05)。PUVASP DC组较PBS对照组、maDC组及imDC组比较显著升高,差异有统计学意义(P<0.01)。
2.2 输注PUVA-SP DC对受体鼠分泌IL-10 B细胞比例的影响 由图1可见,PUVA-SP DC 组小鼠外周血分泌IL-10的B细胞比例为7.48%,明显高于maDC组(3.01%)、imDC组(4.12%)和PBS对照组(2.37%)。maDC组和imDC组小鼠分泌IL-10 B细胞的比例略高于PBS对照组。
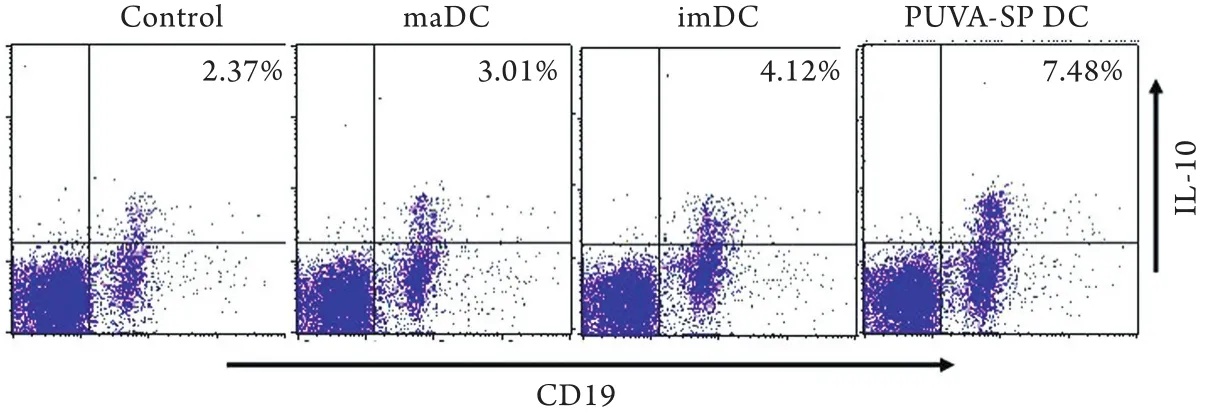
图1 小鼠外周血IL-10+CD19+Breg细胞占CD19+B细胞的比例Fig. 1 Proportion of IL-10+CD19+Breg cells among CD19+B cells in the peripheral blood of mice
2.3 输注PUVA-SP DC对受体小鼠移植皮片存活的影响 PUVA-SP DC组小鼠移植皮片存活期为62.3±2.6d,显著长于maDC组(20.7±1.9d)、imDC组(12.1±1.0d)和PBS对照组(11.0±1.3),差异有统计学意义(P<0.01)。输注maDC、imDC组移植皮片存活时间略长于PBS对照组,但差异无统计学意义(P>0.05,图2)。
3 讨 论
本课题组前期采用PUVA处理外周血淋巴细胞,并促进imDC吞噬PUVA处理后的淋巴细胞,结果发现,PUVA可促使大量大鼠淋巴细胞发生早期凋亡,而大鼠DC吞噬了凋亡的异基因供体大鼠淋巴细胞后,仍能维持其不成熟状态,命名为PUVA-SP DC,其表面分子CD80、CD86、MHC-Ⅱ(OX6)呈低水平表达[3]。给移植受者输注这些DC后,能诱导受者T细胞的免疫低反应性,使受者CD4+CD25+Foxp3+Treg比例明显增加,移植物存活时间明显延长[3]。由此,我们认为PUVA-SP DC具有负向免疫调节功能。
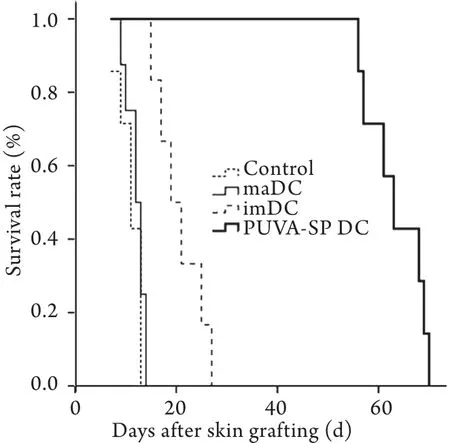
图2 输注不同种类DC对小鼠同种异体皮肤移植存活时间的影响Fig.2 Effect of infusing different types of DC on the survival time of skin allograft in mice
多种免疫效应细胞及其表达的免疫相关分子的相互作用所构成的免疫网络是免疫识别与免疫调控、免疫应答与免疫耐受的基础。免疫系统通过刺激免疫应答和诱导免疫耐受这两种互补的功能维持机体的稳态。在此动态过程中,DC与周围很多免疫细胞存在相互作用,彼此精细调节[6]。近年来,相关研究主要集中在DC和T细胞的相互作用产生的免疫激活或免疫耐受方面[7-9]。B细胞是免疫系统中的主要细胞,能通过产生抗体在体液免疫中发挥核心作用。最近研究表明,与T细胞一样,B细胞也具有异质性,根据其分泌细胞因子的不同,可分为调节性B细胞和效应性B细胞亚群[10-11],其中调节性B细胞主要分泌IL-10或TGF-β1等免疫负向调节因子。2006年,Mizoguchi和Bhan[12]首次使用调节性B细胞的概念来定义具有负向调控功能的B细胞。随后,Evans等[13]发现了过渡2型边缘带前体(transitional 2 marginal zone precursor,T2 MZP) Bregs。T2 MZP Bregs通过产生IL-10抑制CD4+T细胞分化及效应T细胞的活性,从而抑制过度的炎症反应[13-14]。2008年,有研究者发现产生IL-10的B细胞亚群能够抑制T细胞增殖及T细胞介导的炎症反应,他们将B10细胞回输至CD19-/-小鼠体内,发现原本增强的CD4+T细胞依赖性超敏反应恢复至正常水平,并证明B细胞的抗原特异性是通过IL-10介导的抑制功能实现的[5,15]。IL-10是体内重要的免疫负向调控分子,可通过下调主要组织相容性抗原、共刺激分子及抑制多种促炎细胞因子的分泌而诱导耐受性DC、调节性T细胞和Th2细胞的生成,从而直接或间接抑制淋巴细胞的活化,使其在促炎因子的作用下仍能诱导异基因抗原特异性免疫耐受,降低免疫抑制剂的非特异性免疫抑制所造成的感染及肿瘤扩散风险。本研究结果表明,在移植术前输注PUVA-SP DC可显著延长移植物存活时间,在促使受者体内产生较多负向免疫调节因子IL-10的同时,诱导体内产生较多分泌IL-10的Bregs。该结果有助于更好地理解PUVA-SP DC参与免疫调控的机制,丰富调节性树突细胞的负向免疫调控功能,为体外光化学疗法应用于器官移植免疫排斥的治疗提供理论基础。
[1] Beriou G, Moreau A, Cuturi MC. Tolerogenic dendritic cells: applications for solid organ transplantation[J]. Curr Opin Organ Transplant, 2012, 17(1): 42-47.
[2] Shi BY. Review the effects of regulatory dendritic cells in the transplantation inmmunity[J]. Natl Med J Chin, 2011, 91(8): 505-507.[石炳毅. 重新审视调节性树突细胞在移植免疫调节中的作用[J]. 中华医学杂志, 2011, 91(8): 505-507.]
[3] Zheng DH, Dou LP, Wei YX, et al. Uptake of donor lymphocytes treated with 8-methoxypsoralen and ultraviolet A light by recipient dendritic cells induces CD4+CD25+Foxp3+regulatory T cells and down-regulates cardiac allograft rejection[J]. Biochem Biophys Res Commun, 2010, 395(4): 540-546.
[4] Inaba K, Inaba M, Romani N, et al. Generation of large numbers of dendritic cells from mouse bone marrow cultures supplemented with granulocyte/macrophage colony-stimulating factor[J]. J Exp Med, 1992, 176(6): 1693-1702.
[5] Yanaba K, Bouaziz JD, Haas KM, et al. A regulatory B cell subset with a unique CD1dhiCD5+phenotype controls T celldependent inflammatory responses[J]. Immunity, 2008, 28(5): 639-650.
[6] Shi BY. Effects of regulatory network of immunocytes in the transplantation immunity[J]. Natl Med J Chin, 2011, 91(44): 3154-3157.[石炳毅. 调节性免疫细胞网络在移植免疫中的作用[J]. 中华医学杂志, 2011, 91(44): 3154-3157.]
[7] Zhang DH, Lu H, Shi BY, et al. Induction effects of dendritic cells loaded with PUVA-treated allogeneic cells on alloantigenspecific CD4+CD25+Foxp3+T regulatory cells in vitro[J]. Med J Chin PLA, 2010, 35(5): 543-546.[郑德华, 陆宏, 石炳毅, 等.吞噬PUVA处理的同种异基因细胞的树突细胞对抗原特异性CD4+CD25+Foxp3+调节T细胞的体外诱导作用[J]. 解放军医学杂志, 2010, 35(5): 543-546. ]
[8] Zheng DH, Shi BY, Zou YP, et al. Effect of a novel negative immunoregulatory dendritic cell on Th1/Th2 balance of cardiac allograft recipient rats[J]. Med J Chin PLA, 2009, 34(6): 715-718.[郑德华, 石炳毅, 邹一平, 等. 负向免疫调节树突细胞对心脏移植大鼠Th1/Th2类细胞因子的影响[J]. 解放军医学杂志, 2009, 34(6): 715-718.]
[9] 郑智茵, 陈均法, 沈建平, 等. 青蒿琥酯诱导凋亡U937细胞负载树突细胞后介导的免疫应答[J]. 中国实用内科杂志, 2007, 27(Suppl 1): 86-87.[Zheng ZY, Chen JF, Shen JP, et al. Dendritic cell-induced immune response after phagocytizing Artesunate-leading apoptotic U937 cells[J]. Chin J Pract Intern Med, 2007, 27(Suppl 1): 86-87.]
[10] Shi BY, Xiao L, Gao Y. Identification and exploration of function of Tim-1+CD19+regulatory B cells in peripheral blood in recipients of kidney transplantation[J]. Natl Med J Chin, 2011, 91(48): 3388-3392.[石炳毅, 肖漓, 高钰. Tim-1+CD19+调节性B细胞在肾移植受者外周血的鉴定与功能研究[J]. 中华医学杂志, 2011, 91(48): 3388-3392.]
[11] Wojciechowski W, Harris DP, Sprague F, et al. Cytokineproducing effector B cells regulate type 2 immunity to H. polygyrus[J]. Immunity, 2009, 30(3): 421-433.
[12] Mizoguchi A, Bhan AK. A case for regulatory B cells[J]. JImmunol, 2006, 176(2): 705-710.
[13] Evans JG, Chavez-Rueda KA, Eddaoudi A. Novel suppressive function of transitional 2 B cells in experimental arthritis[J]. J Immunol, 2007, 178(12): 7868-7878.
[14] Blair PA, Chavez-Rueda KA, Evans JG, et al. Selective targeting of B cells with agonistic anti-CD40 is an efficacious strategy for the generation of induced regulatory T2-like B cells and for the suppression of lupus in MRL/lpr mice[J]. J Immunol, 2009, 182(6): 3492-3502.
[15] Watanabe R, Ishiura N, Nakashima H, et al. Regulatory B cells (B10 cells) have a suppressive role in murine lupus: CD19 and B10 cell deficiency exacerbates systemic autoimmunity[J]. J Immunol, 2010, 184(9): 4801-4809.
Effect of regulatory dendritic cells on IL-10-producing regulatory B cells of skin allograft in mice
WEI Yu-xiang, ZHOU Wen-qiang, XIAO Li, ZHENG De-hua, QI Zhi, CAI Ming, QIAN Ye-yong, YU Tao, LIAO Ke, SHI Bing-yi*
Organ Transplantation Institute, Beijing Key Organ Transplantation and Immune Regulation Laboratory, 309 Hospital of PLA, Beijing 100091, China
*
, E-mail: shibingyi@medmail.com.cn
The work was supported by the China Postdoctoral Science Fund (200902680 and 20080441308), the Special Fund from Beijing Science & Technology Commission (Z111102055311086) and the National Natural Science Youth Foundation of China (81102242)
ObjectiveTo investigate the effect of recipient immature dendritic cells (imDCs) loaded with PUVA-treated donor apoptotic splenic lymphocytes (PUVA-SP DC) on IL-10+CD19+regulatory B cells (Breg) and the survival duration of skin allograft in mice.MethodsBone marrow-derived DCs of C57BL/6 mice were obtained from bone marrow cells by co-culturing with recombinant mouse IL-4 and GM-CSF. Spleen lymphocytes (SP) of BALB/c mice were isolated and prepared as PUVA- SP by treating the cells with 8-methoxypsoralen plus ultraviolet A irradiation. The bone marrow-derived imDCs of C57BL/6 mice were co-cultured with PUVA-SP of BALB/c mice to obtain PUVA-SP DCs. The skin allograft model was then established. Animals were randomly grouped according to different pretreatments as follows: the control group was iv. introduction of PBS (0.2ml) alone 7 days before skin transplantation, the PUVA-SP DC group
an iv. injection of PUVA-SP DCs, the maDC (mature DC) group received recipient maDCs, and the imDC group was given recipient imDCs. Mice were monitored daily from day 6 after transplantation for signs of rejection of skin graft. The recipients′ peripheral blood serum samples were then collected and the level of cytokines were measured by using ELISA kits. The survival time of skin allograft was evaluated every day. The expression of IL-10+CD19+regulatory B cells was analyzed by flow cytometry.ResultsAfter transplantation, the proportion of IL-10+CD19+Breg in the peripheral blood of PUVA-SP DC group was 7.48%, which was obviously higher than that of imDC group (4.12%), maDC group (3.01%) and control group (2.37%). The serum level of cytokine IL-10 in PUVA-SP DC group was 58.2±0.9ng/ml, and it was significantly higher than that in maDC group (20.1±1.6ng/ml), imDC group (26.2±1.3ng/ml) and control group (19.0±0.6ng/ ml, P<0.01). The survival time of allograft in PUVA-SP DC group was 62.3±2.6d, and it was markedly longer than that in maDC group (20.7±1.9d), imDC group (12.1±1.0d) and control group (11.0±1.3d, P<0.01).ConclusionsAdministration of PUVASP DCs, in the absence of an immunosuppressant, may significantly delay allograft rejection. This effect is associated with upregulation of circulating regulatory B cells with preferential IL-10 secretion.
dendritic cells; skin transplantation; B-lymphocytes, regulatory
R392.4
A
0577-7402(2013)04-0274-05
2013-01-09;
2013-03-04)
(责任编辑:李恩江)
中国博士后基金(200902680,20080441308);北京市科技专项2011阶梯计划项目(Z111102055311086);国家自然科学基金青年基金(81102242)
魏玉香,医学博士。主要从事器官移植免疫方面的研究
100091 北京 解放军309医院全军器官移植研究所,器官移植与免疫调节北京市重点实验室(魏玉香、周文强、肖漓、郑德华、齐帜、蔡明、钱叶勇、于涛、廖珂、石炳毅)
石炳毅,E-mail:shibingyi@medmail.com.cn
