高温下Li2ZrO3吸附CO2的研究进展
2013-07-31张丹
张 丹
(辽宁石油化工大学 化学与材料科学学院, 辽宁 抚顺 113001 )
众所周知,CO2是引起温室效应的气体之一[1],危害人类生存的环境,带来气候变暖等一系列严重后果。它主要来源于人类生活中的对能源的需求,过多燃烧煤炭、石油和天然气等这些化石类燃料产生的。人类活动产生的CO2主要来自于电厂,而电厂产生的CO2温度一般在350 ℃以上。因此开发一种在高温下直接吸收CO2的材料,减少温室气体排放具有重大意义。Li2ZrO3可以在高温下对CO2进行吸附,并可通过调变温度对CO2进行释放、再利用。这一特性引起了广大研究者的关注,近年来已成为研究热点之一[2-5]。
1 Li2ZrO3的合成方法
Li2ZrO3的合成方法大致分为三种:高温固相合成方法[6]、软化学合成方法[7]、溶胶-凝胶法[8]。每一种方法合成出的Li2ZrO3在晶相、粒度、孔径等物理性质上有区别,而这些物理性质在其对CO2的吸附能力上起到决定性的作用。下面就不同的合成方法分别进行讨论。
1.1 高温固相合成方法
用固相反应法合成了 Li2ZrO3材料[9]。原材料采用固态的二氧化锆及碳酸锂、液态的水( 或无水乙醇),利用液体将此两种固体反应物充分混合,加热除去溶剂之后,在高温炉中500~1 000 ℃(不同反应条件温度略有变化)下煅烧 6~12 h, 即可得到Li2ZrO3。因为合成Li2ZrO3的反应是在ZrO2(熔点2 700 ℃)颗粒和Li2CO3(熔点723 ℃)之间进行,由于ZrO2的熔点高,L i2CO3围着固态的ZrO2进行反应,反应产物Li2ZrO3的晶型和颗粒尺寸大小由原材料ZrO2的晶相类型(四方相、单斜相)、粒度大小来控制,从而影响Li2ZrO3吸附CO2的吸附效率及速率,后面我们会论述到。高温固相法的优点是:操作简单、实验步骤少、易于用反应物ZrO2的晶相、粒度控制着产物 Li2ZrO3的晶相、粒度。缺点是:实验需要高温、长期的反应时间,且固相法在制备过程中易引入杂质,合成的材料粒径大,均匀性不好[10]。
1.2 软化学合成方法
软化学合成方法在这里指的是喷雾干燥法[11],Ochoa—Fernandez 等人将 ZnO(NO3)2·2H2O 和CH3COOLi·2H2O 作为前驱体,每一种前驱体在去离子水中进行溶解,然后通过热重分析来标定溶液后,将两种前驱体以一定比例进行混合几个小时,形成混合溶液。将溶液通过喷雾干燥剂(423 K,2 mL·min-1)喷洒干燥,所得到的固体产物在一定温度下进一步氧化、分解,通过Li 和Zr 进行原子级的混合形成粉末,然后粉末在空气中以一定温度进行煅烧,从而形成Li2ZrO3。软化学合成方法的优点是:合成的 Li2ZrO3粉末尺寸小,不到20 nm,可以通过煅烧温度来控制晶体类型(四方相、单斜相)。缺点是:一次合成的材料量很少,在实际应用中受到限制。
1.3 溶胶凝胶法
溶胶凝胶法是制备纳米级Li2ZrO3最常用的方法之一[12]。一般选择Zr 的硝酸盐,Li 的硝酸盐或碳酸盐等。将这两种无机盐在去离子水中进行溶解。另外一方面,选择柠檬酸(CA)、乙二醇(EG)等作为络合剂,利用氨水或尿素将其溶解,并调整溶液的pH 值。将这两种溶液混合,先反应生成无色凝胶,再通过干燥、焙烧形成白色粉末。溶胶凝胶合成法的优点:合成的Li2ZrO3晶粒粒度小(几十个nm),均匀,也可以通过控制煅烧温度来控制晶体类型(四方相、单斜相)而且制备方法简单。缺点是:溶胶凝胶法也有需要高温煅烧,易引入杂质的问题。
2 Li2ZrO3吸附CO2的反应机理
Li2ZrO3吸附CO2的反应方程式如下式所示[13],在500~700 ℃之间Li2ZrO3与CO2反应生成Li2CO3和ZrO2,反应向正反应方向进行。在550~590 ℃时CO2吸附效果最好。升高温度到700 ℃之后,反应开始向逆反应方向进行释放CO2,温度达到780 ℃时效果最好(温度上随反应条件略有变化但规律不变),所以可通过温度控制CO2的吸附/脱附情况。
Li2ZrO3(s)+CO2(g) = Li2CO3(s)+ZrO2(s)
在高温下Li2ZrO3是最有前景的CO2吸附剂之一[14]。然而在Li2ZrO3上CO2的吸附/脱附过程的反应历程到现在仍然不清楚。Ida 等人在大量实验的基础上,提出了Li2ZrO3吸附CO2的双壳机理[15](Double-Shell Mechanism),如图 1 所示。Li2ZrO3吸附CO2之后,由外至内分别是未反应层Li2CO3固体层、ZrO2固体层、和Li2ZrO3。内、外层发生的反应方程式如下式所示:
外层:2Li++ O2-+ CO2= Li2CO3
内层: Li2ZrO3=ZrO2+ O2-+ 2Li+
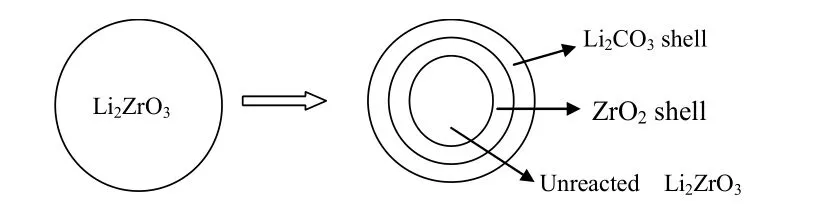
图1 Li2ZrO3 上吸附CO2 的双壳机理模型示意图Fig. 1. Schematic illustration of double-shell model for CO2 sorption on Li2ZrO3
Li2ZrO3表面,Li2ZrO3解离出来的 O2-、Li+和ZrO2。CO2与 O2-、Li+反应生成 Li2CO3,留下 ZrO2。Li2CO3和 ZrO2的熔点都高于 Li2ZrO3吸附 CO2的温度,因此,此时生成的ZrO2和Li2CO3都为固态的。随着反应的进行生成的 Li2CO3的量逐渐增多形成壳层包在最外边,中间是 ZrO2壳层包着未反应的Li2ZrO3。Li2CO3壳层形成之后, CO2可以通过 Li2CO3壳层扩散到ZrO2壳层表面,而里面未反应的Li2ZrO3产生的O2-和Li+,可以通过ZrO2壳层扩撒到其表面。这样在 ZrO2壳层表面,CO2与 O2-和 Li+结合形成Li2CO3,这样碳化过程能够继续进行,但速率下降很多。Li2ZrO3吸附CO2的速率下降主要是受到了上述这两方面的影响。由于O2-和Li+比CO2分子的体积小很多,CO2通过 Li2CO3壳层的扩散速度比 O2-和 Li+通过 ZrO2壳层扩撒的速度慢得多。因此,CO2通过固态Li2CO3壳层的扩散过程更有可能是决速步骤。
在脱附过程中,温度已经被提高到 700 ℃以上,达到780 ℃时,脱附效果最好。此时温度已经高于 Li2CO3的熔点,Li2CO3变成液体(723 ℃)。Li2CO3液体在固体 ZrO2表面上与之进行反应生成CO2和 Li2ZrO3,产生的 CO2通过液态的 Li2CO3扩散到外边,生成的Li2ZrO3在中间形成一个致密的壳层包裹着未反应的 ZrO2。CO2的脱附过程本质上是Li2ZrO3的形成过程。ZrO2结合Li2CO3解离出的O2-和 Li+生成的 Li2ZrO3与刚开始吸附 CO2的 Li2ZrO3的结构是相似的,在高温下吸附CO2的能力是一样的。所以,可以通过温度控制对Li2ZrO3进行循环利用且稳定性很好。
3 影响Li2ZrO3 在高温下吸附CO2 能力的因素
影响 Li2ZrO3在高温下吸附 CO2能力的因素有很多,比较复杂,一般从热力学和动力学两方面考虑。研究出Li2ZrO3在高温下吸附CO2的各种影响因素,能够为制备出在高温下对CO2具有高吸附量、吸附速度快的Li2ZrO3提供理论指导。
3.1 Li2ZrO3 粉末尺寸及结构晶型的影响
Li2ZrO3在高温下吸附 CO2与其自身的晶体结构、粉末尺寸大小有关系。文献报道的CO2的最大吸附率为样品质量增加的29.5%[6]。1μm 的ZrO2颗粒合成的Li2ZrO3吸附率为18%左右,而由4 5μm的 ZrO2颗粒合成的 Li2ZrO3吸附率为 10%左右。随着Li2ZrO3颗粒尺寸变小,吸附速率越快。1μm 的ZrO2颗粒合成的Li2ZrO3吸附率为18%左右需要30 min 而 45μm ZrO2颗粒合成的 Li2ZrO3需要 120 min[8]。Li2ZrO3的晶型对材料的吸附性能有一定的影响,四方相 Li2ZrO3(t) 材料具有较好的吸附性能,吸附率可达25(±0 .6)%( wt )。而单斜相Li2ZrO3(m)材料对 CO2的吸附性能较差,其吸附率仅达 9(±0.6)%( wt ) 左右[6]。
3.2 温度的影响
温度对Li2ZrO3材料吸附CO2性能的影响包括两方面[10,17]:一方面是制备Li2ZrO3材料的合成温度,因为晶型对材料的吸附性能有影响。在较低温度合成的 Li2ZrO3材料为无定形和四方相混合物所以对CO2吸附性能不好,而在800℃合成的Li2ZrO3为四方相,对CO2有着较好的吸附性能,合成温度高于800 ℃以上,合成的Li2ZrO3材料又转变为单斜相,吸附CO2的能力降低。另一方面是Li2ZrO3材料吸附时 CO2的温度, Li2ZrO3材料吸附 CO2的吸附温度为500~590 ℃时,吸附速率最快。温度低于500℃,Li2ZrO3不能吸收CO2或者反应不完全,温度太高,反应不能进行。
3.3 杂质元素的影响
在 Li2ZrO3材料掺杂 K 元素可提高其对CO2的吸附速率[4,18,19]。王银杰、袁文辉等对此进行了研究。这是由于 K 元素的掺杂导致材料的晶体结构发生变化,使材料的晶体结构形成缺陷,晶体缺陷的产生利于提高材料的反应活性,导致Li2ZrO3吸附CO2速率的提高。n (ZrO2)/n (Li2CO3)/n(K2CO3) =1:1:x (摩尔比 ),在 x<0.3 时,材料的吸收容量呈略微增加的趋势,但增加缓慢;当x = 0.3 时,达到吸收的最大值; 当x > 0.3 之后,材料的吸收量明显降低。因此,K2CO3的少量添加对材料吸收CO2的速率有一定的改善,如果添加量过多,反而导致材料吸收性能下降。
3.4 熔盐的影响
Daniel 等对不同熔盐体系对 Li2ZrO3吸附 CO2性能的影响进行了系统而又深入地研究[20],他认为二元/三元熔盐体系能够加快Li2ZrO3材料吸附CO2的速率,因为熔盐体系降低整个体系的熔点,减小了CO2进行扩散受到的阻力,有利于气相CO2的迁移,且含有碳酸盐的熔盐体系比其他熔盐体系的吸附速率快,主要是考虑到共熔的碳酸盐层更有利于气相 CO2的迁移,加快了 Li2ZrO3材料吸附 CO2的速率。
3.5 CO2分压的影响
Esther 等人对CO2分压对Li2ZrO3材料吸收 CO2的速率影响做了系统的研究[21,22]。在不同的CO2气氛下,Li2ZrO3材料吸收 CO2的速率有着明显的不同。在 CO2含量较高的气氛下,Li2ZrO3材料吸收 CO2的速度较快, 而在CO2含量较低的气氛下,Li2ZrO3材料吸收CO2的速度较慢。
4 结束语
在高温下能够吸附CO2的吸附剂中,到目前为止 Li2ZrO3是最有希望进行商业应用的材料。掌握CO2的吸附/脱附机理,理解影响 Li2ZrO3吸收 CO2能力的各种因素对进一步提高 Li2ZrO3对 CO2的吸附率及吸附速率至关重要,从而最终控制温室气体CO2的排放。随着世界各国越来越重视环境问题,Li2ZrO3的发展前景一定会越来越广阔。
[1]吴兑.温室气体与温室效应[M]. 北京:气象出版社,2003:30-31.
[2]李莉,袁文辉,韦朝海二氧化碳的高温吸附剂及其吸附过程[J]. 化工进展,2006,36(7):25-30.
[3]Limin Guo, XiaohuiWang, Caifu Zhong,et al. Synthesis and CO2ca pture property of high aspect-ratio Li2ZrO3nanotubes arrays[J]. Ap plied Surface Science,2011, 257: 8106–8109.
[4]Yuhua Duan. A first-principles density functional theory study of the electronic structural and thermodynamic properties of M2ZrO3and M2CO3(M=Na, K) and their capabilities for CO2capture[J]. Journal Of Renewable and Sustainable Energy,2012(4): 013109-013126.
[5]Heriberto Pfeiffer, Pedro Bosch. Thermal Stability and High-Tempe rature Carbon Dioxide Sorption on Hexa-lithium Zirconate (Li6Zr2O7)[J]. Chem. Mater. ,2005, 17:1704-1710.
[6]王银杰,其鲁.Li2ZrO3材料吸收CO2性能的进一步研究[J].无机化学学报,2004,20(7):770-774.
[7]Esther Ochoa-Fernandez,Magnus Rønning,Xiaofeng Yu,et al.Composi tional Effects of Nanocrystalline Lithium Zirconate on Its CO2Cap ture Properties[J]. Ind. Eng. Chem. Res, 2008, 47: 434 442.
[8]袁文辉,王婵月,阎慧静,等. CO2吸附剂掺钾锆酸锂的制备及性能表征[J]. 华南理工大学学报 (自然科学版),2008,36(7):25-30.
[9]王银杰,其鲁. 影响Li2ZrO3在高温下吸收CO2的因素[J]. 物理化学学报,2004,20(4):364-367.
[10]李春燕,任兆刚,刘花. 锂离子导体材料 Li2ZrO3的制备及表征[J].西华师范大学学报 (自然科学版 ),2012,33(2):176-180.
[11]Esther Ochoa-Ferna´ndez, Magnus Rønning, Tor Grande,et al. Sy nthesis and CO2Capture Properties of Nanocrystalline Lithium Zi rconate[J]. Chem. Mater., 2006, 18:6037-6046.
[12]Qiang Xiao, Xiaodan Tang, Yefeng Liu,et al. Citrate route t o prepare K-doped Li2ZrO3sorbents with excellent CO2capture p roperties[J]. Chemical Engineering Journal,2011,174: 231–235.
[13]Mara Olivares-Marín, Miguel Castro-Díaz, Trevor C. Drage, et al.Use of small-amplitude oscillatory shear rheometry to study the flow propertie of pure and potassium-doped Li2ZrO3sorbents duri ng the sorption of CO2at high temperatures[J]. Separation and P urification Technology ,2010,73: 415–420.
[14]Alina Iwana, Hazel Stephensonb,William C. Ketchie,et al. High te mperature sequestration of CO2using lithium zirconates[J]. Chemi cal Engineering Journal, 2009, 146: 249–258.
[15]Jun-ichi Ida, Y.S. Lin. Mechanism of High-Temperature CO2Sor ption on Lithium Zirconate[J]. Environ. Sci. Technol, 2003, 37:19 99- 2004.
[16]Esther Ochoa-Ferna´ndez, Magnus Rønning,Tor Grande,et al. Nano crystalline Lithium Zirconate with Improved Kinetics for High-Te mperature CO2Capture[J]. Chem. Mater. 2006, 18:1383-1385.
[17]Hans Kristian Rusten, Esther Ochoa-Fernandez, De Chen,et al. N umerical Investigation of Sorption Enhanced Steam Methane Refor ming Using Li2ZrO3as CO2–acceptor[J]. Ind. Eng. Chem. Res.,2007, 46:4435-4443.
[18]Rentian Xiong, Junichi Ida, Y. S. Lin. Kinetics ofcarbon dioxide sorption on potassium-doped Lithium zirconate[J]. Chemical Engi neering Science,2003, 58: 4377 – 4385.
[19]Jun-ichi Ida, Rentian Xiong, Y S Lin. Synthesis and CO2sorptio n properties of pure and modified lithium zirconate[J]. Separation and Purification Technology,2004, 36:41–51.
[20]Daniel J. FauthT, Elizabeth A. Frommell,et al. Eutectic salt promo ted lithium zirconate: Novel high temperature sorbent for CO2ca pture[J]. Fuel Processing Technology, 2005,86 :1503- 1521.
[21]Esther Ochoa-Ferna´ndez, Hans Kristian Rusten, Hugo Atle Jakob sen,et al. Sorption enhanced hydrogen production by steam metha ne reforming using Li2ZrO3as sorbent: Sorption kinetics and reac tor simulation[J]. Catalysis Today ,2005, 106 :41–46.
[22]Lorena Martınez-dlCruz, Heriberto Pfeiffer. Effect of Oxygen Addi tion on the Thermokinetic Properties of CO2Chemisorption on Li2ZrO3[J]. Ind. Eng. Chem. Res., 2010,49: 9038–9042.
