电针对去卵巢大鼠骨组织形态学影响
2013-07-29施洁唐曦葛伟侯立皓娄青林欧阳钢
施洁 唐曦 葛伟 侯立皓 娄青林 欧阳钢
绝经后骨质疏松症是绝经后妇女的常见病和多发病,因骨丢失所造成的病理性骨折的增加,严重损害着老年妇女的健康。目前对骨质疏松的防治研究已经成为医学研究的重要课题。近年来,针灸治疗骨质疏松在临床上取得了良好的疗效,可明显改善骨质疏松患者的临床症状,提高患者骨密度,延缓骨量的丢失[1-2],但有关针灸防治骨质疏松症的机制目前仍不清楚。本实验以切除大鼠卵巢制作绝经后骨质疏松症模型,观察电针对去卵巢大鼠骨组织形态学的影响,以探讨针灸抗骨质疏松的可能作用机制。
1 材料与方法
1.1 动物 选取60 只3 月龄SD 雌性清洁性大鼠,体质量180 ~200 g。未曾交配,购于上海斯莱克实验动物有限责任公司,实验动物使用许可证号为:SCXK(沪)2007-0005。动物适应饲养1 周后,随机分成A、B 2 组,其中A 组为假手术组,共20 只,不切除双侧卵巢;B 组为模型组,共40 只,切除双侧卵巢,手术操作同A 组。3 月后2 组各取10 只大鼠进行骨密度检测确定造模是否成功[3]。造模成功后处死,提取骨标本保存。将A 组余下的10 只大鼠设为假手术组;B 组余下的30 只大鼠随机分为模型组、针刺组和雌激素组,每组各10 只。
1.2 动物造模制作 用3%戊巴比妥钠(按0.1 ml/100 g)经大鼠腹腔注射麻醉后,于背部正中切口进入腹腔背侧,完整摘除双侧卵巢后,仔细止血,逐层缝合。假手术组取腰椎旁背侧切口,进入腹腔,切除一段小肠系膜后,立即止血缝合。动物手术后给予抗生素3 d,防止感染,自由摄食,饮水。
1.3 治疗方法
1.3.1 针刺组:大鼠不作麻醉,在自己设计的鼠架上进行针灸操作。选穴:(1)关元、三阴交(双侧);(2)肾俞、后三里(双侧),每日选取其中1 组穴位,2 组穴位交替进行,取穴方法按华兴邦氏的方法实施,用细美容针刺入穴位后,接韩氏电针仪(南京济生医疗科技有限公司)进行电针刺激,其刺激参数为:连续脉冲波、频率3 ~4 Hz、强度4 ~5 mA,以动物局部轻度抖动为度,每次20 min,每日1 次,连续治疗3 月。
1.3.2 雌激素组:造模成功后,按人鼠剂量换算,每只大鼠以0.1 mg/kg,皮下注射苯甲酸雌二醇,每周1 次,连续3 月。
1.3.3 假手术组与模型组:不作任何处理。
1.4 骨组织形态计量学观察
1.4.1 四环素活体标记与不脱钙切片制作[4-5]:大鼠处死前14 d 腹腔内注射1%四环素生理盐水30 mg/kg,处死前4 d 腹腔内注射1% 钙黄绿素5 mg/kg,进行活体荧光标记。3 月后,用10 g/L 的戊巴比妥钠麻醉并断头处死大鼠,取其左侧股骨下段干骺端长约1 cm 骨组织,置于4 ℃70%乙醇中固定,再经梯度酒精、丙酮脱水、脱脂,将标本经二甲苯透明后浸透包埋于甲基丙烯甲酯、丁酯及过氧化苯乙酰的聚合物中,置于4 ℃冰箱中聚合,用Jung K 型重型切骨机切成8 μm 的厚骨片(用于测量松质骨动态参数)和4 μm 的薄骨片(用于测量松质骨静态参数)。薄片行von Kossa 及Giemsa 染色封片,厚片不染色作荧光观察。
1.4.2 骨组织观察及测量参数:采用半自动数字化图像分析系统和测量软件(OsteoMeasure;OsteoMetrics,Inc,USA)在距骺线1 mm 处至远端3 mm 范围内进行松质骨的骨形态计量学参数测量。测量的指标有:静态参数:(1)骨小梁面积分数(Tb. Ar);(2)骨小梁数(Tb.N);(3)骨小梁宽度(Tb.Wi);(4)骨小梁分离度(Tb.Sp)。动态参数:(1)荧光周长百分率(L. Pm);(2)矿化沉积率(MAR);(3)矿化延迟时间(MLT);(4)类骨质周长百分率(O.Pm);(5)骨吸收周长百分率(Er.Pm);(6)骨形成率(BFR/BS)各参数意义及相关计算公式见文献[6]。
1.5 统计学分析 使用SPSS 11.0 进行统计学分析,结果以±s 表示,组间比较用单因素方差分析,两两比较用SNK 法,P <0.05 为差异有统计学意义。
2 结果
2.1 电针对去卵巢大鼠骨形态静态参数的影响 切除大鼠双侧卵巢后,模型组Tb.Ar,Tb.N 及Tb.Wi 均显著减少,Tb.Sp 明显增加,与假手术组相比具有统计学差异(P <0.01)。提示模型组大鼠在去势后骨量显著下降,骨小梁间结构破坏,骨质疏松形成。见表1。经3 月连续治疗后,与模型组相比,电针组和雌激素组Tb. Ar,Tb. Wi 的水平均有不同程度的提高,而Tb.Sp 均有明显下降,差异有统计学意义(P <0.05,P <0.01),且在雌激素组中Tb. N 与模型组相比亦有显著增加(P <0.05)。电针组中Tb.Ar,Tb.Wi 显著低于雌激素组,而Tb.Sp 则明显高于雌激素组,且均有统计学差异(P <0.05)。见表1。
表1 各组骨形态计量学静态指标(±s,n=10)

表1 各组骨形态计量学静态指标(±s,n=10)
注:与假手术组比较,**P <0.01;与模型组比较,△P <0.05,△△P <0.01;与雌激素组比较,▲P <0.05
组别Tb.Ar(%)Tb.Wi(μm)Tb.N(个/μm)Tb.Sp(μm)假手术组37.43 ±5.8782.54 ±9.734.11 ±0.43218.80 ±151.89模型组20.66 ±4.54**56.07 ±10.2**1.07 ±0.56**592.63 ±166.02**雌激素组27.19 ±4.01**△△77.13 ±9.43△1.98 ±0.73**△228.58 ±113.44**△△电针组25.39 ±2.82**△▲67.13 ±6.48**1.61 ±0.59**411.80 ±144.48**△▲
2.2 电针对去卵巢大鼠骨形态动态参数的影响 切除大鼠双侧卵巢后,与假手术组相比,模型组L. Pm、MAR、O. Pm 及Er. PM、BFR/BS 均显著增加(P <0.05,P <0.01),MLT 明显缩短(P <0.05)。表明模型组大鼠去势后,新骨形成和矿化的速率加快,骨转化活跃,骨形成与骨吸收都增强,呈现高代谢状态。
经3 月连续治疗后,电针组L.Pm、MAR 均有明显升高,Er.PM、MLT 下降明显,与模型组相比,有统计学差异(P <0.05 或P <0.01),而O.Pm 和BFR/BS 较模型组而言,变化不明显;雌激素组中,与模型组相比,L.Pm、MAR均有所下降(P <0.01),Er.PM、BFR/BS 也明显减少(P <0.01),而O.Pm、MLT 则无统计学差异。电针组中L.Pm、MLT、BFR/BS 较雌激素组明显升高,而MLT 则显著下降(P <0.01)。见表2。
表2 各组骨形态计量学动态指标(±s,n=10)

表2 各组骨形态计量学动态指标(±s,n=10)
注:与假手术组比较,* P <0.05,**P <0.01;与模型组比较,△P <0.05 ,△△P <0.01;与雌激素组比较,▲▲P <0.01
项目L.Pm(%)O.Pm(%)Er.PM(%)10.31 ±5.6220.46 ±3.1211.53 ±3.12模型组16.69 ±6.32*28.11 ±4.33*17.62 ±4.18**雌激素组7.81 ±4.29△△24.34 ±5.5712.97 ±4.23△△电针组25.15 ±6.71**△▲▲26.78 ±3.34**14.84 ±3.56假手术组*△项目MAR(μm/d)MLT(d)BFR/BS(%)0.98 ±0.137.07 ±0.979.16 ±2.23模型组1.13 ±0.11*6.13 ±0.54*16.07 ±3.25**雌激素组0.76 ±0.16**6.52 ±0.8110.71 ±1.97电针组1.36 ±0.23**△△▲▲4.16 ±0.76**△△▲▲18.97 ±3.13假手术组**△△▲▲
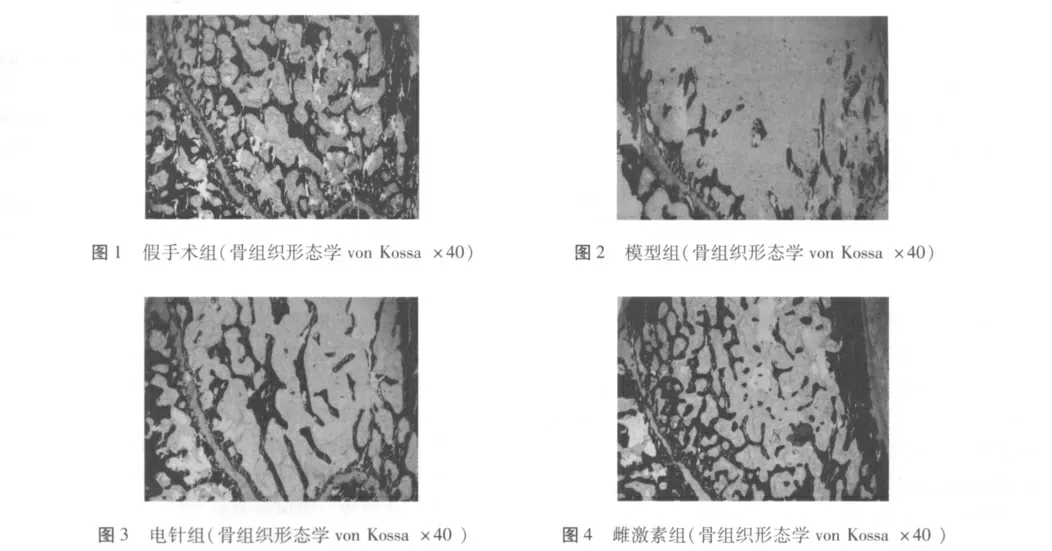
2. 3 各组大鼠骨组织形态学表现 假手术组骨小梁较粗,排列密集而整齐,连续性好(图1)。模型组去势后骨小梁排列稀疏,骨小梁间连接差,出现大量骨小梁盲端(图2)。经电针治疗后,骨小梁密度增大,骨小梁数目增加,但仍不如正常结构,小梁间连接性差(图3)。经雌激素治疗后,骨小梁数目增加,小梁间连接增多,排列有序,仍未达正常结构(图4)。
3 讨论
骨组织形态计量学是利用体视学原理,将形态学观察到的骨组织结构改变用定性、定量的计量方法进行计算[7]。不仅能够精确地测量骨组织微细结构和骨组织形态学及总体骨量的变化,而且能够通过“四环素标记”的骨计量学技术将时间因素标记在骨形成期的矿化过程,能动态观察到完整的激活-吸收-形成-静止过程的改变,了解其产生结构差异的根本原因与代谢的信息状况[8]。因此在疾病的发生机制研究、药物疗效的评价中都有着广泛的应用价值[9]。将骨组织形态计量学运用于针刺研究中,不仅能从静态参数中对骨组织水平的质(骨结构)和量(骨量)进行客观评价,而且可以通过测量其动态参数,了解骨组织形态细胞水平的动态特性,因此,骨组织形态计量学对客观评价针灸治疗骨质疏松症的效果,进一步阐明针灸抗骨质疏松症的可能作用机制均提供了一个很好的研究手段。
本次实验采用摘除大鼠双侧卵巢的方法复制骨质疏松模型,因其骨量丢失与绝经后妇女相似,国内外报道均认为是比较合适的[10-11]。在本实验中,模型组与假手术组相比,其骨量明显下降,骨小梁形态结构发生明显变化。从动态参数分析,骨吸收活动增强,破骨细胞功能增强,同时机体通过破骨-成骨偶联作用,使成骨细胞活性增强,数量明显增多,分泌类骨质功能增强。这些变化显示模型组大鼠去卵巢后呈现较高的骨转换率,骨吸收和骨形成均增强,但骨吸收大于骨形成,致大鼠股骨骨量下降,骨结构稀疏,骨质疏松形成,造模成功。
中医认为肾主骨生髓,脾主四肢肌肉,为气血生化之源,脾肾两脏与骨质疏松关系密切,故以补肾健脾为治疗原则,选取肾俞、后三里、关元、三阴交等穴[12]。经电针治疗后,从动态参数上看,与模型组比较,L.Pm 增加显著,说明电针能够刺激成骨细胞的生成,加速骨的形成。MAR 增加,MLT 减少表明电针能使成骨细胞活性增加,矿化功能增强,BFR/BS 与模型组相比虽然其差异无显著性,但亦有一定程度的提高,表明骨形成增加。在骨吸收方面,Er.Pm 比模型组明显减少,表明破骨细胞功能受到一定抑制,其活性减低,致使骨吸收下降。从静态参数上看,与模型组比较,电针组Tb.Wi 明显提高,Tb.Sp 显著减小,Tb.N 与模型组相比虽然没有统计学意义,但整体也有增加的趋势,表明骨小梁间形态结构得到改善,Tb.Ar 较模型组也有明显增加,骨量得到维持。由上述分析可知,电针能够增加成骨细胞数目和活性,促进骨形成,并且对破骨细胞起到一定抑制作用,使骨吸收减弱,从而达到防治骨质疏松的目的。
雌激素是治疗绝经后骨质疏松症确切有效的药物[13],本次实验采用雌激素作为对照,旨在比较针刺与药物在治疗骨质疏松症疗效及作用机制上的差异。本次实验结果与以往报道的相同[13],雌激素对绝经后骨质疏松症的治疗作用是通过降低高骨转换率,即同时减缓骨吸收和骨形成(以抑制骨吸收为主),从而纠正骨代谢负平衡,达到减少骨量丢失,改善骨结构的目的。
综上所述,电针能明显改善去卵巢大鼠骨质疏松症的骨组织形态学指标,通过抑制骨吸收,促进骨形成,使骨形成大于骨吸收而呈正平衡状态,从而使骨量和骨结构明显改善,达到防治骨质疏松的目的。
[1] 何劲,宋道飞,向楠. 针刺悬钟、肾俞、命门穴对原发性骨质疏松症患者骨密度的影响及疗效[J].中医杂志,2009,50(2):147-149.
[2] 庞勇,赵利华,农泽宁,等. 针灸治疗原发性骨质疏松症临床观察[J]. 上海针灸杂志,2008,27(12):15-16.
[3] 吴启跃,马雯,余正红,等.骨质疏松两种造模方法的对照研究[J].中国中医骨伤科杂志,2007,15(8):17-19.
[4] Robert R. Bone histomorphometry techniques and interprelation[M]. Florida:CPC Press Inc,1983:37-52.
[5] Baron RA,Vignery L,Neff L,et al.Processing of undecalcified bone specimens for bone histomorphometry[M]. In:Recker RR. Bone histomorphometry:techniques and interpretation. Boca Raton:CRC Press,1983:13-26.
[6] 王洪复,骨质疏松症的药效研究方法与技术[M].北京:人民卫生出版社,2009:118-119.
[7] Frost HM. Measurement of human bone formation by means of tetracycline labeling[J]. Can J Biochem Physiol,1963,41(1):31-42.
[8] 于顺禄,白仁骁,郭若霖,等.骨重建过程“四环素活体标记”骨组织形态计量学指标在骨质疏松中的应用[J].中国体视学与图像分析,2003,8(2):119-123.
[9] Weinsten R. Clinical use of bone biopsy[M]. In:Marcus R,Feldman D,Nelson D,et al. Osteoporosis. 3rd edition.Boston:Elsevier Academic Press,2008:448-465.
[10]田茂友,李洪洋.去卵巢大鼠骨质疏松模型研究[J].现代预防医学,2007,34(12):2239-2241.
[11]Lelovas PP,Xanthos TT,Thorma SE,et al. The laboratory rat as an animal model for osteoporosis research[J].Comparative Medicine,2008,58(5):424-430.
[12]华兴邦,李辞蓉,周浩良,等.大鼠穴位图谱的研制[J].实验动物与动物实验,1991(1):1-5.
[13] Studd J. Estrogens as first-choice therapy for osteoporosis prevention and treatment in women under 60[J]. Climacteric,2009,12(3):210-212.
