鼻通贴细胞毒性测定方法的确定
2013-07-25宋广群
宋 阳* 宋广群
(1 武警上海总队医院药剂科,上海 201103;2 武警黑龙江总队医院药剂科,黑龙江 哈尔滨150010)
鼻通贴细胞毒性测定方法的确定
宋 阳1* 宋广群2
(1 武警上海总队医院药剂科,上海 201103;2 武警黑龙江总队医院药剂科,黑龙江 哈尔滨150010)
目的 定鼻通贴细胞毒性的测定方法。方法 采用小鼠成纤维细胞ATCC(L929),比较分别采用MTT法和琼脂覆盖法对鼻通贴进行细胞毒性试测定的结果。结果 MTT法检测细胞毒性方法简便、快速,结果 比较稳定可靠,能进一步量化。结论 MTT试验方法更适合鼻通贴的细胞毒性测定。
鼻通贴;细胞毒性;浸提液
鼻通贴是治疗鼻炎的材料,属于医疗器械的范畴。根据GB/ T16886.2003/ISO10993-5 医疗器械生物学评价国际标准的试验原则,本文通过MTT法和琼脂覆盖法两种方法,对鼻通贴细胞毒试进行研究,结果如下。
1 材 料
1.1 样品及对照材料[1]
1.1.1 样品
鼻通贴,规格:7.5cm×1.8cm,批号: 20100408,由哈尔滨市天地仁医药科技有限公司提供,同一批号至少取3个供试品。
1.1.2 阴性对照材料
经确认的不产生细胞毒性反应的高密度聚乙烯。
1.1.3 阳性对照材料
经确认的可重现细胞毒性反应的含有有机锡添加剂的聚氯乙烯。(琼脂扩散试验阳性对照液为20%苯酚溶液)。
1.2 细胞系
小鼠成纤维细胞ATCC(L 929),从建立的细胞系并已认可的贮源中获取。本试验使用的细胞系购自中国医学科学院上海细胞库,使用的是无支原体污染细胞。
1.3 仪器与试剂
Sunrise酶标仪、CO2孵箱。超净工作台、冰箱、倒置光学显微镜、光学显微镜、蒸汽灭菌器、液氮瓶、电热恒温水浴锅、96孔细胞培养板、移液器,可调式微量加样器。MEM培养基、RPMI1640培养基(美国GIBCO公司),胎牛血清(美国GIBCO公司),二甲基亚枫(Dimethyl Sulphoxide DMSO) (美国sigma公司)、消化液(0.25 %Trypsin & 0.02% EDTA(吉诺生物医药技术有限公司)、磷酸盐缓冲液(吉诺生物医药技术有限公司)、(四唑盐[ 3-( 4,5-Dimethylthiazol-2-yl ) -2 ,5-diphenyltetr-azolium bro2mide ])。
MTT溶液:MTT磷酸盐溶液,浓度为5mg/ mL、中性红磷酸盐溶液,浓度为0.01% ,
2 方 法[2]
2.1 四唑盐(MTT) 比色法
哺乳类动物细胞的线粒体酶可将黄绿色的MTT 降解形成蓝紫色,用二甲基亚砜(DMSO) 溶解后,用酶标仪测定其浓度,从而定量测定细胞的存活比例。
2.1.1 样品浸提液制备
浸提介质为含10%新生牛血清的RPMI1640 培养基(空白对照液)。按照每毫升浸提液覆盖6cm2 样品进行浸提。浸提条件为(37 ±2)℃浸提24h。采用相同条件制备阴性、阳性对照材料浸提液。
2.1.2 试验步骤
①培养细胞达到其对数生长期末细胞趋于融合,用细胞消化液消化分散细胞,用细胞培养液配制成1 ×104个/ mL 的细胞悬液。取96孔培养板,每孔加入100μL的细胞悬浮液。轻轻水平转动培养板使细胞均匀地分散在皿孔表面。②置于含5%二氧化碳培养箱内,(37± 2)℃下培养24h。③弃去原培养液,每孔加入100μL的空白对照液、阴性对照液、阳性对照液、供试品浸提原液并以培养基作稀释剂的i=1.5系列浸提稀释液。每组至少设8孔。SI5置含5%二氧化碳培养箱,(37±2)℃下培养。培养间期为48h。⑤培养间期后,每孔加入PBS -Ca 100 μl 洗两次,弃去孔内液体,每孔分别加入MTT溶液20μL,置含5%二氧化碳培养箱,(37±2) ℃培养5h。⑥弃去孔内液体,每孔分别加入150μl DMSO,将培养板放置振荡仪上振荡10min使孔内溶液颜色均匀。⑦用酶标仪测定吸光度,采用双波长测定法,选用的波长为570nm,630nm。⑧结果计算细胞相对增殖率RGR(%)=试验样品组(阴性对照组,阳性对照组)的吸光度/空白对照组的吸光度×100%。⑨结果判断:根据RGR值,判定细胞毒性见表1。结果阴性对照组细胞毒性反应为1级。阳性对照组细胞毒性反应为3级。试验样品组反应见表2。

表1 细胞相对增殖率与细胞毒性分级的关系
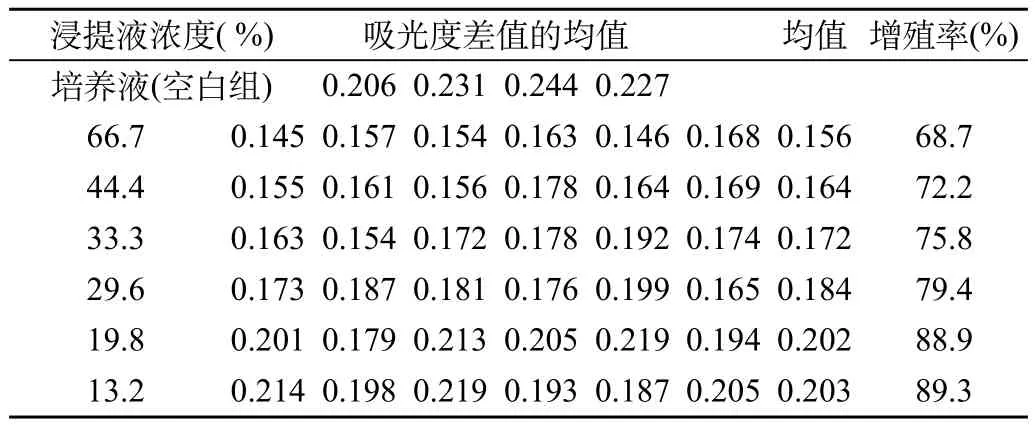
表2 鼻通贴测量波长与参考波长吸收度差值的均值及细胞增殖率
2.2 琼脂扩散试验
在细胞处于生理状态时,用中性红活体染色剂使细胞着色,但又对细胞无毒。用来研究观察样品对细胞形态和生理状态影响。
2.2.1 样品浸提液制备
浸提介质为含10 %新生牛血清的RPMI1640培养基(空白对照液)。浸提比例与MTT法相同。将滤纸剪成1.5cm×1.5cm小块,用浸提介质浸透备用。采用与试验样品相同条件及方法制备的阴、阳性对照材料浸提液。
2.2.2 试验步骤
①培养细胞达到其对数生长期末细胞趋于融合,用细胞消化液消化分散细胞,用细胞培养液配制成3×105个/mL的细胞悬液。制备平板细胞单层:每只培养皿加入10mL制备好细胞悬液,轻轻转动培养皿使细胞均匀的分布在培养皿底部。②放入含5%的二氧化碳培养箱培养24h使其成为融合但不稠密的网状的细胞单层。③弃去原培养液,将混合的MEM琼脂培养基加入培养皿中10mL/皿放冷凝固后。④每个培养皿加入10mL新配制的0.01%中性红活体染色液10mL,37℃避光染色15min;⑤弃去染色液每个皿放置3个试样,放入含5%的二氧化碳培养箱培养24h;⑥细胞反应=褪色指数/溶解指数结果;⑦镜下观察结果评分,评判标准见表3。细胞毒性反应见表4。结果阴性对照组细胞毒性反应为1级。阳性对照组细胞毒性反应为4级。试验样品组反应见表5。
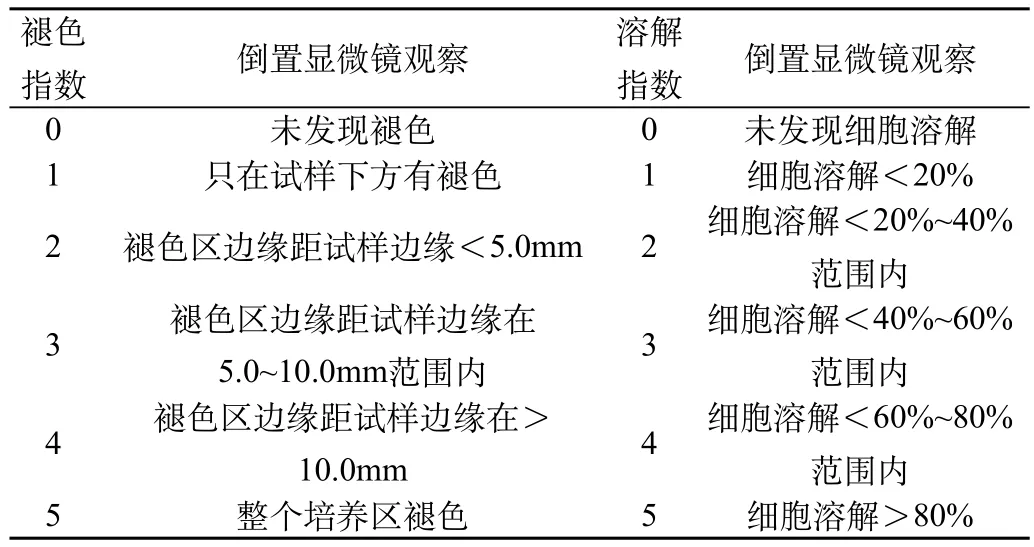
表3 琼脂覆盖法结果评价标准及溶解指标的评判标准

表4 细胞毒性反应

表5 琼脂覆盖法测量鼻通贴细胞毒性反应结果
3 讨 论
细胞毒性试验可观察生命细胞在外源性有害物质的作用下所发生的一系列结构与功能的改变,根据所采用的方法不同,可观察到体外培养细胞受某种化合物刺激后细胞的凋亡、衰亡直至死亡的全过程。研究内容涉及外源性有害物质对机体的细胞毒性作用、特异的细胞毒作用、细胞毒物代谢和毒物的细胞毒作用机理以及致癌性等,范围十分广泛,研究方法也各不相同。细胞毒性试验有很多种方法GB/16886.5-2003规定方法有直接接触试验(MTT 法)、间接接触试验(琼脂覆盖法)本次试验目的是以期从琼脂覆盖法、MTT法中筛选出适合本样品细胞毒性的方法,建立一套简便、快速的体外细胞毒性检测方法。通过试验两种方法的细胞毒性测定结果基本吻合,但是琼脂覆盖法操作过程较MTT法复杂。并且结果判断人为因素大,不能定量,而MTT法法的优点是简便、快速、所需细胞数较少,试验周期短。其原理是根据哺乳类动物细胞的线粒体酶可将黄绿色的MTT降解形成蓝紫色,用二甲基亚砜(DMSO) 溶解后,用酶标仪测定其浓度,从而定量测定细胞的存活比例。所以四唑盐(MTT) 可用于鼻通贴的细胞毒性的测定方法简单可靠。
[1] GB/ T16886.12 - 2000.医疗器械生物学评价—第12部分:样品制备与参照样品[S].2000.
[2] GB/ T16886.5 - 2003.医疗器械生物学评价—第5 部分:细胞毒性试验:体外法[S].2003.
[3] 国家食品药品监督管理局中国药品生物制品检定所.医疗器械检验操作规范[S].北京:中国科学技术出版社,2005.
R765.21
B
1671-8194(2013)24-0066-02
*通讯作者
