C57-ras癌症转基因小鼠模型胚胎冷冻保种技术研究
2013-07-23刘甦苏周舒雅刘佐民王金恒范昌发
左 琴,刘甦苏,周舒雅,刘佐民,王金恒,范昌发
(中国食品药品检定研究院,国家啮齿类实验动物种子中心,北京 100050)
随着转基因和基因敲除模型动物模型的大量建立和广泛使用,其保存和繁育体系的建立愈显重要。模型动物的保存有活体保存和低温冷冻保存两种途径,后者具有经济、降低模型动物遗传漂变风险、避免因自然灾害疾病原因引起的品种丢失等优势。与普通小鼠相比,转基因模型动物的胚胎显得更加娇贵与脆弱,胚胎数量和质量往往都不及普通动物。因而建立模型动物的低温保种技术的难度更大。为了让耗费大量经费和经过多年研究的模型动物品种资源得到妥善保存、以便为后续科研提供充足的动物,有针对性的研究和建立模式动物的低温保种技术是非常有必要的[1]。
本研究在已有胚胎冷冻和体外受精技术基础上,对本室自主建立的 C57-ras癌症转基因小鼠模型(专利公开号:CN101532018A)的低温保种技术进行了研究。通过直接收集体内发育的2-细胞胚胎或者通过体外受精方法获得2-细胞胚胎,采用玻璃化冷冻法冷冻、复苏、移植,后代经 PCR检测,获得了阳性的转基因动物,建立了该转基因动物品系低温保种方法,而且在转基因小鼠的保种中,利用体外受精的方式替代直接收集体内发育的2-细胞胚胎,提高了保种的效率。
1 材料和方法
1.1 实验动物
C57-ras癌症转基因动物模型为本室自主建立(专利公开号:CN101532018A),是通过将人原癌基因c-Ha-ras原核注射至C57BL/6J 1-细胞胚建立;其余小鼠包括SPF级C57BL/6J小鼠和KM小鼠均来自于本单位【SCXK(京)2009-0017】。所有小鼠饲养于清洁级环境,饲喂SPF小鼠颗粒饲料,饮用灭菌自来水。温度控制在(22 ±3)℃,自动光控(L∶D=12 h∶12 h,光照起始时间为 7∶00)。
1.2 主要仪器及试剂
CO2培养箱(Thermo 8000DH,美国)、体视显微镜(NIKON SMZ624,日本);孕马血清(PMSG)、人绒毛膜促性腺激素(hCG)(均购于宁波第二激素厂,中国)、M2培养液(Sigma M7176,美国)和 KSOM 培养液(Millipore MR-106-D,美国)、DAP213冻存液和HTF培养液(日本熊本大学动物资源研发中心和上海斯莱克实验动物有限责任公司赠送)。PCR检测所用试剂(购于宝生物工程(TaKaRa)大连有限公司,中国),引物由北京诺赛基因研究公司合成。
1.3 方法
1.3.1 胚胎采集[3]
取4周龄的C57BL/6J雌鼠,间隔48h分别注射PMSG和 hCG,各10 IU/只进行超排;待 hCG注射后与性成熟C57-ras雄鼠交配,次日晨检阴道栓,见栓小鼠于hCG注射40 h后颈椎脱臼处死,取其输卵管,M2培养液冲胚,在体视显微镜下回收形态正常的2-细胞期胚胎,清洗3次,移入CO2培养箱中培养待用。
1.3.2 体外受精[4]
同上对4周龄C57BL/6J雌鼠超数排卵。在第二天取C57-ras雄鼠的精子进行精子培养获能时,将注射hCG后15 h的C57BL/6J雌鼠颈椎脱臼处死,从输卵管壶腹部取出卵母细胞团,放入已平衡12 h的HTF液中培养。
将2~3只10~15周龄的 C57-ras雄鼠颈椎脱臼处死,取其附睾上体尾部,用解剖针刺破后挤出精子团块,放入在 CO2培养箱中已经平衡12 h的HTF培养液中,培养1 h。
在显微镜下检查培养1h的精子悬浮液的精子活力和精子数量,然后用移液器取 10 μL(约含精子200个/μL)精子悬浮液,加入到已经取出的卵母细胞团中,放入 CO2培养箱中培养24 h,在实体显微镜下,挑选出发育正常的2-细胞期胚胎,放入CO2培养箱中培养,待冻存或胚胎移植。
1.3.3 胚胎冷冻和复苏[5-6]
采用简易玻璃化冷冻-解冻法冻存胚胎和复苏胚胎。将待冻存的2-细胞胚置于1 mol/L DMSO液滴中静置数分钟,用微量移液器吸取5 μL含有所有胚胎的 DMSO于冷冻管中,在0℃恒温器中平衡5 min,加入 DAP213溶液,再在 0℃条件下平衡 5 min后置于液氮中保存。
将冻存管从液氮中取出,室温下静置约30 s,加入9 mL 37℃预热的0.25 mol/L蔗糖溶液,用移液器吹打10次,将溶液移入35 mm培养皿,室温下静置10 min,观察记录结果;将状态良好的2-细胞胚移入KSOM培养液,放于CO2培养箱培养,待移植。
1.3.4 胚胎移植[7]
2-细胞胚采用输卵管移植法。结扎的KM雄鼠与正常KM雌鼠1∶1合笼,翌日检查阴道栓,见栓记为假孕第1天。将复苏胚胎移植至假孕1天母鼠的输卵管内,两侧各移植6~10个胚胎,出生后统计其产仔率。
1.3.5 PCR检测
取离乳小鼠尾尖,按常规酚-氯仿法提取基因组DNA,PCR 反应条件是:94℃ 4 min,94℃ 45 s,68℃45 s,72℃ 2 min,72℃ 5 min,30 个循环。扩增目的片段大小为408 bp。1%琼脂糖凝胶电泳观察结果。
1.4 数据处理
应用SPSS7.1统计软件,采用χ2检验进行结果分析。
2 结果
2.1 2-细胞期胚胎冷冻及复苏结果
C57-ras转基因雄鼠和普通 C57BL/6J雌鼠交配,获得102枚2-细胞期胚胎。选择其中90枚形态好的胚胎冷冻。共进行3次复苏实验,每次复苏30枚冻存胚胎,平均复苏成活胚胎20.33个,平均复苏成活率是67.78%,3次复苏组间第二组与其他两组相比有极显著差异(P<0.01)。复苏后分别移植到3只假孕鼠输卵管中,总计获得幼仔13只,得到3只阳性小鼠,见表1[8]。可见,转基因动物胚胎冷冻较普通动物难度大,较难以把控,尤其对于纯合致死的模型动物,保存胚胎有阳性小鼠的胚胎,也有野生型小鼠的胚胎,这意味着针对模式动物的胚胎冷冻技术,还需要进行大量的摸索。
2.2 体外受精结果
取C57-ras转基因雄鼠精子与普通C57BL/6J雌鼠卵母细胞团在体外受精后,共收集到341个卵母细胞,其中有243个受精,有203枚胚胎发育到2-细胞期,平均体外受精率是58.49%,体外受精的3个分组间其中第一组的体外受精率是80.99%,与其他两组相比有极显著差异(P<0.01),这可能是第一组取的精液活率较高的原因,见表2。
2.3 体外受精2细胞胚胎冷冻复苏结果
冷冻保存了203个体外受精的2细胞期胚胎,解冻复苏了60个胚胎,平均复苏率是63.33%,移植到2只假孕鼠输卵管中,共产仔6只,见表3[8]。
2.4 通过PCR检测产生移植产生小鼠
取移植产生的21只小鼠尾尖,提取基因组DNA后进行PCR检测,以确定是否获得含有转基因的阳性小鼠。通过两次重复检测,发现有5只幼仔小鼠为转基因阳性(图1)。

表1 2-细胞胚冷冻复苏结果Tab.1 Result of recovery of C57-ras transgenic mice froze 2-cell embryo

表2 体外受精结果Tab.2 Result of C57-ras transgenic mice IVF

表3 体外受精2细胞期胚胎冷冻复苏结果Tab.3 Result of recovery of C57-ras transgenic mice IVF froze 2-cell embryo
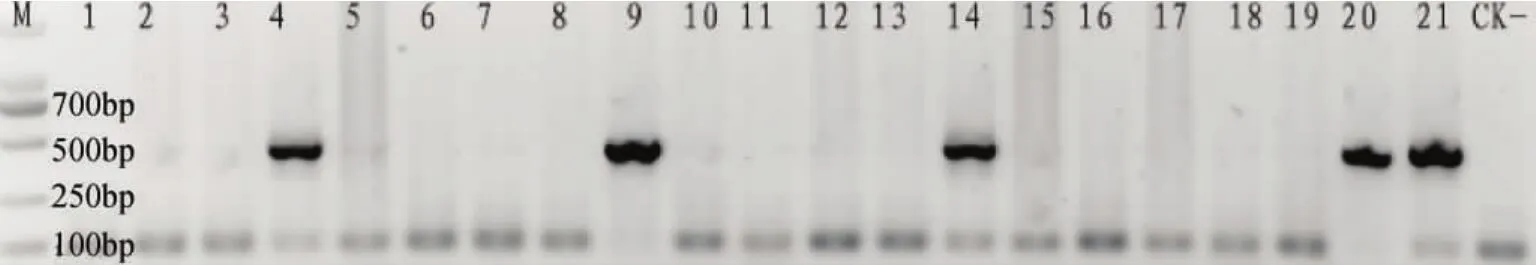
图1 PCR检测c-Ha-ras转基因小鼠中目的基因的插入Fig.1 Identification of human c-Ha-ras gene integration with PCR
3 讨论
3.1 DAP213玻璃化冷冻方法
本研究以自主建立的C57-ras癌症转基因动物模型为材料,开展了模式动物的胚胎冷冻和体外受精技术探索,以期建立模型动物的低温保存方法。通过直接收集2-细胞胚和经体外受精获得2-细胞胚,并经过玻璃化冷冻方法冻存、复苏、移植、检测,最终两种途径均获得阳性转基因动物。胚胎冷冻技术方法主要有缓慢冷冻法和玻璃化冷冻法,两种方法各有其优点。玻璃化冷冻法因其对设备要求低,操作简单,而被广泛采用。Nakagata建立以DAP213为抗冻保护剂的玻璃化冷冻法已经程序化,并出现了商业化的胚胎冷冻试剂盒,便于建立一种快速、经济、可靠的胚胎冷冻技术方法[9]。本实验中采用了DAP213冷冻试剂盒冷冻2-细胞胚。通过3次实验结果显示,解冻后平均复苏率为67.78%,移植后的产仔率为21.31%,子代中的阳性率为23.08%。徐平等比较了12个品系的小鼠体外受精后2细胞期胚胎的冻存复苏率在58.12%~83.19%间,表明不同遗传背景的小鼠间冻胚复苏率有差异[10]。
Nakagata的玻璃化冷冻法较易掌握,在冻存胚胎时使用的是冻存管,与其他使用塑料细管的玻璃化冷冻法相比较,避免了复杂的装管程序,单次冻存的胚胎量多。但是有数据表明2细胞期的胚胎解冻复苏后,培养到扩张囊胚期的发育率,DAP213法是 39.1% ,EFS20/40 法是 93% ,后者更高[11]。
从原核期的胚胎到扩展囊胚期的胚胎,各个时期的胚胎都可以冷冻保存,对于近交系和转基因小鼠,在超数排卵后,获得的晚期胚胎数量少于早期胚胎,我们建议近交系和转基因小鼠选择冻存早期胚胎。
3.2 体外受精和胚胎冷冻结合保存种子资源
在转基因小鼠的扩繁中,易出现繁殖能力低、食仔或不能自然交配等现象。采用体外受精技术,可以辅助不能自然交配或繁殖能力低的个体产生后代,在短时间内快速获得较多数量的动物。通过体外受精获得小鼠胚胎并冷冻保存,这种方式可以较为安全的长期保存小鼠品系,通过移植也能较快的获得转基因活体动物,是目前保存小鼠遗传资源的一种重要手段,同时也为转基因小鼠模型推广提供便利[12]。
常规冷冻保种的胚胎来源通常是需要数量较多的该品系雌鼠进行超排,交配成功的雌鼠取胚胎冷冻,但是转基因小鼠品系通常提供不了大量的雌鼠,而体外受精解决了这个问题,采用1-2只阳性转基因雄鼠和其背景来源的雌鼠体外受精,就可以获得大量的胚胎,进行冷冻保存。
对来源于不同遗传背景的35个小鼠品系超速排卵所得的卵母细胞与同品系小鼠精子进行体外受精研究表明,不同遗传背景的小鼠体外受精差异显著(P<0.05),受精率在 15.2% ~97.2%之间[10]。本实验中采用 HTF为体外受精液,对 C57-ras转基因小鼠体外受精中,受精率是59.53%,在对体外受精的2细胞期胚胎冷冻保存复苏后,复苏率是 63.33%,产仔率是 15.78%,后代阳性率是33.33%,和从体内发育的2细胞期胚胎冷冻后的结果没有差异,说明体外受精的胚胎可以作为一种胚胎来源方式进行冷冻保存。
[1]李劲松,成国祥,李厚达,等.胚胎冷冻技术在转基因动物中的应用[J].生物技术,1996,6(2):1-4.
[2]OECD guidelines for the testing of chemicals[W].Test No.451:Carcinogenicity Studies[2008/2010].http://www.oecd.org/dataoecd/30/46/41753121.pdf.
[3]Nagy A,Gertsenstein M.,Vinstersten K.,et al.Manipulating the Mouse Embryo.(THIRD EDITION) [M].USA.COLD SPRING HARBOR LABORATORY PRESS,2003,141-175.
[4]豊田裕,横山峰介,星冬四郎.マウス卵子の体外受精に关する研究,I精巢上体精子 にする 受精成绩[J].家畜繁殖志,1971,16(4):147-151.
[5]Nakagata N.High survival rate of unfertilized mouse oocytes after vitrification[J].J.Reprod Fertil,1989,89:479-483.
[6]Nakao K, Nakagata N, KatsukiM. Simple and effcient procedureforcryopreservation ofmouseembryos bysimple vitrification[J].Exp.Anim.1997,46:231-234.
[7]中泻直已.マウスにおける经卵管壁卵管内胚移植の试み[J].实验动物,1992,41:387-388.
[8]周生来,董婉维,郑志红,等.胚胎冷冻技术应用于抗菌肽转基因小鼠的保种传代[J].中国比较医学杂志,2007,8(17):484-486.
[9]熊本大学動物資源開発研究部門.Reproductive Engineering Techniques in Mice.(SECOND EDITION) [W].http://card.medic.kumamoto-u.ac.jp.
[10]徐平,刘丽均,郁丽丽,等.系统低温生物学技术在实验小鼠资源保存中的建立与应用[J].中国比较医学杂志,2009,8(19):9-14.
[11]梁洋,杜文敬,王春生,等.小鼠早期胚胎的 EFS20/40、EFS40、DAP213和GP25玻璃化法冷冻保存[J].江西农业大学学报,2010,6(32):9-14.
[12]徐平,山村绫子,唐一岷,等.不同品系小鼠的体外受精、胚胎冷冻及移植的比较研究[J].中国实验动物学报,2004,12(3):147-151.
