与感觉相关的ASIC3、TRPV1基因敲除小鼠繁殖性能的观察与痛阈的比较
2013-07-23吉长福尚红燕辛娟娟杨兆坤宿杨帅王晓宇景向红
石 宏,吉长福,尚红燕,辛娟娟,杨兆坤,宿杨帅,王晓宇,何 伟,景向红
(1.中国中医科学院针灸研究所,北京 100700;2.山东中医药大学,济南 250355)
ASIC3-/-和TRPV1-/-纯合子小鼠是以正常近交系C57BL/6为背景,利用基因敲除技术将相关基因定点灭活制备而成的动物模型。纯合子ASIC3-/-是靶点突变小鼠,它表现出正常及与疼痛相关的皮肤机械敏感性、炎症疼痛感觉的改变,视力减退伴夜盲症及年龄引起的听力损失的改变。ASIC3-/-小鼠的机械感受器对于轻触表现出更高敏感性,而且对伤害性机械刺激敏感性是下降的[1],对酸以及伤害性的热刺激敏感性下降。TRPV1-/-小鼠是纯合的定点突变小鼠,对本品系的纯合小鼠皮下注射辣椒素,不会引起疼痛,肿胀也受到显著抑制,体温也不会降低。纯合小鼠的热致疼痛相关行为表现出严重缺陷,而且不会反感饮用添加了辣椒素的水。
ASIC3-/-和TRPV1-/-纯合子小鼠常用于痛觉相关研究。目前对于C57BL/6繁殖性能报道较多,但对ASIC3-/-及TRPV1-/-小鼠的繁殖性能及在喂养过程中存在的问题目前国内尚未见到报道。我们在ASIC3-/-及TRPV1-/-小鼠动物使用繁饲养殖中积累了一些数据,并对它进行了整理,同时以C57BL/6小鼠作为对照组与ASIC3-/-和TRPV1-/-纯合子小鼠进行了基础痛阈值的比较,为繁殖使用这类基因小鼠的同行提供一些参考。
1 材料与方法
1.1 实验动物
动物品系:ASIC3-/-小鼠、TRPV1-/-小鼠、C57BL/6小鼠。
动物来源:ASIC3基因敲除小鼠(Stock Number:013127),品系为 B6.129-Asic3tm1Wsh/J,TRPV1 基因敲除小鼠(StockNumber:003770)品系为B6.129S4-Trpv1tm1Jul/J,两种小鼠均为纯合子小鼠,从美国JAX实验室引进;C57BL/6来自中国食品药品检定研究院实验动物资源中心,动物许可证号【Scxk(京)2009-0017】。
动物选择:TRPV1-/-和ASIC3-/-纯合子小鼠通过检验检疫,饲养,繁殖,测序鉴定,检测合格后进行分组实验。选用性成熟未交配过的TRPV1-/-和ASIC3-/-纯合子小鼠各12只(雌雄各半)进行交配。TRPV1-/-小鼠8~10周龄左右,体重20~25 g。ASIC3-/-小鼠8~10周龄左右,体重在20~25 g。C57BL/6小鼠12只(雌雄各半),8~10周龄左右,体重20 ~25 g。
1.2 实验环境
动物饲养在中国中医科学院中医基础理论研究所动物房SPF级屏障设施内(实验动物使用许可证号【SYXK(京)2010-0032】室内温度控制在20~25℃,湿度控制在40% ~70%,全程喂饲北京科澳协力饲料有限公司生产的大小鼠生长繁殖饲料。饲料、垫料、饮水均经过高温高压灭菌处理,动物饮水为酸化纯净水(pH2.5~3.0),每周更换垫料饮水1~2次,光暗照明12 h交替,饲养流程严格按照屏障设施SOP操作。
1.3 实验仪器
温度测痛仪(UGO basile tail flick unit 37360,意大利),触觉测痛仪(UGO Basile Dynamic Plantar Aesthesiometer 37450,意大利)。
1.4 观察方法
1.4.1 ASIC3-/-、TRPV1-/-纯合子小鼠分别按性别分笼饲养,8周龄左右开始配种,采用1只雄鼠和1只雌鼠同居的方式进行交配繁殖。观察6个月内小鼠妊娠的胎次,妊娠率、窝产仔数、离乳率、头胎产仔数等。
1.4.2 测定 C57BL/6小鼠、ASIC3-/-、TRPV1-/-纯合子小鼠的基础机械痛阈值和温度阈值。机械痛阈值测定[2]:使用触觉测痛仪,测小鼠的抬脚反射潜伏期(单位 S)。热痛阈值测定[3]:待动物安静后,将温度测痛仪的聚光光源聚集于大鼠足底部,测定其热辐射缩腿反应潜伏期(单位S)。从记录开始到抬足的时间作为相应的痛阈值。每只动物测量三次,取其即刻效应平均值。
1.5 统计学方法
2 结果与分析
2.1 基因敲除小鼠的繁殖情况分析
ASIC3-/-和TRPV1-/-小鼠均观察半年内的繁育情况,在ASIC3-/-种鼠中,只有3只雌鼠全部妊娠,另有2只雌鼠妊娠二次,1只雌鼠仅妊娠一次,总体妊娠率为77.8%,每窝平均产仔数5.64只、离乳仔数3.5只,离乳率57.14%。TRPV1-/-的每只雌鼠在半年内均妊娠三次,妊娠率100%,每窝产仔数6.5只、离乳仔数5只、离乳率79%。经过比较ASIC3-/-小鼠从妊娠率、窝产仔数、离乳数、离乳率都不及TRPV1-/-小鼠,而TRPV1-/-小鼠从产仔数及离乳率方面都相对稳定(表1)。
表1 ASIC3-/-小鼠与TRPV1-/-小鼠繁殖性能的比较()Tab.1 Reproduction Performance in ASIC3-/-and TRPV1-/-

表1 ASIC3-/-小鼠与TRPV1-/-小鼠繁殖性能的比较()Tab.1 Reproduction Performance in ASIC3-/-and TRPV1-/-
离乳率(%)Weaning rate ASIC3-/- 77.8±42.78 5.64±1.60 3.5±3.48 57.14±51.36 TRPV1-/-品系Strain妊娠率(%)Gestate rate窝产仔数(只)Baby/litter离乳仔数(只)Wean number 100±0 6.44±1.76 5.06±2.84 79.03±37.40
表2 ASIC3-/-小鼠与TRPV1-/-小鼠不同胎次繁殖性能的比较()Tab.2 Reproduction Performance of different birth sequence in ASIC3-/-and TRPV1-/-
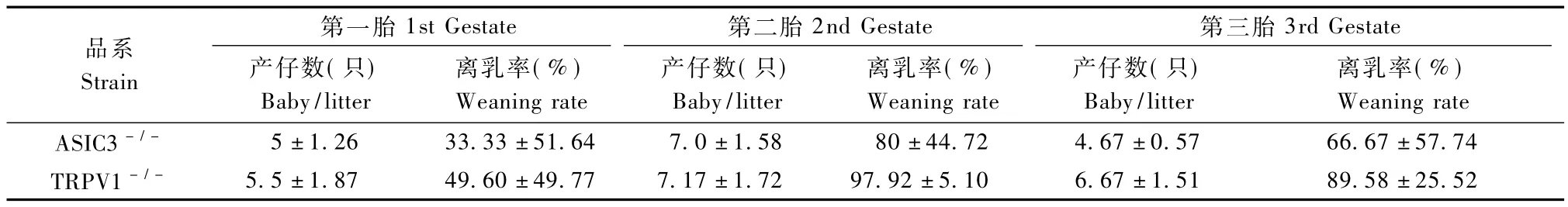
表2 ASIC3-/-小鼠与TRPV1-/-小鼠不同胎次繁殖性能的比较()Tab.2 Reproduction Performance of different birth sequence in ASIC3-/-and TRPV1-/-
第一胎1st Gestate 第二胎离乳率(%)Weaning rate ASIC3-/- 5±1.26 33.33±51.64 7.0±1.58 80±44.72 4.67±0.57 66.67±57.74 TRPV1-/- 5.5±1.87 49.60±49.77 7.17±1.72 97.92±5.10 6品系Strain 2nd Gestate 第三胎3rd Gestate产仔数(只)Baby/litter离乳率(%)Weaning rate产仔数(只)Baby/litter离乳率(%)Weaning rate产仔数(只)Baby/litter.67±1.51 89.58±25.52
ASIC3-/-小鼠头胎产仔数是5只,离乳率33.33%、第二胎产仔增加为7只左右,离乳率达到80%,第三胎时产仔数减少到与第一胎一致,但离乳率要高于第一胎,达到66.67%。TRPV1-/-小鼠的头胎产仔数均为5只左右,头胎的离乳率50%,而第二胎和第三胎TRPV1-/-小鼠产仔数增多,都在7只左右,离乳率也分别升高到97.92%和89.58%(表2)。
从表2中可以看出,TRPV1-/-小鼠头胎生育及离乳率低些,第二、三胎繁殖情况趋于稳定,而ASIC3-/-小鼠的繁殖不是很稳定,离乳率也低于TRPV1-/-小鼠。
经分析ASIC3-/-小鼠离乳率偏低与ASIC3-/-小鼠的食仔及弃养情况偏高有关,例如第一次妊娠生产的4只ASIC3-/-小鼠中有3只全部弃养或食仔,第二次妊娠生产的5只小鼠中有1只全部弃养,第三次妊娠的5只小鼠有2只全部弃养。这一方面说明ASIC3-/-小鼠母性不强,另一方面也可能与这种小鼠本身的基因缺陷有关。
2.2 三组小鼠基础机械痛阈和热痛阈值的比较
我们对三组小鼠的基础痛阈值进行了测定,经比较三组小鼠的基础痛阈值显著不同,其中ASIC3-/-组的机械痛阈值与 C57BL/6组和TRPV1-/-组相比显著升高(P<0.001,图 1),说明ASIC3-/-小鼠的机械感受能力下降,而ASIC3-/-组与C57BL/6组热痛阈值相比没有统计学差异(P>0.05,图2);TRPV1-/-组与C57BL/6对照组机械痛阈值相比没有无显著差异(P>0.05,图1),而其热痛阈值较其他两组显著升高(P<0.001,图2)。说明TRPV1-/-小鼠的对热感受能力下降。
3 讨论
本实验的观察表明ASIC3-/-小鼠的妊娠次数低于TRPV1-/-小鼠30%左右,每窝产仔数、离乳仔数、离乳率也低于 TRPV1-/-小鼠,这可能和ASIC3-/-小鼠对机械感受的灵敏度下降有关,这种机械感受的下降除了造成对机械痛的感受迟钝以外,还造成了喂养能力和母性的下降。而TRPV1-/-小鼠的繁育情况相对稳定。TRPV1-/-小鼠虽然其对热的感受能力下降,但是其喂养能力和母性没有影响。这些结果提示我们对于ASIC3-/-小鼠这种动物的喂养和繁殖需要注意。

注:***P <0.001,与 C57BL/6 小鼠比较 n=12;☆☆☆P <0.001,与 TRPV1-/-小鼠比较(n=12)。图1 三组小鼠间基础机械痛阈值的比较()Note: ***P <0.001,compared with C57BL/6 mice(n=12);☆☆☆P<0.001,compared with TRPV1-/-mice(n=12).Fig.1 Comparison of basal tactile threshold among three groups()
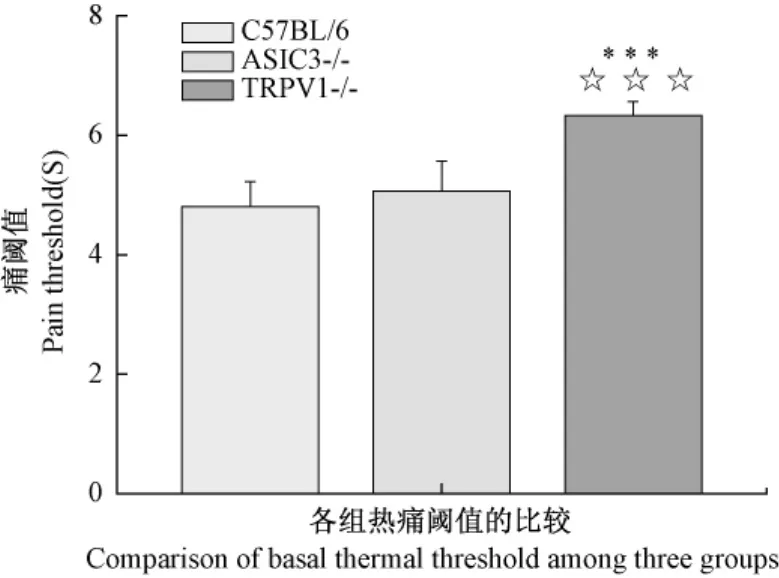
注:***P <0.001,与 C57BL/6 小鼠比较 n=12;☆☆☆P<0.001,与 ASIC3-/- 小鼠比较(n=12)。图2 三组小鼠间基础热痛阈值的比较()Note: ***P <0.001,compared with C57BL/6 mice(n=12);☆☆☆P<0.001,compared with ASIC3-/-mice(n=12).Fig.2 Comparison of basal thermal threshold among three groups()
在小鼠的繁育期间我们还发现母鼠有弃养和食仔现象。在环境、饮食相同的情况下,ASIC3-/-小鼠的弃养、食仔现象多于 TRPV1-/-小鼠。同时还发现个别小鼠有脱毛现象,有的是成年小鼠脱毛,也有的是新生小鼠脱毛,脱毛的小鼠基本上是同一笼中的小鼠,脱毛部位头部偏多,背部也有。经过查阅资料得知C57系小鼠对营养要求较高,对营养变化极为敏感,除要用专用小鼠饲料外还需补充维生素E等增加营养,所以我们对哺乳期母鼠增加喂饲蛋黄,给所有小鼠增加葵花籽,胡萝卜、苹果等辅助饲料,经过补充营养,脱毛现象好转,毛色光亮。小鼠的脱毛情况虽是个别现象,但从个例中也可以看出TRPV1-/-小鼠脱毛比例略高于ASIC3-/-小鼠,而TRPV1-/-小鼠也要比 ASIC3-/-小鼠更活跃些。这些现象的原因有待于进一步观察和研究。
近年来研究还显示,ASIC3与痛觉及伤害感受器密切相关。在酸化条件下所致的伤害和疼痛感受中,ASIC3是主要的酸感受器之一。不仅在哺乳动物的大脑、背根神经节、三叉神经、胃内神经、视网膜、感觉神经等处有 ASIC3表达,而且在心、肺、骨、骨骼肌、睾丸、味蕾、皮肤神经末梢等也有ASIC3的表达[4,5]。Jackson的网站上对所提供 ASIC3这种品系的基因敲除小鼠的描述是:该小鼠为纯合的靶点突变小鼠,它表现出正常及与疼痛相关的皮肤机械敏感性、炎症疼痛感觉的改变,视力减退伴夜盲症及年龄引起的听力损失的改变。
Price 等[6,7]的研究发现 ASIC3 基因敲除小鼠对轻触觉的反应性是增强的,张颖等[8]在基因敲除研究中还发现ASIC3可能参与高强度痛觉感知的调节。这些为ASIC3在触觉中的作用提供了有力的证据。
TRPV1 为热敏感离子通道[9,10],主要分布在中和小伤害性感受神经元上,研究提示TRPV1可能参与了与痛觉相关上下游通路上多个水平的调节[11]。目前TRPV1作为一类与痛觉传递有密切联系的离子通道受体已广泛应用于调控痛觉的机制研究。
Jackson提供的TRPV1基因敲除小鼠为纯合的定点突变小鼠,它体型正常,可以繁育,不会表现出明显的身体和行为异常,在背根神经节检测不到基因产物(mRNA或蛋白)。当环境酸化或环境温度达到43℃时,或环境中存在辣椒素化合物时,体外培养的背根中枢神经元和制备的皮肤对辣椒素化合物不表现反应或反映受到显著抑制。在未受损的野生型鼠后爪皮下注射辣椒素,会引起疼痛并出现肿胀。但对于本品系的纯合小鼠,不会引起疼痛,肿胀也受到显著抑制。也有的研究表明,TRPV1基因敲除小鼠对外周热刺激的反应比野生型小鼠相比明显降低,而对机械痛的反应无差异[12,13],这和本实验的行为学结果一致。
在病理状态下,疼痛是疾病的主要症状之一。ASIC3和TRPV1作为参与痛觉的离子通道,在痛觉的传导过程中起着重要的作用。现在基因敲除技术的出现有力的推动ASIC3和TRPV1受体的相关研究,这样得到的结果比过去采用神经纤维阻断得到的结果更直接更有说服力。但是关于这种动物饲养方面的工作报道不多,还需要我们总结和积累经验。本实验的观察结果可以为 ASIC3-/-、TRPV1-/-小鼠的喂养和繁殖提供参考,为这种实验动物引入疼痛的研究提供借鉴作用。
[1]Price M P,Mcllw rath S L,Xie J,et al.The DRASIC cation channel contributes to the detect ion of cutaneous t ouch and acid stimuli in mice[J].Neuron,2001,32(6):1071-1083.
[2]Hargreaves K,Dubner R,Brown F,et al.A new and sensitive method for measuring thermal nociception in cutaneous hyperalgesia[J].Pain,1988,32:77-88.
[3]Chen Y,Luo F,Yang C,et al.Acute inhibit ion of Ca2+ /calmodulin-dependen t protein kinase II reverses experiment al neuropathic pain in mice[J].J Pharmacol Exp Ther,2009,330:650-659.
[4]Babinski K,Le KT,Seguela P.Molecular cloning and regional distribution of a human proton receptor subunit with biphasic functional properties[J].J Neurochem,1999,72(1):51-57.
[5]Bebsib CJ,Xie J,Wemmie JA,et al.Heleromultimers of DEG/ENaC subunits form H+ -gated channels in mouse sensory neurons[J].Proc Natl Acad Sci USA,2002,99(4):2338-2343.
[6]Price M P,Lew in G R,Nm llwrath S L,et al.The mammalian sodium channel BNC1 is required for normal touch sensation[J].Nature,2000,407(6807):1007-1011.
[7]Price M P,Mcllwrath SL,Xie J,et al.The DRASIC cation channel contributes to the detect ion of cutaneous t ouch and acid stimuli in mice[J].Neuron,2001,32(6):1071-1083.
[8]张颖,郑建全,王秋鹃.酸感受离子通道亚基3的研究进展[J].国外医学药学分册,2006,33(1):9-13.
[9]Vennekens R, Owsianik G,NiliusB. Vanilloid transient receptor potential cation channels:an overview[J].Curr Pharm Des,2008,14(1):18-31.
[10]Alawi K,Keeble J.The paradoxical role of the transient receptor potential vanilloid 1 receptor in inflammation[J].Pharmacol Ther,2010,125(2):181-195.
[11]朱倩林,于布为.TRPV1在疼痛治疗中的作用及研究进展[J]. 国际麻醉学与复苏杂志,2010,31(2):159-161.
[12]Immke D C,Gavva N R.The TRPV1 receptor and nociception[J].Semin Cell Dev Biol,2006,17:582-591.
[13]Caterina M J,Leffler A,Malmberg A B,et al.Impaired nociception and pain sensation in mice lacking the capsaicin receptor[J].Science,2000,288:306-313.
