微生物产β-木糖苷酶的研究进展
2013-07-22范园园李秀婷滕超
范园园,李秀婷,滕超
(北京工商大学食品学院,食品添加剂与配料北京高校工程研究中心,北京 100048)
木聚糖是半纤维素的主要组分,广泛分布于高等植物的细胞壁中,是自然界中一类存量巨大的可再生资源,也是较容易提取、降解和利用的一类半纤维素。因木聚糖为异质多糖,其降解和生物转化需要多种酶的参与,主要包括木聚糖酶(β-D-xylanxylanohydrolase,EC 3.2.1.8)和β-木糖苷酶(β-D-xyloside xylo hydrolase,EC 3.2.1.37)、α-葡萄糖醛酸酶、乙酰酯酶等[1]。
β-木糖苷酶是一种外切酶,主要催化水解木糖苷和以外切方式从非还原性末端水解聚合度较低的木寡糖(木二糖或木三糖)为木糖。同时β-木糖苷酶还可以作用于萜类、甾体等甙元与木糖形成的糖苷键,释放出甙元。目前,包括β-木糖苷酶在内的木聚糖酶系已广泛应用于包括食品、药品、造纸、能源等多个领域。但相对木聚糖酶系其它水解酶(木聚糖酶等)而言,β-木糖苷酶的相关研究仍相对薄弱。本文将从酶的来源、定位与分类、酶学性质、生产调控、基因的克隆与表达等几个方面对木糖苷酶的研究进展进行论述,对研究现存问题和方向进行分析,并对应用前景进行展望。
1 β-木糖苷酶的来源
β-木糖苷酶在自然界中分布非常广泛,现已从细菌、放线菌和真菌(包括霉菌、酵母、蕈菌)等微生物以及部分高等植物中分离得到。大多数细菌或真菌只产生一种β-木糖苷酶,例如细菌Bacillus thermantarcticus,以及真菌Aspergillus carbonarius、Aureobasidium等均只分泌一种β-木糖苷酶。但随着研究的深入,迄今为止已发现可同时产生多种β-木糖苷酶微生物,例如Tsujibo 等从腐烂木材上分离到一株嗜热链霉菌热紫链霉菌(Streptomyces thermoviolaceus)OPC-520 在含木聚糖培养基上可以同时分泌2 种木糖苷酶(STX-I和STX-II),测定分子量分别为54 000 和33 000[2]。另外,试验结果显示两种木糖苷酶的性质也存在较大差别(STX-I 和STX-II 等电点、酶最适反应温度分别为4.2 和8.0,以及70 ℃和60 ℃)。通过对两种酶氨基酸序列分析发现,STX-I 及STX-II 分别与粪肥杆菌外切葡聚糖酶以及短小芽孢杆菌木聚糖酶具有很高的序列同源性。Matsuo 等从Penicilluium wortmanni IFO 7237 中分离纯化得到4 种木糖苷酶,其等电点各不相同[4]。Lorenz 等研究发现嗜热厌氧细菌Thermoanaerobacterium sp.JW/SY485 可同时产3 种木糖苷酶,酶相关性质(包括酶活力及与底物的亲和性)均不相同[5]。实验据此推测,菌株在某种碳源物质缺乏或丰富时可能会相应的分泌不同种类的木糖苷酶,以保持对碳源较高的利用效率。
2 β-木糖苷酶分泌部位
根据酶分泌部位的不同,β-木糖苷酶可大体分为胞内型、胞外型以及膜结合型三种,另外同种菌株还会随着生长机制及培养条件的不同而有所变化[6]。例如,在大多数细菌及酵母中β-木糖苷酶是以溶质状态分布在细胞之内的,在这些微生物生长过程中,低聚木糖必须以一定的方式进入细胞中才可以被降解[7]。而在丝状真菌中,有些木糖苷酶在菌丝生长初期位于菌丝体内,而在后期则会分泌或者裂解分布到培养基当中[8],也有一些菌体所产木糖苷酶始终保留在细胞内[9]。除此以外有些微生物(如Streptomyces sp.EC 10)所产木糖苷酶则为膜结合型[10]。通常大部分β-木糖苷酶仅具有单一活性,但研究也发现有相当比例的β-木糖苷酶为双功能酶或多功能酶,例如Motoki 等从Aspergillus japonicas 中分离到的β-木糖苷酶即属于多功能酶,除具有木糖苷酶活性外还具有β-葡糖苷酶以及α-L-阿拉伯呋喃糖苷酶活性[11]。
3 β-木糖苷酶的酶学性质
1991 年,Henrisaat 等根据氨基酸序列的相似性把糖基水解酶分成不同的家族。2009 年,Cantarel 等将不同来源的β-木糖苷酶分别归于第3、30、39、43、52 和54 等不同六个族糖基水解酶。而迄今为止发现真菌来源的β-木糖苷酶属于第3、第43 及第54 等三个家族[12]。不同家族的木糖苷酶酶学性质均有所差别,而酶性质的差异直接影响其使用条件及应用领域。
3.1 pH 与β-木糖苷酶的活性
大部分木糖苷酶的最适pH 在3.0-6.0 之间。已报道的β-木糖苷酶的等电点多为弱酸性(见表1)。但也有部分菌株所产β-木糖苷酶为中性或偏碱性。例如Katapodis 等对一种来源于Sporotrichum thermophile 的β-木糖苷酶进行了研究,结果显示其最适pH 为7.0[13];而Tuohy 等从Talaromyces emersonii 中分离到的β-木糖苷酶的等电点为8.9[14]。不同来源的β-木糖苷酶对pH 得耐受性同样存在明显差异,例如吴华伟等从草菇中分离得到的β-木糖苷酶的最适pH 为6.4~6.8,在pH5.8~7.7 之间酶活力相对稳定[15];栾宏伟等从Leifsonia shinshuensis DICP 16 菌体分离出的β-木糖苷酶则在pH 6.0~11.0 之间具有很好的稳定性[16]。

表1 不同来源β-木糖苷酶的性质Table 1 The nature of β-xylosidases in different sources
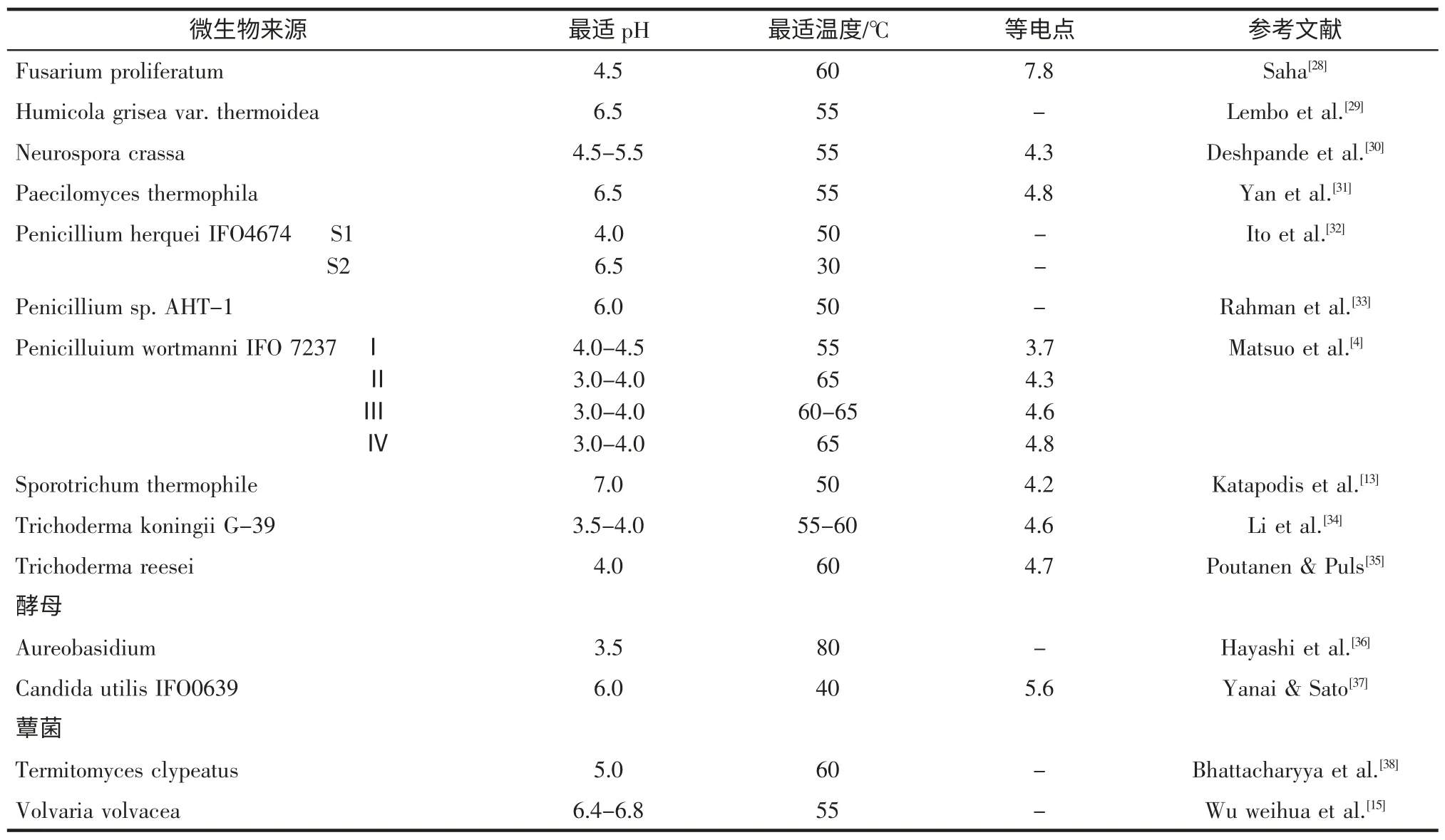
续表1 不同来源β-木糖苷酶的性质Continue table 1 The nature of β-xylosidases in different sources
3.2 温度与β-木糖苷酶的活性
温度对酶活性有很大的影响,在一定范围内,反应温度升高酶的反应速率相应增加。但同时过高的温度又容易导致酶蛋白质变性,进而导致酶失活。因此,在工业应用中,酶的热稳定性成为首要考虑的重要参数,较好的温度耐受性将极大的扩展酶的使用范围及应用领域。
β-木糖苷酶的最适反应温度范围一般为40 ℃~60 ℃(见表1),而近年来从一些嗜热细菌和耐热真菌中分离到的β-木糖苷酶都有较高的热稳定性。Bachmann 等研究发现褐色高温单孢菌(Thermomonospora fusca)的β-木糖苷酶最适温度达82 ℃,其活性可在65 ℃保持8 h 以上,在70 ℃也可以保持1.5 h[18]。Xue等从海栖热袍菌(Thermotoga maritima)中分离到一株极耐高温的β-木糖苷酶,它的最适反应温度为90 ℃,在95 ℃时酶半衰期为22 min[39]。
3.3 金属离子与β-木糖苷酶的活性
大多数酶属于蛋白质,因此其结构和活性都有可能会受到金属离子的影响。研究表明,金属离子的种类以及浓度均会对β-木糖苷酶的活性产生显著影响。例如,K+、Ca2+一般对β-木糖苷酶酶活力具有促进作用。王岚研究了不同金属离子对来源于嗜热真菌β-木糖苷酶活力的影响,一定浓度的K+、Ca2+可以提高酶活力的22.4%和14.8%[40]。Zanoelo 等曾报道Ca2+不仅可以提高真菌Scytalidium thermophilum 的β-木糖苷酶的酶活,还可以提高酶的热稳定性,使其在65 ℃下的半衰期从11 min 延长至30 min[41]。Hayashi 等研究也表明Ca2+可显著提高β-木糖苷酶的活性[42]。而一些金属离子如Hg2+的则对酶活力具有明显的抑制作用[43-44]。
4 β-木糖苷酶的生产调控
已有研究表明,利用微生物生产β-木糖苷酶的过程受到多种因素的影响,比如碳源、氮源、碳氮比、初始pH 等。
4.1 不同碳源对β-木糖苷酶合成的影响
发酵过程中碳源不仅是微生物生长代谢的能量来源,也是酶合成的诱导物。因此碳源的种类会直接影响酶的活力和产率。Gasparic 等研究发现,分别以木聚糖和葡萄糖为碳源对菌株Prevotella ruminicola B1进行发酵,所产β-木糖苷酶酶活相差约20 倍,木聚糖对此菌株产β-木糖苷酶具有明显的诱导作用[45]。Tsujibo 等证明Streptomycesthermoviolaceus OPC-520 β-木糖苷酶的活性可被桦木木聚糖及木寡糖(木二糖和木三糖)诱导,而单糖(如木糖、阿拉伯糖和葡萄糖)则不能诱导β-木糖苷酶的合成;试验同时显示当向含有桦木木聚糖的培养基中加入葡萄糖时,β-木糖苷酶的合成受到强烈抑制[46]。Zanoelo 等对Scytalidium thermophilum 产β-木糖苷酶的研究也发现,培养基中加入葡萄糖后可显著降低β-木糖苷酶的活性,同时发现放线菌酮能阻断木聚糖对酶的诱导作用[41]。毛连山等考察了不同分子量大小木聚糖作为碳源对里氏木霉(Trichoderma Reesei)RutC-30 产木聚糖酶酶系组成的影响,结果显示低分子质量的木聚糖有利于内切-β-木聚糖酶的生成,而较高分子质量的木聚糖则有利于β-木糖苷酶的诱导合成[47]。
4.2 氮源及碳氮比对β-木糖苷酶合成的影响
β-木糖苷酶的合成同时受酶诱导物和酶蛋白质前体的调控,酶诱导物主要为菌株可利用的碳源,而酶蛋白质的前体则主要来自于氮源。因此氮源的种类和添加量同样会影响β-木糖苷酶的活力和产率。例如,王岚研究了不同氮源对嗜热拟青霉产胞外β-木糖苷酶的影响,结果显示以牛肉蛋白胨为发酵氮源时产胞外β-木糖苷酶酶活最高,尿素次之。但以尿素为氮源时,发酵液中杂蛋白比例较低[40]。
另外,碳氮比也是影响微生物发酵产酶水平的重要因素,一般来说碳氮比过低容易造成微生物因氮源过多而生长过旺,进而对碳源消耗过快导致酶合成水平下降;而碳氮比过高则会造成菌株因氮源不足而生长缓慢,同样不利于酶的合成。毛连山等在研究里氏木霉RutC-30 产木聚糖酶时发现,较高的碳氮比会显著促进菌株β-木糖苷酶的发酵得率但同时会抑制内切木聚糖酶的合成[48]。另外结果还显示在以天然纤维质材料为碳源进行发酵时,碳源的利用顺序为木聚糖而后纤维素,同时发酵后期纤维素分解生成的葡萄糖也会对β-木糖苷酶的合成产生明显的抑制作用。
4.3 其它因素对β-木糖苷酶合成的影响
pH 对微生物生命活动的影响很大。pH 的改变会引起细胞膜正负电荷的改变,从而引起细胞膜透性的变化,影响微生物对营养物质的吸收、酶的形成及活力以及微生物的代谢途径等。发酵过程中pH 的变化会直接影响微生物的生长及酶的合成,因此通过发酵初期及培养过程中pH 的调控也可以有效促进特定酶系的合成。洪枫在研究初始pH 对里氏木霉合成木聚糖酶影响时发现,低pH 有利于β-木糖苷酶的合成,而且在低pH 条件下木糖苷酶表现出较高的活性,水解木聚糖效率提高了2-3 倍[49]。另外也有研究证实通过在培养基中添加合适的表面活性剂也可以促进β-木糖苷酶的合成[50]。
5 β-木糖苷酶基因的克隆与表达
目前,已发现的天然菌株产β-木糖苷酶水平普遍不高并且所产酶系成分复杂难于纯化。因此现阶段要实现β-木糖苷酶较大规模生产还存在一定困难。而通过相关工程菌的构建则是解决这一生产瓶颈的重要途径。
相对国外而言,我国关于重组β-木糖苷酶的研究还比较有限。薛业敏等从Thermoanaerbacter ethanolicus JW200 克隆出编码高度耐热稳定性的β-木糖苷酶的基因,以高拷贝质粒pAlter2Ex1 在大肠杆菌中得到高效表达,酶的热稳定性得到很大提升,重组酶的β-木糖苷酶在75 ℃时半衰期为1 h[51]。吴爱莲以Thermoanaerobacterium sp.JW/SL YS485 中的β-木糖苷酶基因xylC 为研究对象,经基因定点突变后在大肠杆菌中实现高效表达,结果显示利用工程菌株发酵产酶水平提高了55 倍(较天然菌株)[52]。梁艳丽等将Bacillus halodurans C-125 中编码β-木糖苷酶的基因BH1068克隆到大肠杆菌中得到高效表达,使其稳定性提高,并增加了酶对木糖的耐受性,对木糖的耐受能力由56 mmol/L 增加到300 mmol/L[53]。
国外关于β-木糖苷酶克隆及表达的研究相对较多。细菌有Aeromonas caviae ME-1、Bacillus pumilus、Butyrivibrio fibrisolvens、Streptomyces thermoviolaceus OPC-520、Thermotoga maritime 等,真菌有Aspergillus niger、Aspergillus nidulans、Trichoderma reesei、Talaromy ces emesonii 等。例如,Xue 等将海栖热袍菌(Thermotoga maritima)β-木糖苷酶基因在大肠杆菌中进行表达,重组酶最适反应温度达到90 ℃[39]。Kitamoto 等将来源于Aspergillus oryzae KBN616 中的β-木糖苷酶基因在强启动子调控下高效表达,产酶水平较对照组高出13 倍以上[54]。
6 β-木糖苷酶的应用前景
随着对β-木糖苷酶研究的深入,其应用领域也越来越广。能源工业方面,利用β-木糖苷酶与木聚糖酶的协同水解能够高效降解木聚糖为木单糖,而木糖可以被继续转化为大宗化工原料(如乙醇、乳酸等)[55]。造纸工业中,β-木糖苷酶可作为生物漂白剂,已有文献报道β-木糖苷酶单独或者与木聚糖酶协同作用对麦草浆进行预处理可以明显提高漂白浆的白度[56]。在医药工业,还可以利用β-木糖苷酶水解去除木糖残基来制造具有重要生理功能的紫杉醇[57]。在食品领域,β-木糖苷酶被应用于食品焙烤、低聚木糖制备、酒类酿造等方面并取得了良好的使用效果。在环境保护方面,β-木糖苷酶的应用使许多工农业废弃物以及一些生活垃圾可以更彻底的降解,有利于环境保护,同时β-木糖苷酶的使用减少了许多有害的有机或者无机化学试剂的应用,有利于环境社会的可持续发展。
7 β-木糖苷酶研究的现存问题及方向
相对木聚糖酶系其它水解酶而言,β-木糖苷酶的相关研究仍相对薄弱,还存在一些问题需要进行更加深入的研究。首先,目前用于较大规模生产的β-木糖苷酶多来自于转基因微生物,而关于转基因微生物的安全性评价方面还存在一些争议,而目前发现的天然菌株产β-木糖苷酶水平普遍不高,高产β-木糖苷酶天然菌株的获取仍是今后研究的重要组成部分。其次,当前关于β-木糖苷酶的研究还主要集中在β-木糖苷酶的分离、生产、纯化以及性质研究等方面,局限在酶蛋白的整体层面,而对于其三维分子结构和分子作用机制方面的研究还相对欠缺。到目前为止,还无法彻底解释β-木糖苷酶与其他木聚糖降解酶系组分的协同机理、底物选择专一性、底物诱导专一性以及结构与功能的关系等方面的问题。同时,随着研究的不断深入,一些新的问题不断出现,需要作出合理的解释,例如,在某种特定微生物当中,β-木糖苷酶多样性对于该微生物的意义及多种β-木糖苷酶之间的功能分配与协作问题等。在应用方面,由于各应用领域的工艺要求的不同,对β-木糖苷酶的性质及稳定性要求各不相同,而目前对于特定领域需要的β-木糖苷酶的针对性研究相对较少,使得β-木糖苷酶的应用存在一定的局限性,有待进一步研究。
[1]聂国兴,王俊丽,明红.木聚糖酶的应用现状与研发热点[J].工业微生物,2008,38(1):53-59
[2]Tsujibo H,Miyamoto K,Kuda T,et al.Purification,properties,and partial amino acid sequences of thermostable xylanases from Streptomyces thermoviolaceus OPC-520[J].Environ microbiol,1992,58(1):371-375
[3]Tsujibo H,Mitsuo K,Sadao I,et al.Molecular characterization of a high-affinity xylobiose transporter of Streptomyces thermoviolaceus OPC-520 and Its transcriptional regulation[J].J Bacteriol,2004,186(4):1029-1037
[4]Matsuo M,Fujie A,Win M,et al.Four types of β-xylosidase from Penicillium wortmanni IFO 7237[J].Agric Biol Chem,1987,51(9):2367-2379
[5]Lorenz W,Wiegel J.Isolation,analysis,and expression of two genes from Thermoanaerobacterium sp Strain JW/S-YS485:a beta-xylosidase and a novel acetyl xylan esterase with cephalosporin C deacetylase activity[J].J Bacteriol,1997,179(17):5436-5441
[6]Lenartovicz V,deSouza C G,Moreira F G,et al,Temperature and carbon source affect the production and secretion of thermostable βxylosidase by Aspergillus fumigates[J].Process Biochem,2003,38(12):1775-1780
[7]Bajpai P.Microbial xylanolytic enzyme system:properties and application[J].Adv appl microbiol,1997,43(1):141-194
[8]Wong K,Saddler J.Trichoderma xylanases,their properties and application[J].Crit Rev Biotechnol,1992,12(5/6):413-435
[9]Lembo T,Azevedo M,Bloch C,et al.Purification and partial characterization of a new β-xylosidase from Humicola grisea var.thermoidea[J].World J microbiol biotechnol,2006,22(5):475-479
[10]Belfaquiha N,Penninckx M J.A bifunctional β-xylosidase-xylose isomerase from Streptomyces sp.EC 10[J].Enzyme and microbial technol,2000,27(1):114-121
[11]Motoki W,Koji Y,Sachio H,et al.Purification and Properties of an Extracellular β-Xylosidase from Aspergillus japonicas and Sequence Analysis of the Encoding Gene[J].The Society for Biotechnology,Japan,2008,106(4):398-404
[12]Cantarel B,Coutinho P,Rancurel C,et al.The carbohydrate-active enzymes database (CAZy):an expert resource for glycogenomics[J].Nucleic Acids Res,2009,37(database):233-238
[13]Katapodis P,Nerinckx W,Claeyssens M,et al.Purification and characterization of a thermosable intracellular β-xylosidase from the thermophilic fungus Sporotrichum thermophile[J].Process biochem,2006,41(12):2402-2409
[14]Tuohy M G,Puls J,Claeyssens M,et al.The xylan-degrading enzyme system of Talaromyces emersonii:novel enzymes with activity against aryl beta-D-xylosides and unsubstituted xylans[J].J biochem,1993,290(2):515-523
[15]吴华伟,戴军,邵蔚蓝,等.草菇中木糖苷酶的分离纯化及其酶学性质[J].无锡轻工大学学报,2003,23(3):30-34
[16]栾宏伟,胡莹,刘兴宝,等.一种来源于Leifsonia shinshuensis DICP 16 菌体的β-D-木糖苷酶的分离纯化及其性质[J].生物工程学报,2008,24(5):867-873
[17]Lama L,Calandrell V,Gambacorta A,et al.Purification and characterization of the thermostable xylanase and β-xylosidase by the thermophilic bacterium Bacillus thermantarcticus[J].Res microbiol,2004,155(4):283-289
[18]Bachmann S L,Mccarthy A J.Purification and characterization of a thermostable β-xylosidase from Thermomonospora fusca[J].J general micobiol,1989,135(2):293-299
[19]Shao W L,Wiegel J.Purificafion and characterization of a thermostable β-xylosidase from Thermoanaerobacter enthanolicus[J].J bacteriol,1992,174(18):5848-5853.
[20]Pinphanichakam P,Tangsakul Z,ThongnumwonT,et al.Purification and characterization of β-xylosidase from Streptomyces sp.CH7 and its gene sequence analysis[J].World J microbiol biotechnol,2004,20(7):727-733
[21]Flores M E,Perez R,Huitron C.β-Xylosidase and xylanase characterization and production by Streptomyces sp.CH-M-1035[J].Lett appl microbiol,1997,24(5):410-416
[22]Kurakake M,Osada S,Komaki T.Transglycosylation of β-xylosidase from Aspergillus awamori K4[J].Biosci biotechnol biochem,1997,61(12):2010-2014
[23]Kiss T,Kiss L.Purification and characterization of a thermostable intracellular β-xylosidase from Aspergillus carbonarius[J].World J microbiol biotechnol,2000,16(5):465-470
[24]Kumar S,Ramon D.Purification and regulation of the synthesis of a β-xylosidase from Aspergillus nidulans[J].FEMS microbiol lett,1996,135(2/3):287-293
[25]Kitamoto N,Yoshino S,Ohmiya K,et al.Sequence analysis,overexpression,and antisense inhibition of a β-xylosidase gene,xylA,from Aspergillus oryzae KBN616[J].Appl environ microbial,1999,65(1):20-24
[26]Sulistyo J,Kamiyama Y,Yasui T.Purification and some properties of Aspergillus pulverlentus β-xylosidase with transxylosylation capacity[J].J ferment bioeng,1995,79(1):17-22
[27]Andrade S V,Polizeli M L,Terenzi H F,et al.Effect of carbon source on the biochemical properties of β-xylosidase produced by Aspergillus versicolor[J].Process Biochem,2004,39(12):1931-1938
[28]Saha B C.Purification and properties of an extracellular β-xylosidase from a newly isolated Fusarium proliferatum[J].Bioresour technol,2003,90(1):33-38
[29]Lembo T,Azevedo M O,Bloch J C,et al.Purification and partial characterization of a new β-xylosidase from Humicola grisea var.thermoidase[J].World J microbiol biotechnol,2006,22(5):475-479
[30]Deshpande V,Lachke A,Mishra C,et al.Mode of action and properties of xylanase and β-xylosidase from Neurospora crassa[J].Biotechnol Bioeng,1986,28(12):1832-1837
[31]Yan Q J,Wang L,Jiang Z Q,et al.A xylose-tolerant β-xylosidase from Paecilomyces thermophila:characterization and its co-action with the endogenous xylanase[J].Biores technol,2008,99(13):5402-5410
[32]Ito T,Yokoyama E,Sato H,et al.Xylosidases associated with the cell surface of Penicillium herquei IFO 4674[J].J biosci bioeng,2003,96(4):354-359
[33]Rahman A K,SugitaniN,Hatsu M,et al.A role of xylanase,aipha-Larabinofuranosidase and xylosidase in xylan degeadation[J].Can J microbiol,2003,49(1):58-64
[34]Li Y K,Yao H J,Cho Y T.Effective induction,purification and characterization of Thrichoderma koningii G-39 β-xylosidase with high transferase activity[J].Biotechnol appl bioehem,2000,31(2):119-125
[35]Poutanen K,Puls J.Characteristics of Trichoderma reesei β-xylosidase and its use in the hydrolysis of solubilized xylans[J].Appl microbiol biotechnol,1988,28(4/5):425-432
[36]Hayashi S,Ohno T,Yokoi H.Production and properties of the cellassociated β-xylosidase from Aureobasidium[J].J lnd microbiol biotechnol,2001,26(5):276-279
[37]Yanai T,Sato M.Purification and characterization of an β-D-xylosidase from Candida utilis IFO 0639[J].Biosci biotechnol biochem,2001,65(3):527-533
[38]Bhattacharyya S,Khowala S,Kumar A,et al.Purification and characterization of an extracellular β -xylosidase of Termitomyces clypeatus[J].Biotechnol prog,1997,13(6):822-827
[39]Yemin Xue,Weilan Shao.Expression and characterization of a thermostable β-xylosidase from the hyperthermophile Thermotoga maritime[J].Biotechnology letters,2004,26(19):1511-1515
[40]王岚.嗜热拟青霉J18 胞外β-木糖苷酶的纯化和性质[D].(硕士学位论文).北京:中国农业大学,2006
[41]Zanoelo F F,Polizeli M L,Jorge J A.Purification and biochemical properties of a thermostable xylose-tolerant β-D-xylosidase from Scytalidium thermophilum[J].J ind microliol biotechnal,2004,31(4):170-176
[42]Hayashi S,Ohno T,Ito M,et al.Purification and properties of the cell-associated β-xylosidase from Aureobasidium[J].J Ind Microbiol Biot,2001,26(5):276-279
[43]Shenq-Chyi Chang,Hui-Chin Chou,Min-Kuei Cheng,et al.Purification and characterization of β-xylosidase from an isolated Xylaria regalis 76072314[J].Fung sci,2005,20(3/4):105-112
[44]Mohamed G,Ines M,Ali G,et al.Catalytic properties of the immobilized Talaromyces thermophilus β-xylosidase and its use for xylose and xylooligosaccharides production[J].Journal of molecular catalysis B:Enzymatic,2009,57(1/4):242-249
[45]Gasparic A,Martin J,Daniel A S,et al.A xylan hydrolase gene cluster in Prevotella ruminicola B (1)4:Sequence relationships,synergistic in-teractions,and oxygen sensitivity of a novel enzyme with exoxylanase and beta-(1,4)-xylosidase activities[J].Environ microbiol,1995,61(8):2958-2964
[46]Tsujibo H,Takada C,Tsuji A,etal.Cloning,sequencing,and expression of the gene encoding an intracellular beta-D-xylosidase from Streptomyces thermoviolaceus OPC-520[J].Biosci biotechnol biochem,2001,65(8):1824-1831
[47]毛连山,勇强,余世袁.低聚木糖生产用木聚糖酶的选择性合成[J].现代化工,2004,24(1):132-134
[48]毛连山,余世袁.低聚木糖生产用里氏木霉木聚糖酶选择性合成的研究现状[J].现代化工,2007,27(2):17-21
[49]洪枫,陈琳,余世袁.培养基初始pH 值对木聚糖酶合成的影响[J].工业微生物,1999,29(4):15-18
[50]Long K,Knapp J S.The effect of junlon PW110 and tween 80 on the production of cellulolytic enzymes by Coprinus cinereus[J].Mycological research,1991,95(9):1077-1081
[51]薛业敏,卢晨,毛忠贵,等.阿拉伯糖苷酶基因的克隆、表达以及表达产物的酶的稳定性[J].中国农业大学学报,2003,8(5):9-13
[52]吴爱莲.嗜热厌氧菌中糖苷酶的定向改造[D].南京:南京师范大学,2007
[53]梁艳丽,李兴玉,毛自朝,等.嗜碱芽孢杆菌C-125 木糖苷酶积基因的表达与酶特性鉴定[J].生物工程学报,2009,25(9):1386-1393
[54]Kitamoto N,Yoshino S,Ohmiya K,et al.Sequence analysis,overexpression and antisence inhibition of a β-xylosidase gene,xylA,from Aspergillus oryzae KBN616[J].Environ microbiol,1999,65(1):20-24.
[55]Katahira S,Fujita Y,Mizuike H,et al.Construction of a xylan-fermenting yeast srain through codisplay of xylanolytic enzyme of the surface of xylose utilizing Saccharomyces cerevisie cells[J].Appl environ microbiol,2004,70(9):5407-5414
[56]毛连山,尤纪雪,宋向阳,等.内切木聚糖酶与木糖苷酶预处理对麦草浆漂白性能的影响[J].林产化学与工业,2003,23(2):7-11
[57]Patel R N.Tour de paclitaxel:biocatalysis for semisynthesis[J].Annu rev microbiol 1998,52(1):361-395
