离子交换色谱法分离纯化胸腺肽α1的工艺研究
2013-09-05刘妍妍刘茗飞高薇张丽萍
刘妍妍,刘茗飞,高薇,张丽萍
(1.黑龙江八一农垦大学食品学院,黑龙江大庆 163319;2.吉林大学生物与农业工程学院,吉林长春 130022)
离子交换色谱法分离纯化胸腺肽α1的工艺研究
刘妍妍1,2,刘茗飞1,高薇1,张丽萍1,2
(1.黑龙江八一农垦大学食品学院,黑龙江大庆 163319;2.吉林大学生物与农业工程学院,吉林长春 130022)
摘 要:通过对胸腺肽α1的分离纯化,提高胸腺肽α1的纯度,确定简单可行的纯化工艺技术。将QAE Sephadex A-25和D208、D301、717等阴离子交换介质进行静态吸附实验,确定最适离子交换介质;通过L9(33)正交试验对流速、填料高度及进样浓度进行优化,确定最佳分离条件。以QAE Sephadex A-25作为填料介质吸附胸腺肽α1,在流速60 cm/h,填料高度50 cm,进样浓度8 mg/mL条件下,胸腺肽α1纯化效果理想,经HPLC测定,得到纯度达24.596 6 mg/mL的胸腺肽α1,质量分数达12.03%,比市场上销售的胸腺肽中Tα1含量(质量分数0.6%~1.0%)高出近10倍。
关键词:胸腺肽α1,离子交换色谱,分离纯化
胸腺肽是胸腺组织上皮细胞分泌的分子量在10 000 u以下的多肽激素[1],是一种重要的生物反应调节剂。它广泛地存在于脊椎动物的组织中,例如牛、猪、羊、鼠以及人类,在它们的胸腺、脾、心脏、肝脏中分布,其中要属胸腺中含量最高[2]。胸腺肽中活性最高的多肽为胸腺肽α1(thymosin α1)又简称Tα1,具有较高的免疫增强活性,同时还具有刺激血管内皮细胞迁移、促进血管生成和伤口愈合等作用,已用于乙型肝炎、丙型肝炎、恶性肿瘤以及免疫缺陷疾病等的临床治疗和研究中[3]。
目前,获得高纯度胸腺肽α1可以利用生物提取法、基因工程法、化学合成法三种途径进行生产,其中基因工程法具有高效表达的技术难题,尚处在实验室研究阶段;化学合成法具有成本昂贵、污染环境等弊端;利用动物组织提取天然胸腺肽α1价格合理,无环境污染,临床应用安全[4]。本实验采用QAE Sephadex A-25对超声波辅助提取的胸腺肽进行分离纯化,以期可以摸索出一套分离纯化胸腺肽α1的工艺技术,为今后工业化生产胸腺肽α1提供参考。
1 材料与方法
1.1 材料与仪器
胸腺肽α1粗品:由黑龙江八一农垦大学食品学院实验室提供[5];乙腈:HPLC Grade.DIMA TECHNOLOGY INC;三氟乙酸:HPLC Grade,天津市科密欧化学试剂有限公司;三羟甲基氨基甲(Tris):Ultrapure Grade,Chem Base;QAE Sephadex A-25:超细型,瑞典 Pharmacia公司;阴离子交换树脂(D 301; 717;D208,大庆精化树脂厂);盐酸(AR):沈阳华东试剂厂;乙酸(AR):天津市科密欧化学试剂开发中心;氢氧化钠(AR):沈阳新兴试剂厂;Tα1标准品(迈普新,生产批号081002,纯度10%,四川成都地奥九泓制药厂)。
TH梯度混合器:上海精科实业有限公司;DYY-10C电泳仪:北京市六一仪器厂;WD-9405B水平摇床:沃德生物医学仪器分公司;Ф1.6 cm×20 cm、Ф1.6 cm×50 cm、Ф1.6 cm×30 cm Z型层析柱:上海精科实业有限公司;TU-1800紫外可见分光光度计:北京普析通用仪器有限公司;PB-10 Sartorius普及型pH计:德国赛多利斯股份公司;PC-2025 HPLC System(Lab Alliance);250 mm×4.6 mm C18硅胶柱(Lab Instrument CO.LTD)。
1.2 方法
1.2.1 电导率的测定
采用电导计按照文献[6]中附录3规范操作直接测定。
1.2.2 吸附量的计算
吸附量的计算公式:
吸附剂对胸腺肽α1吸附量(mg/mL)=(吸附前胸腺肽α1含量/mg-吸附后胸腺肽α1含量/mg)/离子交换剂体积/mL
1.2.3 HPLC检测
从各个洗脱峰中吸取20 μL进行HPLC测定。根据《ZGB2003-001胸腺肽溶液质量标准》规定,采用高效液相色谱(High Performance Liquid Chromatogram,HPLC)法确定胸腺肽α1的含量。
柱子类型:C18硅胶柱,300 A;
流动相A:体积分数为0.1%的三氟乙酸(TFA);
流动相B:体积分数为0.1%的TFA和90%乙腈;
洗脱梯度:10%~30%流动相B;洗脱时间:50 min;流速:1 mL/min;检测波长:214 nm。
1.2.4 胸腺肽α1标准曲线的绘制
取胸腺肽α1标准品,用超纯水分别配制成质量浓度为 0.2、0.4、0.6 、0.8、1.0 mg/mL 的 5 种标准溶液,在给定的色谱条件下,分别进样20 μL进行HPLC检测。每份平行进样3次,取其平均值。以胸腺肽α1的峰面积值Y对质量浓度X/(g/L)绘制胸腺肽α1标准曲线,建立相应的回归方程,并应用此方程进行实验中胸腺肽 α1的测定[7]。
1.2.5 阴离子交换介质的选择研究
实验中分别选择QAE-Sephadex A-25以及阴离子交换树脂D208、D301、717作为分离纯化胸腺肽α1的离子交换介质,通过实验选出最合适的离子交换介质。
1.2.6 洗脱方式的选择
1.2.6.1 阶跃式洗脱
实验采用 pH7.0,20 mmol/L Tris·HCl/10 mmol/L NaCl溶液、20 mmol/L Tris·HCl/30 mmol/L NaCl、20 mmol/L Tris·HCl/50 mmol/L NaCl溶液三种梯度浓度溶液进行洗脱,将所收集的洗脱峰进行含量的测定。
1.2.6.2 梯度洗脱
实验采用 20 mmol/L Tris·HCl,pH7.0,0~50 mmol/L NaCl溶液进行梯度洗脱,将所收集的洗脱峰进行含量的测定。
1.2.7 流速的优化研究
实验选用内径为1.6 mm、柱高为30 cm的层析柱,设定 20、40、60、80、100、120、140、160 cm/h 等 8 个流速水平,根据不同流速下离子交换介质对原料液吸附程度的不同,检测穿透曲线出现时流出液的OD值,采用Sigma Plot9.0作图软件对所得数据进行绘图,根据图像即可选出合适的流速。
1.2.8 填料高度的优化研究
实验选取的层析柱内径为1.6 cm,将填料高度分别设定在 10、20、30、40、50 cm 5 个水平,设定流速在80 cm/h,找出填料高度与多肽吸附程度之间的关系。
1.2.9 正交试验
试验选取流速(cm/h)、填料高度(cm)、以及进样浓度(mg/mL)3个因素作为考察对象,采用L9(33)正交试验表,进行正交试验。
2 结果与分析
2.1 胸腺肽α1标准曲线
2.1.1 胸腺肽α1标准品高效液相色谱图
经高效液相色谱检测,得到浓度为1.6 mg/mL的Tα1标准品的HPLC图谱,见图 1;胸腺肽α1标准品的保留时间为3.003 min,峰面积为91 069。
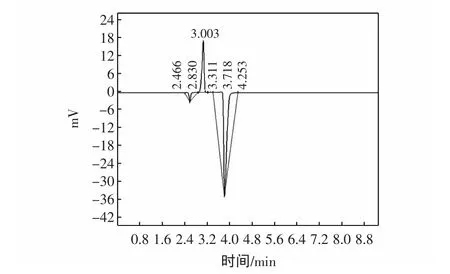
图1 胸腺肽α1标准品高效液相图谱Fig.1 Chromatogram of Tα1standard sample
2.1.2 胸腺肽α1标准曲线的建立
胸腺肽α1的峰值Y对胸腺肽α1标准品的浓度X(mg/mL)的标准曲线如图2。
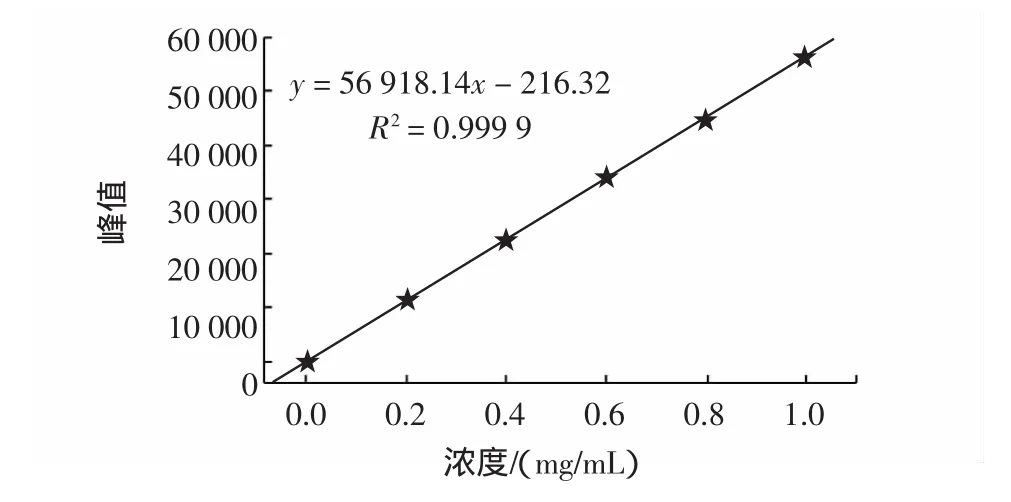
图2 胸腺肽α1标准曲线Fig.2 Standard curve of Tα1
2.2 阴离子交换剂的初步筛选结果
通过公式计算得出阴离子交换剂QAE-Sephadex A-25以及阴离子交换树脂D208、D301、717对胸腺肽α1的静态吸附量见表1。

表1 阴离子交换剂静态吸附量Table 1 Results of weak anion gel static absorption
QAE Sephadex A-25凝胶吸附量最大,因此选择QAE Sephadex A-25凝胶介质为分离介质,并可将717阴离子交换树脂作为工业化分离的备选介质。
2.3 洗脱方式的确定
阶跃式洗脱结果见图3所示。
由图3可以看出,经过阴离子交换色谱分离的胸腺肽含有约23个吸收峰,这与胸腺肽资料中叙述的几十种多肽吻合,但其中4、5、6三个吸收峰没有明显分开。
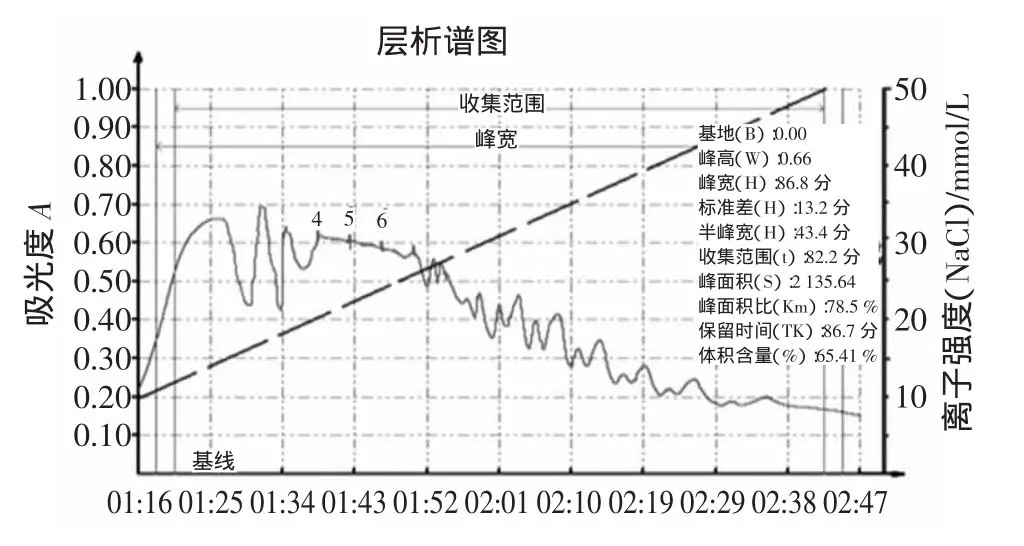
图3 QAE Sephadex A-25梯度洗脱曲线Fig.3 The gradient elution curve of QAE Sephadex A-25
梯度洗脱结果见图4。
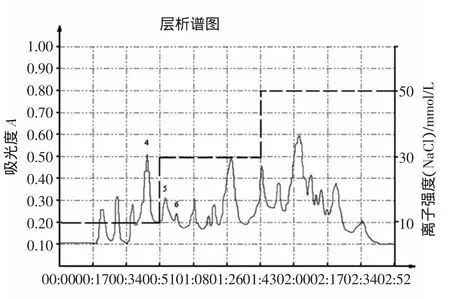
图4 QAE Sephadex A-25阶跃式洗脱曲线Fig.4 The step elution curve of QAE Sephadex A-25
从图4中梯度式洗脱层析图谱可了解到,在30 mmol/LNaCl离子强度洗脱下,共洗脱出19个色谱峰,其中4、5、6三个吸收峰初步洗脱分开,从而确定阶跃式洗脱方式将优于梯度洗脱方式。同时,从层析图谱中可以了解到胸腺肽粗品中直接分离出胸腺肽α1是有一定困难的,因此,将等电点沉淀所得样品进行阴离子交换色谱分析,以期能够得到比较纯的胸腺肽α1。
2.4 流速的优化结果
通过实验得到洗脱速度与出现穿透峰后流出液中蛋白浓度的关系如图5所示。
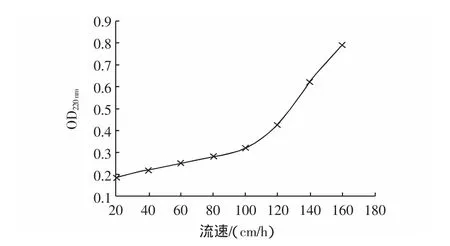
图5 流速与交换后溶液蛋白浓度的关系Fig.5 The relationship between velocity and absorpted
由图5可以看出,当流速在100 cm/h以下时,洗脱后的穿透液OD值比较低并且也比较稳定,这说明样品在流速为100 cm/h以下时得到了充分的吸附;当流速大于120 cm/h时,穿透液的OD值大幅度增加,这说明样品中的多肽在流速高于120 cm/h时没有得到充分吸收,造成样品大量浪费。因此,实验选择流速低于100 cm/h。
同时,流速降低会导致洗脱峰面积增大,半峰宽变大,出现拖尾现象,所以流速也不可以过低,实验选择高于30 cm/h。
2.5 填料高度的优化
在流速为80 cm/h时,填料高度与蛋白吸附程度的关系见图6所示。

图6 80 cm/h时填料高度与OD220nm之间的关系Fig.6 The relationship between column length and OD220nm at 80 cm/L
由图6可以了解到,层析柱在流速为80 cm/h的条件下,随着填料高度的升高OD值逐渐下降,即样品中的多肽吸收的越来越充分;同时,OD值在50 cm的填料高度时并不稳定,说明在此流速下层析柱的填料高度仍要加高,仅50 cm是不能满足要求的,即在此流速下进行离子交换层析是不可取的。
那么确定流速为50 cm/h条件下,对填料高度与OD值的关系重新进行分析,结果见图7所示。
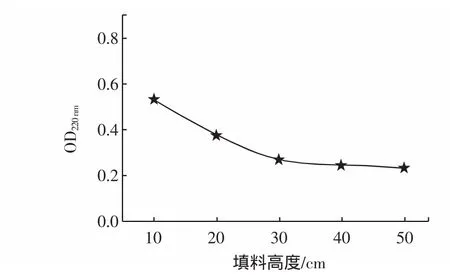
图7 50 cm/h时填料高度与OD220nm之间的关系Fig.7 The relationship between column length and OD220nmat 50 cm/h
由图7可知,当层析柱流速在50 cm/h时,随着填料高度的增加OD值在下降,说明样品中的多肽吸附的越来越充分;在填料高度达到30 cm时,OD值变化趋于稳定,说明在此时离子交换剂对样品吸附的比较充分,所以,在流速为50 cm/h时,可确定填料高度为30 cm。
2.6 正交试验结果
正交试验结果,见表2。
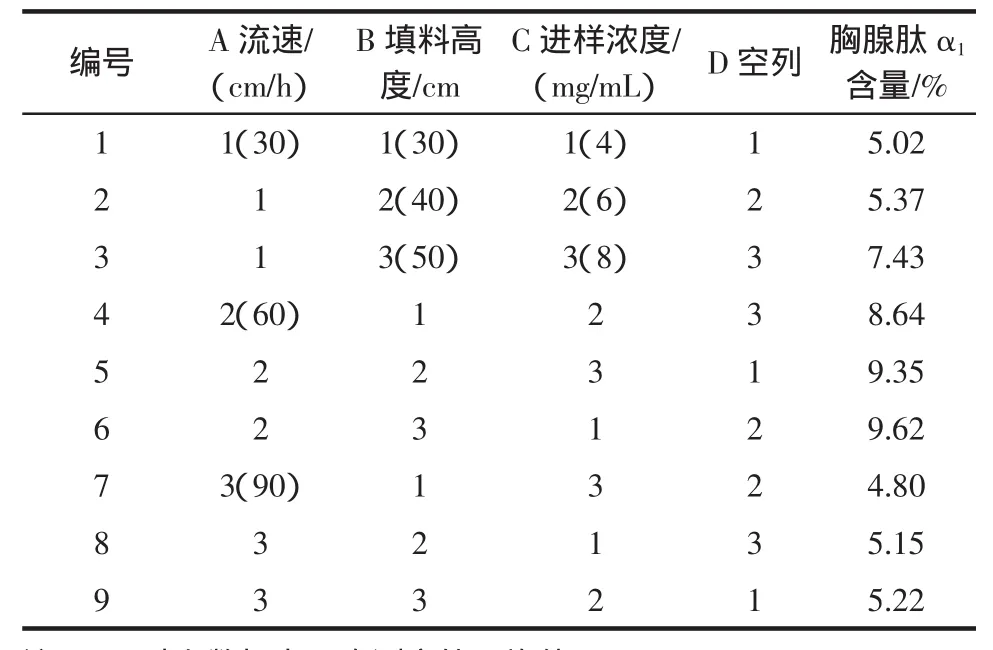
表2 L9(33)正交试验结果Table 2 Factors and Levels of Orthogonal experiment
对正交实验评定指标中的胸腺肽α1含量进行极差分析,结果见表3。
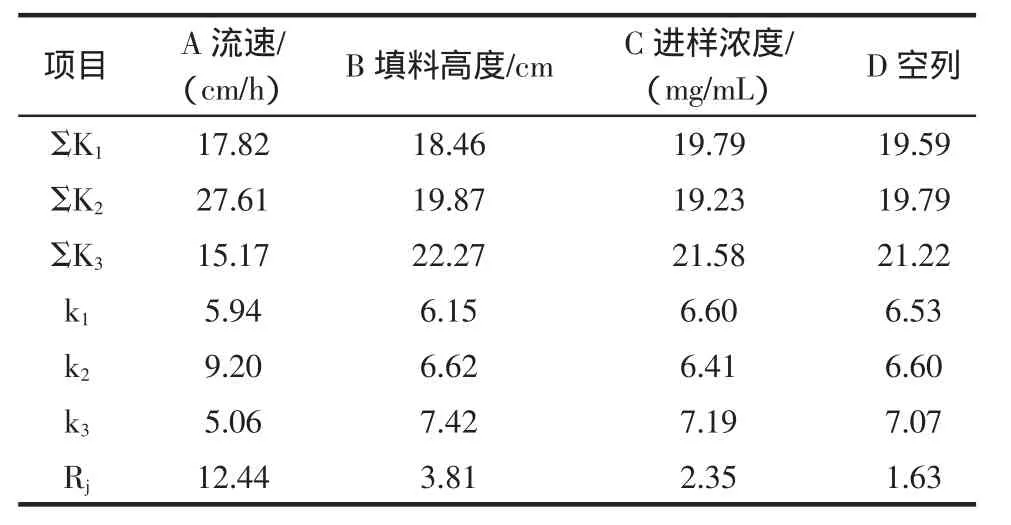
表3 胸腺肽α1含量的极差分析Table 3 Variance analysis of Tα1
由表3中的R值的结果看出,因素A的R值最大,其次是B和C,D的R值最小。极差越大,反映该因素水平变动时,总指标变化越大,即该因素越重要。因此,影响胸腺肽α1含量的因素主次顺序为:A>B>C,即流速>填料高度>进样浓度。
对正交试验评定指标中的胸腺肽α1含量进行方差分析,结果见表4。
表4方差分析结果显示,此模型F值为20.31,Pr(0.0477)<0.05,模型的 R-Square为 0.9838,说明此模型具有意义;实验中3种因素对胸腺肽α1含量的影响程度各不相同,因素A(流速)的F值=54.33,Pr(0.018 1)<0.05,说明在α=0.05时,因素A对胸腺肽α1含量的影响达到显著水平,因素B、C对胸腺肽α1含量的影响不显著。
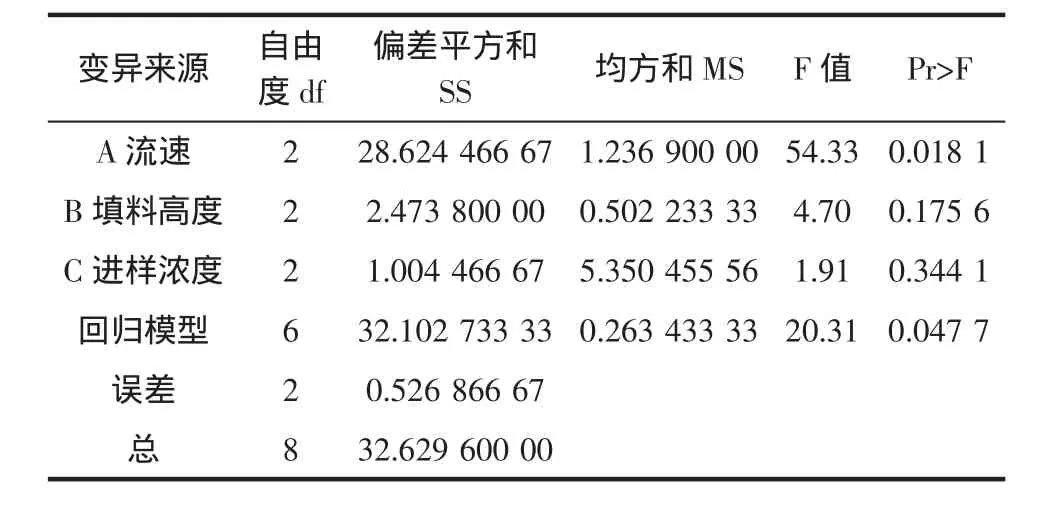
表4 正交试验方差分析表Table 4 ANOAN(analysis of variance)of items of regression equation on Tα1
将各因素对胸腺肽α1含量的影响趋势作直观图,见图8。
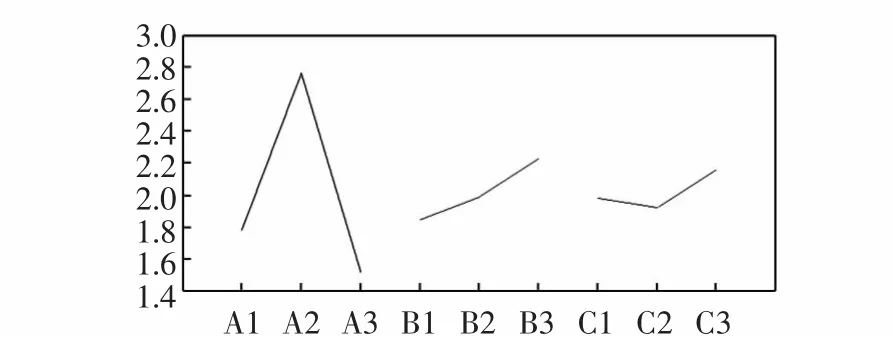
图8 影响胸腺肽α1含量的效应曲线Fig.8 Effect curve of Tα1
由图8选择最佳工艺条件为A2B3C3组合,即流速确定为60 cm/h,填料高度为50 cm,进样浓度为8 mg/mL来采用QAE Sephadex A-25凝胶分离纯化胸腺肽α1。
2.7 验证实验
按照优化的阴离子交换色谱对等胸腺肽α1粗品进行分离纯化,实验结果,见图9。
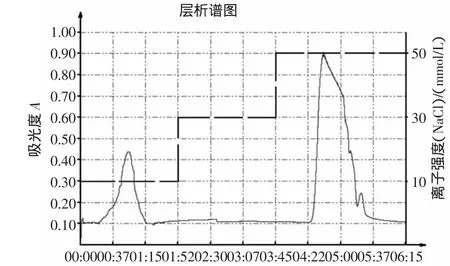
图9 QAE Sephadex A-25等电点沉淀的洗脱曲线Fig.9 The elution curve of isoelectric precipitation in QAE Sephadex A-25
由图9可知,胸腺肽粗品经过等电点沉淀后,于QAE Sephadex A-25凝胶中同样采用阶跃式洗脱分离出3个洗脱峰,说明等电点沉淀除去大量的杂多肽,优化了胸腺肽α1的分离纯化工艺。
2.8 HPLC检测结果与分析
于各个洗脱峰吸取20 μL进行HPLC测定,测定方法参见2.7.7洗脱峰Ⅰ、Ⅱ、Ⅲ的HPLC色谱图分别见图10、图11和图12。
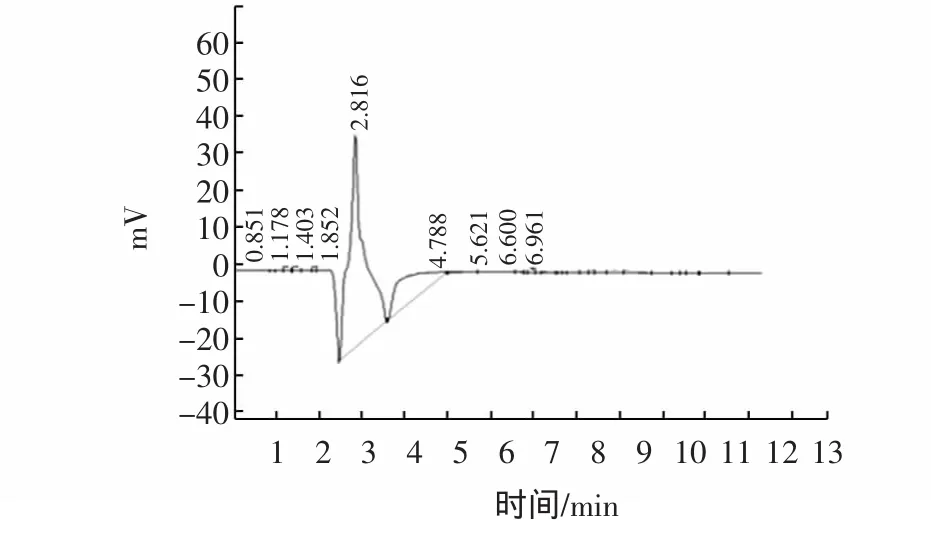
图10 洗脱峰I的高效液相色谱图Fig.10 Chromatogranm for the sample of eluting peak I
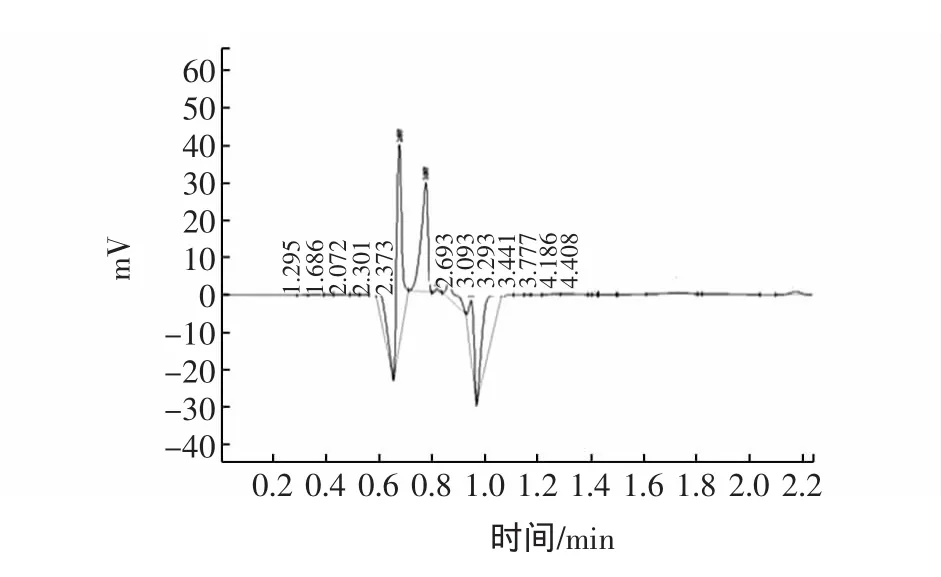
图11 洗脱峰ⅡⅢ的高效液相色谱图Fig.11 Chromatogranm for the sample of eluting peakⅡ
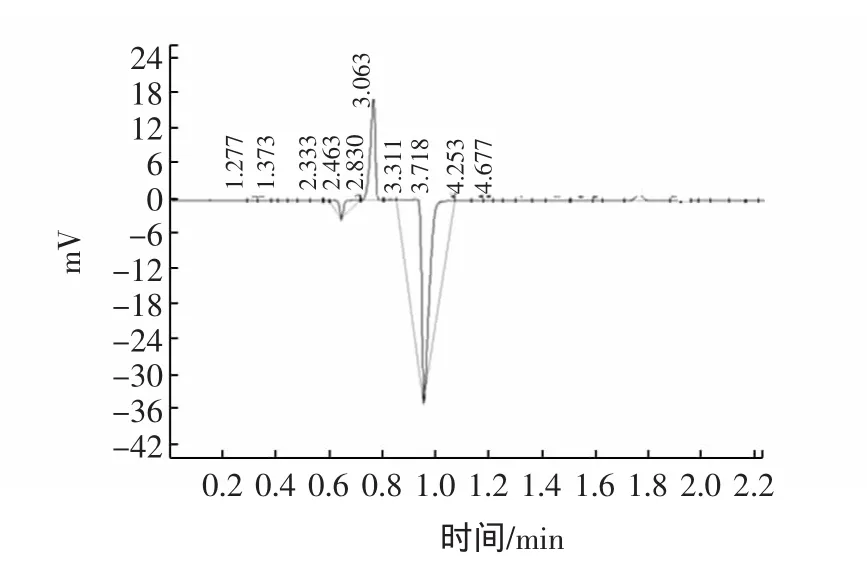
图12 洗脱峰Ⅲ的高效液相色谱图Fig.12 Chromatogranm for the sample of eluting peakⅢ
洗脱峰Ⅰ的保留时间为2.816 min,峰面积为1 399 778,其胸腺肽α1含量高达24.596 6mg/mL,远远高出市场上所销售的胸腺肽中Tα1含量(0.6%~1.0%)。
洗脱峰Ⅱ中Tα1的保留时间为3.093 min,峰面积为365 076,含量约为6.417 9 mg/mL。
洗脱峰Ⅲ中Tα1的保留时间为3.128 min,峰面积为207 480,含量约为3.649 0 mg/mL;由以上情况可以了解到,采用优化的阴离子交换色谱对Tα1进行分离纯化,效果较好,出现三个洗脱峰,经测定,洗脱峰Ⅰ中Tα1的含量达到24.596 6 mg/mL。
3 结论
采用QAE Sephadex A-25阴离子交换介质,pH 7.0、20 mmol/LTris·HCl缓冲液作为离子交换色谱的结合缓冲液(A 液),20 mmol/LTris·HCl,0~50 mmol/LNaCl作为洗脱缓冲液(B液)进行阶跃式洗脱,流速60 cm/h,填料高度50cm,进样浓度8mg/mL对胸腺肽α1纯化,可以达到纯度为24.596 mg/mL的胸腺肽α1制品。
:
[1]沙莹,潘爵南.新型免疫调节剂——胸腺肽α1[J].中国药业,2001,10(11):80-81
[2]Naylor PH,Friedman-Kien A,Hersh E,et al.Thymosin alpha 1 and thymosin beta 4 in serum:comparison of normal,cord.homosexual and AIDS serum[J].Int J Immunopharmacol,1986,8(7):667-676
[3]曹颖瑛.胸腺素α1的研究进展[J].国外医学免疫学分册,1999,22(1):10-11
[4]秦琦.胸腺肽的生产工艺和质量标准的建立[D].长春:吉林大学,2008
[5]刘茗飞,张丽萍.超声波法提取胸腺肽的各影响因素分析[J].农产品加工,2008(5):4-8
[6]朱厚础.蛋白质纯化与鉴定实验指南[M].北京:科学出版社,2000:247
[7]赵思明.食品科学与工程中的计算机应用[M].北京:化学工业出版社,2005:47-54
Studies on the Isolation and Purification of Thymosin α1by Ion-exchange Chromatography
LIU Yan-yan1,2, LIU Ming-fei1, GAO Wei1, ZHANG Li-ping1,2
(1.Department of Food Science, HLJ Bayi Agriculture University, Daqing 163319, Heilongjiang, China;2.Biological and Agricultural Engineering College, Changchun 130022, Jinlin,China)
Abstract:Through purifying thymosin α1and improve the purity of thymosin α1 in order to research a simple and feasible purification technology.The study chooses QAE Sephadex A-25 and D208,D301,717 ect.for static IV adsorption experiment through the anion exchange chromatography in order to determine the optimumion exchange media; The optimal experiment conditions of the eluent, eluting style, flow rate,height of media are studied and chooseL9(33)orthogonal experiment on optimizing the conditions of the velocity, height and the concentration.The study choosesHPLC and SDS-PAGE to identifying the thymosin α1. The experiment showed that theQAE Sephadex A-25 as a fillermedia adsorbing thymosin α1makes the best effect, the velocity is 60 cm/h, packing height is 50 cm,the concentration is 8 mg/mL,then the purification results is satisfactory.Determined by the HPLC,the purity of thymosin α1is 24.596 6 mg/mL, the mass percent is 12.03%.The method is accurate and feasible.The purity of thymosinα1is 10 times higher than the commercial thymosin α1 products (themass percent is 0.6%to 1.0%).
Key words:Thymosin α1; ion-exchange chromatography; isolation and purification
DOI:10.3969/j.issn.1005-6521.2013.12.006
黑龙江省科技攻关项目(NOGB 06B0403-3)
刘妍妍(1979—),女(汉),讲师,硕士,研究方向:畜产品加工。
2012-09-10
