T-2毒素胶体金免疫层析快速检测试纸条的研制
2013-07-22徐小婧王俊平王霄雪谈超王硕张燕
徐小婧,王俊平,王霄雪,谈超,王硕,张燕
(天津科技大学食品营养与安全教育部重点实验室,天津 300457)
T-2 毒素为白色针状结晶,熔点150 ℃~151 ℃,难溶于水,易溶于极性溶剂,如三氯甲烷、丙酮和乙酸乙酯等。烹调过程不易将其破坏。分子式为C24H34O9,分子量为466。基本结构为四环的半倍萜,C-9 和C-10 位上有不饱和双键,在紫外灯下不显荧光。
T-2 毒素(T-2 toxin)是真菌毒素之一,属于单端孢霉烯族化合物中的A 族。是该类化合物中毒性最强的毒素之一。在近年来被确定为大骨节病、食物中毒性白细胞缺乏症的致病因子。毒性分级为剧毒,有明显的细胞毒和对蛋白质、DNA 合成的抑制作用,并有肯定的致畸性和致突变性[1-2]。主要污染小麦、玉米、大麦、燕麦和黑麦等谷物及麦芽、啤酒等食品,在美洲、欧洲等各洲的谷物中广泛存在,国内报道在大骨节病病区小麦和玉米中均有检出[3]。目前国际上对T-2 毒素制订的限量标准不多,前苏联等多国规定在粮食中允许标准为100 μg/kg[4]。
有关T-2 毒素的检测方法等的研究,国内外开展的比较多。目前,检测粮谷类食品和饲料中T-2 毒素的方法主要有薄层色谱法(TLC)、液相色谱法(LC)、气相色谱法(GC)、气质联用(GC-MS)、酶联免疫吸附测定法(ELISA)等。传统分析方法需要昂贵的仪器,对技术人员要求高,样品需经过繁琐的前处理,成本高,分析速度慢,很难达到快速、简便和现场检测要求,更难以适应大量复杂样品的检测。而胶体金免疫层析方法具有简便快速、灵敏直观、无需仪器等特点,因此被广泛地应用于快速检测,临场检测等领域。但采用胶体金免疫层析法快速半定量测定T-2 毒素少有报道。本试验根据胶体金免疫层析试验(GICA)原理成功研制出T-2 毒素胶体金免疫层析快速检测试纸条,建立了一种快速、有效的T-2 毒素检测方法,现将试验结果报道如下。
1 材料与方法
1.1 试剂与仪器
T-2 毒素(T-2 toxin)、卵清蛋白(OVA)、牛血清蛋白(BSA)、琥珀酸酐(HS)、二甲基酰胺(DMF)、二抗(羊抗兔):Sigma 公司;抗T-2 毒素兔多克隆抗体:天津科技大学食品营养与安全重点实验室免疫纯化得到;氯金酸(HAuCl4):Acoros 公司;柠檬酸三钠:Fluka 公司;聚乙二醇(PEG20000):Biobasic 公司;Millipore 硝酸纤维素膜H180(NC 膜)、玻璃纤维膜、PVC 底板、吸水纸均购自上海金标生物科技有限公司;甲醇、氯化钠、无水碳酸钠、碳酸氢钠:天津化学试剂六厂;磷酸盐缓冲液PBS(0.01 mol/L,pH 7.4)。
旋蒸仪:瑞典Buchi 公司;超纯水系统:美国Millipore 公司;低温高速离心机:德国Eppendorf 公司;双维平面华划膜仪、全自动斩切机:上海金标生物科技有限公司;真空干燥箱:三水公司。
1.2 方法
1.2.1 T-2 毒素完全抗原的制备
1)半抗原的合成参考Chu[5]的方法:取5 mg T-2毒素溶于1 mL 无水吡啶中,加入105 mg 琥珀酸酐,在油浴(105 ℃)的条件下反应4 h。反应物减压干燥后溶于氯仿,水洗4 次。氯仿层旋干,即得到T-2 HS 结合物。
2)T-2 HS 结合物与载体蛋白的连接采用活化酯法[6]:称取5 mg T-2 HS 与1.27 mg N-羟基琥珀酰亚胺溶于1 mL 无水四氢呋喃中,在氮气保护下加入2.27 mg N,N'-二环己基碳二亚胺,室温,反应过夜。反应物在相对离心力450 g,离心15 min。取上清液旋干。得到活化酯,质谱鉴定产物。
3)称取5 mg OVA 溶于1 mL 磷酸氢二钾缓冲液(50 mmol/L K2HPO4,pH 9.3)中,取制备的活化酯溶液90 μL 缓慢滴加到蛋白缓冲液中,过程要在冰浴中进行,滴加完毕后放入4 ℃冷藏柜反应过夜,取出后在室温下放置1 h~2 h,将连接液装入透析袋,用PBS 溶液透析3 d,每天换3 次。收集透析后液体加入10 μL 的0.01 mg/L 的叠氮钠,分装后-20 ℃保存。
1.2.2 胶体金的合成与表征
取100 mL 氯金酸溶液(1.0×10-4g/mL)置于250 mL的锥形瓶中,在磁力搅拌的同时加热至沸腾,沸腾后迅速加入柠檬酸钠水溶液(浓度为0.01 g/mL)2 mL,5 min之内颜色变化并且稳定,后继续加热15 min,之后移去热源,室温放置至冷却,最后用去离子水补充失去的水分,4 ℃下保存备用。
1)肉眼观察:用肉眼观察所制得的胶体金溶液,观察其颜色、均匀度和透明度。
2)可见光光度法:用紫外可见光分光光度仪对胶体金在紫外可见光范围内(200 nm~600 nm)进行扫描,获得胶体金紫外可见光吸收光谱,测定最大吸收波长、吸光值和峰宽。
3)扫描电镜:在扫描电镜下观察胶体金颗粒的大小是否均匀一致,有无不规则形状。拍片放大后测量胶体金颗粒直径大小,取多个点计算胶体金颗粒的平均直径(由天大科技园完成)。
1.2.3 胶体金标记抗体蛋白
因为胶体金是胶体,所以当含有电解质时会造成胶体金的聚沉,所以应该尽量保证抗体中较低的含盐量,这样标记前抗体必须彻底除盐,将待标记的T-2毒素多克隆抗体置入透析袋中在双蒸水或极低浓度的盐水(5 mmol/L NaCl,pH 7.0)中4 ℃透析过夜,除去多余的盐离子[7]。
量取10 mL 胶体金溶液,将pH 调至8.5,在搅拌状态下向其中逐滴加入200 μL 浓度为1 mg/mL 的除盐抗体,保持搅拌1 h,加入200 μL 浓度为0.2 g/mL BSA 水溶液及100 μL 浓度为0.1 g/mL PEG20000 水溶液作为稳定剂,继续搅拌0.5 h。
1.2.4 金标记抗体的纯化及表征
在4 ℃低温下,先2 000 r/min 低速离心15 min,吸取上清液;然后将所得上清液以12 000 r/min 高速离心30 min,仔细吸出上清;底层红色液体用金标储存液重悬为原体积1/10,4 ℃保存备用。
将与抗体标记的胶体金溶液与未标记的胶体金溶液在紫外下进行全波长扫描,观察波形变化,判断是否标记成功。
1.2.5 层析条件的优化
1)分别对二抗、包被原、金标抗体的包被量进行优化。
2)对包被原稀释液及包被条件进行优化。
3)对金标垫的干燥方式、金标垫泡垫配方及封闭NC 膜的封闭液做优化。
1.2.6 试纸条的组装
将样品垫、金标垫、已包被好抗原抗体的NC 膜、吸水纸依次粘贴到PVC 底板上,切割成条,用封口袋密封,置于干燥器中常温保存备用。
1.2.7 试纸条的检测方法与最低检测限的确定
将试纸条插入样品液中,待样品液浸润金标垫后取出平放10 min 后观察。如果检测线、质控线上均出现红色条带,说明样品呈阴性;如果只有质控线上出现红色条带说明样品呈阳性;如果质控线上无条带,说明试纸条失效。
用甲醇稀释T-2 毒素标准品至10 mg/L,然后用优化好的标品稀释液分别稀释浓度至5、10、50、100、200 ng/mL,并设一个空白阴性对照,插入试纸条,10 min判定结果,每个浓度重复6 次。取质控线刚好消失的浓度为最低检测限。
1.2.8 试纸条的稳定性与重复性确定
取同批次试纸条分别置于4 ℃与37 ℃作7 d 对照试验,每个浓度重复做3 次。取不同批次及批间的试纸条作对照试验,每个浓度重复3 次。
2 结果与分析
2.1 胶体金的合成与质量鉴定
胶体金的制备过程和胶体金探针的标记是获得可靠结果的关键,在其胶体金制备的过程当中应特别注意用于制备胶体金的玻璃器皿必须非常清洁,特别要防止油脂污染,这是因为玻璃表面性状对还原过程的成功与否有重要作用,如果有少量的污染就会影响金颗粒的生成,造成颗粒大小不一或液体混浊。所制备的胶体金溶液如出现浑浊、聚集、沉淀、颗粒不均,都是不符合标记的标准的[8],一概不能使用。柠檬酸钠还原法是合成胶体金的经典方法,胶体金颗粒尺寸、粒径分布、晶体结构和分散度都受到反应动力学的影响,而影响反应动力学的因素又包括还原剂的用量、反应温度、pH 等[9]。本实验通过筛选最终选择20 nm 的胶体金作为标记物。
用肉眼观察,可见胶体金溶液外观呈深红色,色泽均匀清亮,表面没有漂浮物。胶体金溶液500 nm~600 nm 的紫外可见光扫描图谱如图1。
由图1 可知,只有一个最大的吸收峰λmax=520 nm,最大吸收峰峰值为1.625,而且制备的胶体金溶液峰宽较小,波形光滑,说明制得的胶体金溶液的颗粒大小比较均匀。
图2 为胶体金的扫描电镜图。
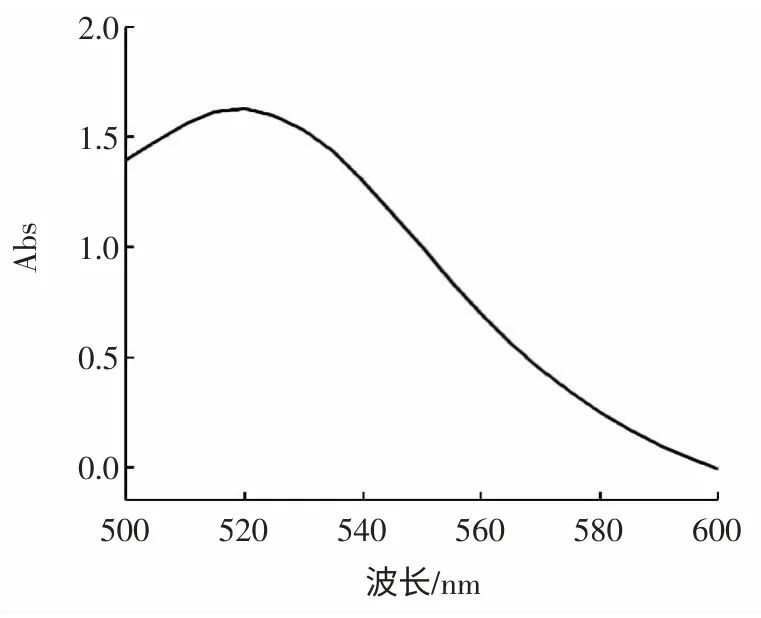
图1 胶体金的可见光吸收光谱Fig.1 Visible-light absorbance spectrum of colloidal gold
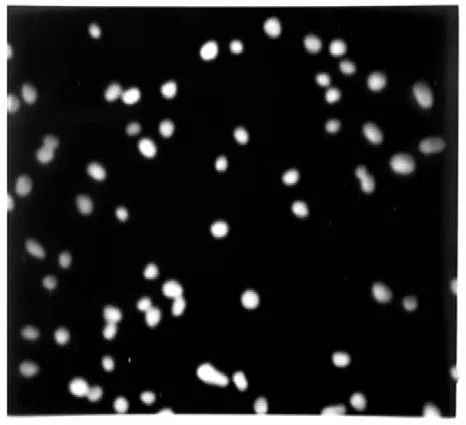
图2 胶体金电镜扫描图(Bar=100 nm)Fig.2 Determination of colloidal gold by scanning electron microscope
由图2 可知,可以观察到胶体金颗粒粒径比较均一,且无椭圆形和多角形的金颗粒存在,放大后取多点测量胶体金粒径为20 nm。
2.2 金标抗体的质量鉴定
将与抗体标记的胶体金溶液与未标记的胶体金溶液在紫外下进行全波长扫描,结果见图3,上面的峰为标记后的胶体金溶液在紫外下的吸收峰,下边的峰为未标记的胶体金溶液在紫外下得吸收峰。
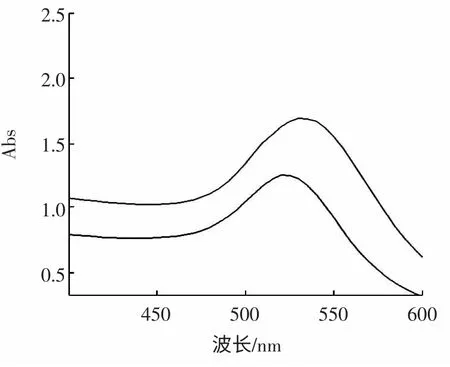
图3 紫外可见扫描抗体标记胶体金Fig.3 Ultraviolet light absorbance spectrum of colloidal gold labeled with T-2 toxin Ab
由图3 可见,胶体金溶液在紫外下进行全波长扫描,得到最大的吸收波长是520 nm,胶体金标记了T-2毒素多克隆抗体后,其最大吸收峰出现了位移,在540 nm 处波长出现,有此判断抗体已经标记上了胶体金。
2.3 层析条件的确定
1)对二抗稀释倍数、包被原稀释倍数、金标抗体稀释倍数做正交试验优化,最终确定三者所用的稀释倍数分别为1 ∶600、1 ∶1、1 ∶20。
2)由于T-2 毒素微溶于水,易溶于有机溶剂。在包被原稀释液中加入一定量的甲醇有利于包被原与NC 膜更稳固的结合。最终优化用3%的甲醇PBS(pH 7.4,0.01 mol/L)溶液稀释包被原包被于NC 膜上。为了缩短包被时间,采用了烘箱37 ℃包被1 h。
3)金标垫经喷金后分别放于室温、37 ℃鼓风烘箱、37 ℃真空干燥箱进行干燥,最终37 ℃真空干燥箱干燥效果最好,金标抗体释放完全。在金标抗体释放过程中,蔗糖与BSA 的加入可以起到整体增色的效果,Tween20 等表面活性剂的加入可以加速金标抗体的释放速度,所以采取10%蔗糖,5%BSA,0.1%Tween 20,0.1%NaN3的金标垫泡垫配方,在喷金前预先泡垫。同时为尽量减少NC 膜的非特异性吸附选用含1 %BSA 的PBS 缓冲液对NC 膜进行封闭。
2.4 最低检测限的确定
采用已优化好的条件,制备好免疫层析试纸条测定T-2 毒素的最低检测限,结果见图4。
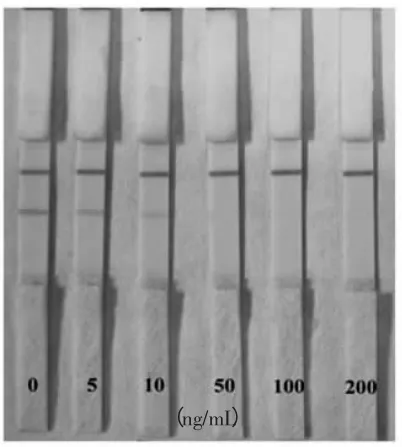
图4 T-2 毒素检测限的确定Fig.4 Assay sensitivities for T-2 toxin
如图4 所示,T-2 毒素标品浓度为50 ng/mL 时质控线恰好消色,此即为试纸条方法的最低检测限。
2.5 方法检测的特异性
将HT-2 毒素,赭曲霉毒素A,伏马毒素B1,黄曲霉毒素B1等溶于含3%甲醇的PBS(pH 7.4,0.01 mol/L),配成1 000 ng/mL 浓度,然后用检测试剂检测。结果表明,本检测试剂与以上物质在1 000 ng/mL 浓度时没有交叉反应。因此本检测试剂可以通过观察试剂上检测线的有无及颜色变化进行定性检测,对T-2 毒素具有较高的特异性。
2.6 重复性及稳定性的确定
随机抽取不同批次和批间制备的试纸条进行重复检测实验,检测结果基本一致。说明该方法重复性好。
采用加速试验进行稳定性研究,37 ℃保存7 d 相当于4 ℃保存6 个月[10]。研究发现,胶体金标记抗体在37 ℃保存4 d 后,试纸条的质控线颜色明显变浅,检出限降低至25 ng/mL,说明金标抗体在3 个月的保存期内稳定性较好。
3 结论与展望
目前,食品中T-2 毒素的检测方法很多,但各有其优缺点。本试验研制的T-2 毒素免疫层析试纸条灵敏度高、重复性较好,具有检测快速,操作简单,无需专业人员或仪器检测,目测即可观察结果,适用于快速检测及临场检测。
分析稳定性较差的原因可能是因为T-2 包被原在储藏的过程中T-2 毒素从大蛋白分子上脱落,这是由于T-2 毒素连接蛋白分子的结构不稳定,可进一步选用其他更好的接臂方式制备半抗原连接蛋白做包被原。可进一步将T-2 毒素试纸条应用于实际样品的检测中。
[1]唐晓波.谷物中A 类单端孢霉烯族真菌毒素检测方法研究进展[J].中国地方病学杂志,2003,22(6):567-570
[2]吴永宁.现代食品安全科学[M].北京:化学工业出版社,2003:314-315
[3]杨建伯.中国“大骨节病”防治策略的继续诠释[J].中国地方病学杂志,2004,23(1):3-6
[4]Si-yuan Li,Jun-ling Cao,Zhong-li Shi,et al.Promotion of the articular cartilage proteoglycan degradation by T-2 toxin and selenium protective effect[J].Journal of Zhejiang University Science,2008,9(1):22-33
[5]Chu FS,S Grossman.Production of Antibody Against T-2 Toxin[J].Applied and environmental microbiology,1979,37(1):104-108
[6]Wang S,Allan RD,Skerritt JH,et al.Development of a compand specific ELISA for flufenoxuron and an improved class-specific assay for benzoylphenylurea insect growth regulators[J].Journal of agricultural and food chemistry,1999,47:3416-3424
[7]Dykman L A,Bogatyrev V A.Colloidal gold in solid phase assays[J].Biochemistry(Moscow)1997,62:350-356
[8]Bassab C,Syamal R.Manufacturing high-quality gold sol[J].IVD technology,2001,8(3):46-54
[9]关嵘.应用酶联免疫技术检测动物源性食品中氯霉素残留的研究[J].检验检疫科学,2002,12(4):5-10
[10]邓省亮.胶体金免疫层析法快速检测黄曲霉毒素B1的研究[J].食品科学,2007,28(2):232-235
