迷迭香总黄酮的提取工艺
2013-07-22陈宝张立颖沈芳樊红日刘雄民冯龙
陈宝,张立颖,沈芳,*,樊红日,刘雄民,冯龙
(1.广西大学化学化工学院,广西南宁 530004;2.广西工业职业技术学院食品与生物工程系,广西南宁 530001)
迷迭香(Rosmarinus officinalis L.)属唇形科迷迭香属植物[1],原产地中海沿岸一带,目前我国很多地区都有种植。迷迭香中含有萜类、黄酮、有机酸、多支链烷烃及氨基酸等多种化学成分。其中,黄酮类成分的研究较早,迄今为止已从迷迭香中分离出30 余种黄酮类化合物,主要包括橙皮素、芹菜素、蓟黄素、白杨素、高车前苷、6-羟基木犀草素-7-葡萄糖苷等,具有抗菌、消炎、降压、抗氧化、抗癌等作用[2-3]。迷迭香总黄酮的研究仅见吴建章等[4]对迷迭香黄酮的甲醇索氏提取,且黄酮提取率较低。本试验以广西巴马迷迭香为原料,采用乙醇热浸提法[5-6]提取黄酮类化合物,并优化提取工艺,旨在提高总黄酮的提取率,为该资源的开发利用提供科学的理论参考。
1 材料与方法
1.1 材料和试剂
广西巴马迷迭香;芦丁标准品,中国药品生物制品检定所;无水乙醇、石油醚(沸程60 ℃~90 ℃)、亚硝酸钠、九水合硝酸铝、氢氧化钠等均为国产分析纯(AR)。
1.2 仪器
UV-2550 型紫外可见分光光度计:日本岛津公司;DF-101B 集热式恒温加热磁力搅拌器:巩义市英峪予华仪器厂;FZ102 型微型植物粉碎机:天津市泰斯特仪器有限公司;AR224CN 电子天平:奥豪斯仪器(上海)有限公司。
1.3 方法
1.3.1 迷迭香总黄酮的提取
提取工艺流程:干燥的迷迭香→粉碎过60 目筛→石油醚回流脱脂、脱色→风干→精确称取定量脱脂干粉→乙醇回流浸提→冷却、抽滤→总黄酮提取液→定容至料液比相应体积得供试品溶液。
1.3.2 标准曲线的制作[7]
精确称取在120 ℃干燥至恒重的芦丁标准品5.0 mg,置于50 mL 棕色容量瓶中,用60 %的乙醇溶解并定容至刻度线,配得0.1 mg/mL 的芦丁标准溶液。精确量取该芦丁液0.2、0.4、0.6、0.8、1.0、1.2、1.4、1.6 mL,分别置于10 mL 容量瓶中,分别加入5 %的NaNO2溶液0.3 mL,摇匀,静置6 min;再分别加入10 %的A(lNO)33溶液0.3 mL,摇匀,静置6 min;最后分别加入4 %的NaOH 溶液4.0 mL,用60 %的乙醇溶液定容至刻度线,摇匀,静置15 min。以相应试剂为空白,于505 nm波长处测定样液吸光度,并绘制芦丁标准溶液浓度C(mg/mL)与吸光度A 的标准曲线。
1.3.3 总黄酮含量的测定
精密吸取40 μL 供试品溶液置于10 mL 容量瓶中,按照“1.3.2”中方法测定吸光度,根据标准曲线回归方程计算供试品中总黄酮的含量,并用下面的公式计算总黄酮的提取率:

1.3.4 精密度试验
精密吸取芦丁对照品溶液适量,按“1.3.2”方法重复测定6 次,RSD =0.31%。
1.3.5 稳定性试验
对同一份供试品溶液,每隔5 min 按“1.3.2”方法测定1 次含量,共测6 次,RSD=1.12%,表明迷迭香提取液在30 min 内稳定。
1.3.6 加标回收试验
精密吸取已知含量的样品6 份,分别加入不同体积的芦丁对照品溶液,按“1.3.2”方法测定,平均回收率为99.81%,RSD=2.78%。
2 结果与讨论
2.1 标准曲线
标准曲线见图1。
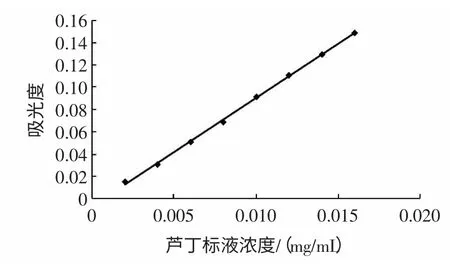
图1 芦丁标准曲线Fig.1 Standard curve of rutin
芦丁标准溶液在浓度0.002 mg/mL~0.016 mg/mL范围内与吸光度呈良好的线性关系,其回归方程y=9.685 7x-0.006 4,相关系数R2=0.999 1,x 为芦丁标准溶液浓度(mg/mL),y 为吸光度A。
2.2 乙醇浓度对总黄酮提取率的影响
精确称取2.000 g 迷迭香干粉5 份,按料液比1 ∶20(g/mL)分别加入浓度为40%、50%、60%、70%和80%的乙醇各40 mL,70 ℃回流提取3 h,结果见图2。
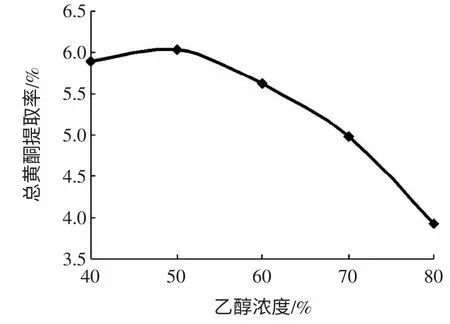
图2 乙醇浓度对总黄酮提取率的影响Fig.2 Effect of ethanol concentration on yield of total flavonoids
由图2 可知,随着乙醇浓度的增加,总黄酮提取率先增大而后减小。当乙醇浓度为50%时,总黄酮提取率最大。当乙醇浓度继续增加时,总黄酮提取率依次减小,这可能是由于一些脂溶性杂质、亲脂性强的成分溶出增多,导致黄酮类化合物的浸出减少。故选择50%乙醇为迷迭香总黄酮最佳提取浓度。
2.3 料液比对总黄酮提取率的影响
精确称取2.000 g 迷迭香干粉5 份,按料液比1 ∶10、1 ∶20、1 ∶30、1 ∶40、1 ∶50(g/mL)分别加入浓度50%乙醇,70 ℃回流提取3 h,结果见图3。
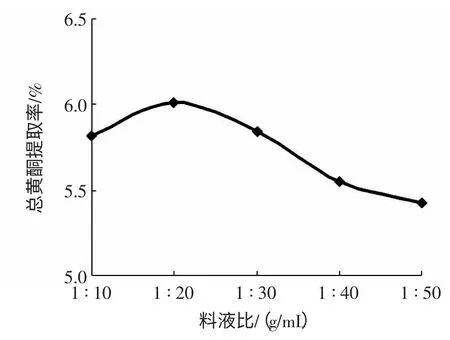
图3 料液比对总黄酮提取率的影响Fig.3 Effect of solid-liquid ratio on yield of total flavonoids
由图3 可知,随着提取溶剂的增加,总黄酮提取率先增大而后减小。当原料一定时,溶剂用量越多原料颗粒周围浓度越低,细胞壁内外浓度差越大,这样有利于有效成分的溶出。料液比为1 ∶20(g/mL)时,总黄酮提取率最大。当溶剂用量继续增加时,因溶剂挥发带来的损失会增大,导致提取率有所减小。故选择1 ∶20(g/mL)为迷迭香总黄酮最佳提取料液比。
2.4 提取时间对总黄酮提取率的影响
精确称取2.000 g 迷迭香干粉5 份,按料液比1 ∶20(g/mL)各加入浓度50%乙醇,70 ℃分别回流提取1、2、3、4、5 h,结果见图4。
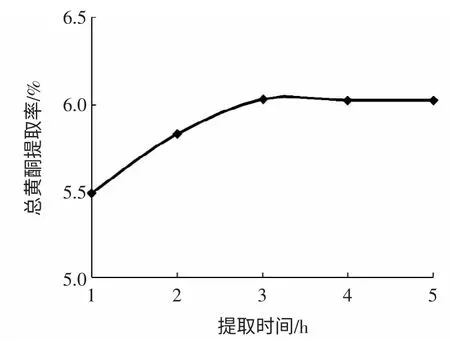
图4 提取时间对总黄酮提取率的影响Fig.4 Effect of extraction time on yield of total flavonoids
由图4 可知,当提取时间为3 h 时,总黄酮提取率最大,继续延长提取时间,提取率反而略微减少,并趋于平稳,这可能是由于长时间浸提使得部分黄酮类化合物受热损失。故选择3 h 为迷迭香总黄酮最佳提取时间。
2.5 提取温度对总黄酮提取率的影响
精确称取2.000 g 迷迭香干粉5 份,按料液比1 ∶20(g/mL)各加入浓度50%乙醇,分别于50、60、70、80、90 ℃回流提取3 h,结果见图5。
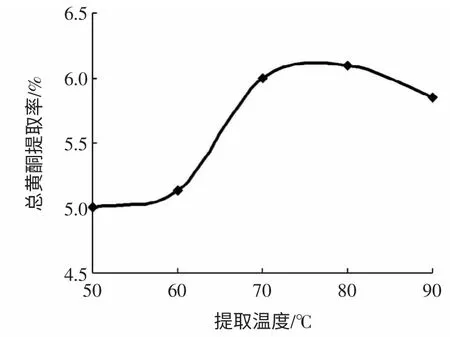
图5 提取温度对总黄酮提取率的影响Fig.5 Effect of extraction temperature on yield of total flavonoids
由图5 可知,在80 ℃以前,总黄酮提取率随温度的升高而逐渐增大。当温度达到80 ℃时,提取率最大。随着温度的继续升高,总黄酮提取率反而下降,这是因为高温下溶剂挥发,浸提效果变差,同时部分黄酮类物质可能被破坏,导致提取率的减小。故选择80 ℃为迷迭香总黄酮最佳提取温度。
2.6 正交试验
选取乙醇浓度、料液比、提取时间和提取温度进行四因素三水平正交试验。正交试验因素水平见表1,正交试验设计及结果见表2。
由表2 可知,4 个因素对总黄酮提取率影响的主次顺序为B>C>A>D,即料液比>提取时间>乙醇浓度>提取温度。提取条件的最优组合为A2B2C2D3,即乙醇浓度为50%,料液比为1 ∶20(g/mL),提取时间为4 h 和提取温度90 ℃。在此条件下,3 次重复试验,迷迭香总黄酮提取率达6.31%。
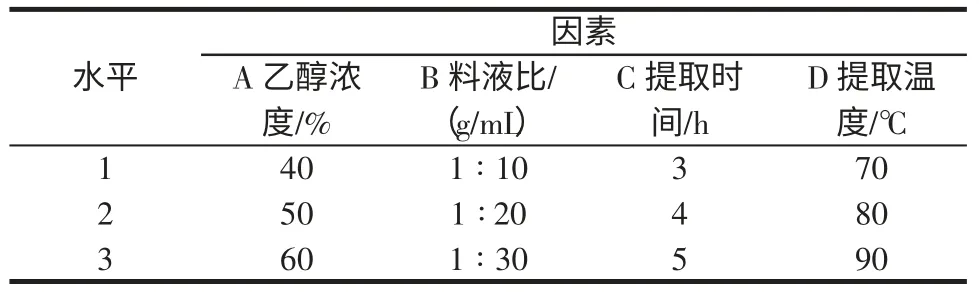
表1 正交试验因素水平表Table 1 Factors and levels of orthogonal test
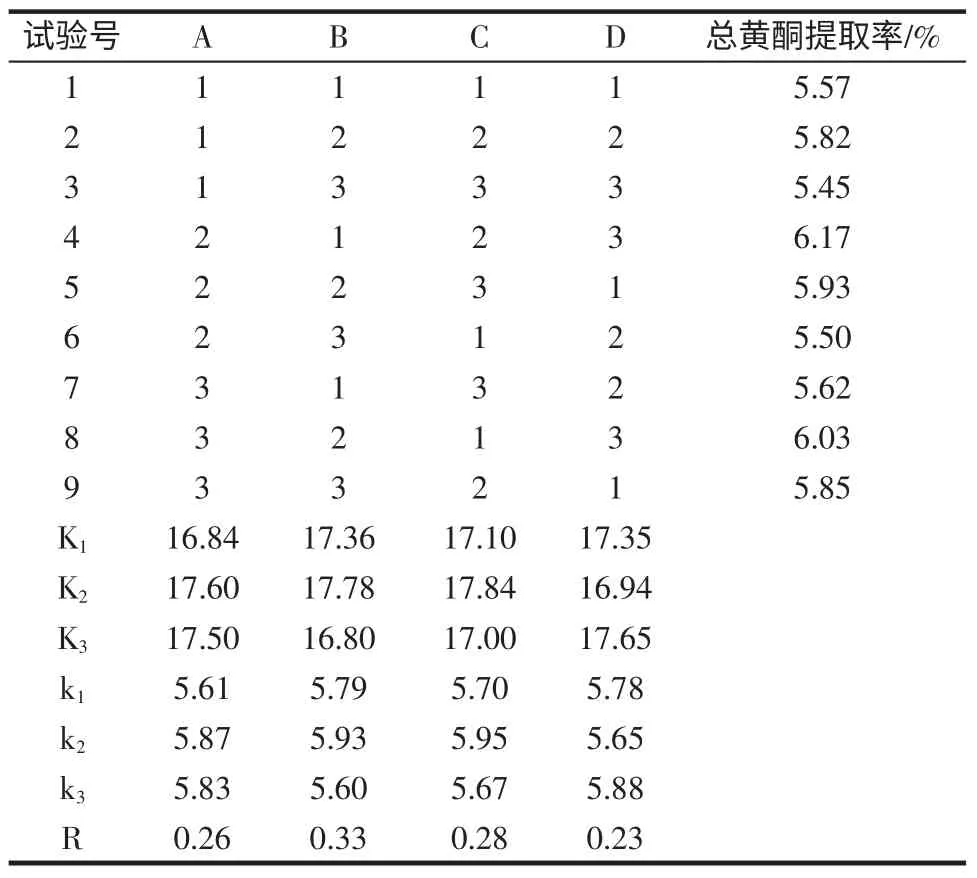
表2 正交试验设计及结果Table 2 The design and results of orthogonal test
3 结论
通过单因素及L(934)正交试验确定迷迭香总黄酮最佳提取工艺条件:乙醇浓度为50%,料液比为1 ∶20(g/mL),提取时间为4 h 和提取温度为90 ℃。在最佳提取工艺条件下,提取率为6.31%。
[1]江苏新医学院.中药大辞典[M].上海:上海科技出版社,1986:1738-1739
[2]郑汉臣,蔡少青.药用植物学与生药学[M].北京:人民卫生出版社,2004:127-129
[3]包辉,王照友,王赞.黄酮类化合物研究现状及发展趋势[J].科技风,2011(10):163
[4]吴建章,郁建平,艾长春,等.迷迭香中微量元素与黄酮类化合物的含量分析[J].光谱实验室,2008,25(4):627-629
[5]刘琦,辛秀兰,兰蓉,等.金花葵花中总黄酮提取工艺的研究[J].食品研究与开发,2011,32(7):19-21
[6]田国政,何义发.薇菜叶总黄酮提取工艺条件优化[J].食品科学,2010,31(22):283-285
[7]查甫本,陈向明.山核桃外果皮黄酮提取条件的研究[J].合肥学院学报,2009,19(3):68-71
