猴头菇不同活性部位体外抗氧化活性研究
2013-07-22吴美媛王喜周周英王超许维丹
吴美媛,王喜周,周英,王超,许维丹
(丽水学院成教学院,浙江丽水 323000)
猴头菇(Hericium erinaceus),又名猴头蘑、熊头菇、刺猬菇,录属于担子菌门,猴头菌科,是著名的药食两用菌。猴头菇性平,味甘,能利五脏,助消化,具健胃,益精,补虚,抗癌之功效。现代研究表明猴头菇可增强机体免疫力、抗溃疡、抗肿瘤及延缓衰老等多种作用[1-2]。
自由基是生物体氧化过程中产生的中间代谢产物,与机体衰老有密切关系,机体不断产生和清除自由基,以保持动态平衡。如果机体产生自由基的能力超出了清除能力,自由基就会直接或间接地引起蛋白质变性、多糖降解、DNA 断裂,造成细胞损伤或死亡[3],补充清除机体自由基的营养物质,对维护人体健康,延缓衰老有很大的意义[4]。本课题以抗氧化活性为指标,筛选了猴头菇的提取溶剂,制备出具有优良抗氧化活性的提取物,同时为猴头菇功能食品的开发提供了参考。
1 仪器与试剂
1.1 仪器
BS124S 电子天平(Sartorius);LZ-26 薄膜蒸发浓缩器(厦门化工医药机械厂);DL-6000B 离心机(湖南赛特湘仪离心机仪器有限公司);Shimadzu2450 紫外可见分管光度计(日本岛津公司)。
1.2 试剂
猴头菇细粉:100 目,浙江方格药业有限公司;ABTS试剂:singma;DPPH 试剂:singma;丙酮、乙醇、水杨酸、硫酸亚铁、双氧水、磷酸一氢钠、磷酸二氢钠:均为分析纯,国药集团化学试剂有限公司。
2 方法
2.1 样品溶液制备
分别用水、50%乙醇和丙酮提取猴头菇。水提取物:称取猴头菇细粉20 g,置于500 mL 圆底烧瓶中,加30 倍蒸馏水,100°C 浸提3 h,过滤,滤液减压浓缩,即得水提取物;醇提取物:称取猴头菇细粉20 g,置于500 mL 圆底烧瓶中,加15 倍50 %乙醇,75 °C 浸提1.5 h,过滤,滤液减压浓缩,即得醇提取物;丙酮提取物:称取猴头菇细粉20 g,置于500 mL 圆底烧瓶中,加15 倍丙酮,55°C 浸提1.5 h,过滤,滤液减压浓缩,即得丙酮提取物。
称取水提取物、乙醇提取物、丙酮提取物各2.0 g,分别用相应的溶剂将其配置成0.2、0.4、0.6、0.8、1.0、2.0 mg/mL 的样品溶液,备用。
2.2 体外抗氧化活性测定
分别测定猴头菇水提物、乙醇提取物及丙酮提取物对·OH 自由基、DPPH·自由基及ABTS+自由基的清除能力,数据采用SPSS16.0 处理,组间比较采用方差分析和t 检验。
2.2.1 ·OH 自由基清除能力测定
分别取不同浓度样品2 mL 于试管中,依次加入6 mmol/LFeSO4,6 mmol/LH2O2各2mL,摇匀,静置10min,再加6mmoL/L 水杨酸2mL,摇匀,静置30min,于510nm处测定Ai,以蒸馏水代替6 mmoL/L 水杨酸,测得Aj,以蒸馏水代替样品测定A0,重复3 次,按下式计算·OH自由基抑制率[5]。
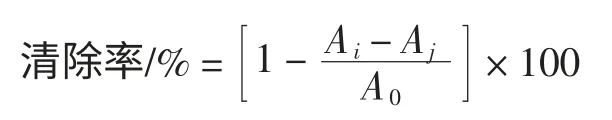
式中:Ai、Aj、A0分别代表样品组、样品空白组及对照组的吸光度。
2.2.2 DPPH·自由基清除能力测定
分别取不同浓度样品2 mL 于试管中,加入2 mL 2×10-4moL/L 的DPPH 的无水乙醇溶液,混合均匀,暗处反应30 min 后于517 nm 处测定Ai,以无水乙醇代替2×10-4moL/L DPPH 测得Aj,以蒸馏水代替样品溶液测得A0,重复3 次,按下式计算DPPH·自由基清除百分率。
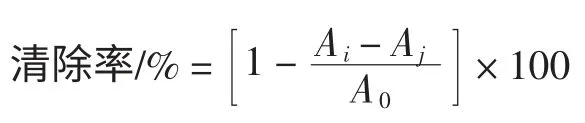
式中:Ai、Aj、A0分别代表样品组、样品空白组及对照组的吸光度。
2.2.3 ABTS+自由基清除能力测定
取ABTS 10 mg,K2S2O82.9 mg 溶于10 mL 0.01 moL/L磷酸钠缓冲液中,25 ℃避光储存16 h~18 h,备用。实验当日取ABTS 液2 mL 加18 mL 0.01 moL/L 磷酸钠缓冲液,调节吸光度在734 nm 处为0.7。分别取0.2 mL不同浓度样品于试管中加3.8 mL 上述ABTS 分析液,6 min 后734 nm 测得Ai,以蒸馏水代替ABTS 分析液测得Aj,以蒸馏水代替样品溶液测得A0,重复3 次,按下式计算ABTS+自由基清除百分率。
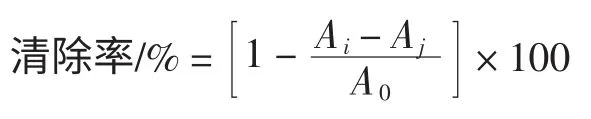
式中:Ai、Aj、A0分别代表样品组、样品空白组及对照组的吸光度。
3 结果与讨论
3.1 提取物得率
热水、乙醇和丙酮提取物得率分别为:(4.15±0.49)%、(7.35±0.58)%和(5.33±0.61)%。
3.2 体外抗氧化活性测定
3.2.1 对·OH 自由基的清除作用
H2O2与Fe2+混合产生·OH,在反应体系中加入水杨酸,能有效捕捉·OH,从而生成2,3-二羟基苯甲酸,该产物在510 nm 处有强吸收,若有抗氧化物质加入,便会与水杨酸竞争,从而使有色产物的生成量减少。因此在510 nm 处比色,可以评价受试物清除·OH 的能力。猴头菇不同溶剂提取物对·OH 自由基的清除作用见图1。
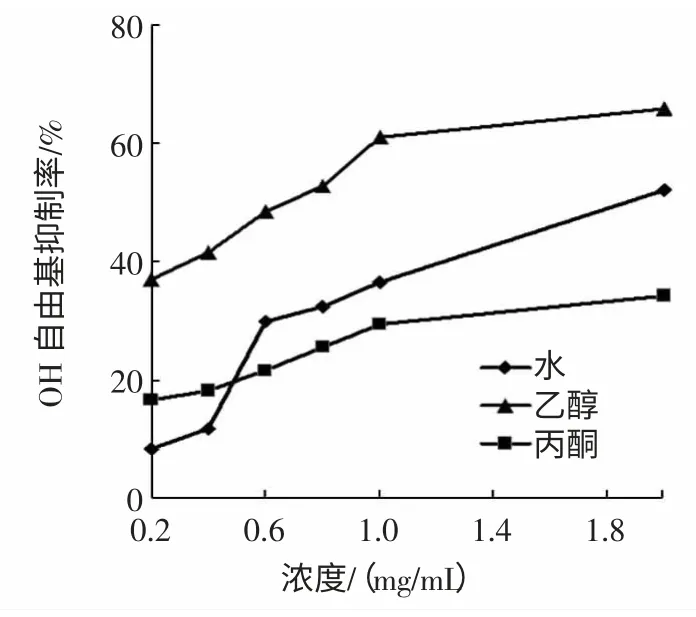
图1 ·OH 自由基的清除作用Fig.1 ·OH radical scavenging capacity of VCand the different solvents extraction
由图1 可见3 种溶剂提取物对·OH 自由基都有一定的清除作用,并表现出一定的量效关系,各浓度下,乙醇提取物对·OH 自由基的清除作用均显著高于热水及丙酮提取物(P<0.01),在2.0 mg/mL 时,热水、乙醇及丙酮提取物对·OH 自由基的清除率分别为(51.53±1.83)%、(65.64±1.97)%和(37.28±2.12)%。
3.2.2 对DPPH·自由基的清除作用
DPPH 是一种稳定的自由基,在有机溶剂中呈紫色,在517 nm 波长处有较大吸收,当加入抗氧化剂时,一部分自由基被清除掉,使该波长下吸收强度减弱,可借此来评价某物质的抗氧化活性。猴头菇不同溶剂提取物对DPPH·自由基的清除作用见图2。
结果可知3 种溶剂提取物对DPPH·自由基都有一定的清除作用,且随着浓度的增大清除能力增强。乙醇提取物和丙酮提取物对DPPH·自由基的清除作用无显著性差异(P>0.05),在0.2 mg/mL~1.0 mg/mL 浓度范围内,热水提取物对DPPH·自由基清除作用显著优于乙醇及丙酮提取物(P<0.01),在2.0 mg/mL 时热水、乙醇及丙酮提取物对DPPH·自由基的清除力无差异(P>0.05),清除率分别为(60.2 ±2.07)%,(62.15±2.23)%和(59.16±1.74)%。
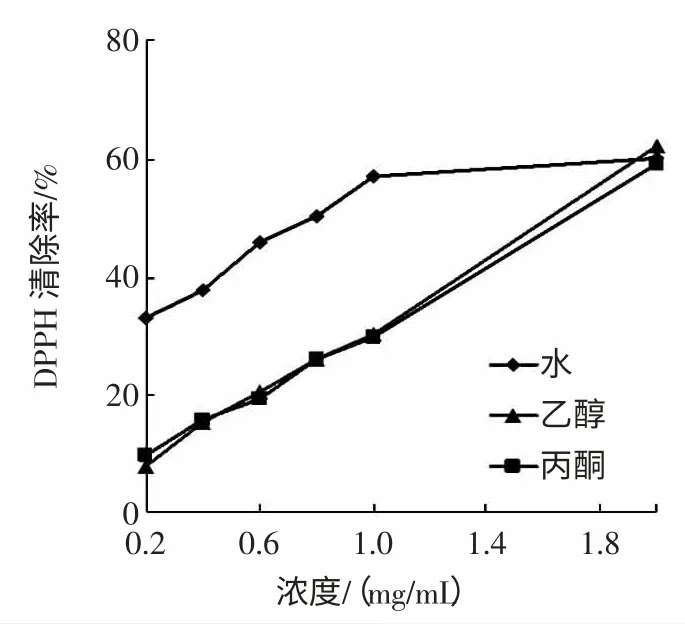
图2 DPPH·自由基的清除作用Fig.2 DPPH·radical scavenging capacity of VCand the different solvents extraction
3.2.3 对ABTS+自由基的清除作用
ABTS 作为一种间接检测方法,使用范围最广泛,ABTS 经氧化后生成稳定的蓝绿色阳离子自由基ABTS+,能溶于水相或酸性乙醇介质中,在734 nm 处有最大吸收,可用于亲水性和亲脂性物质抗氧化能力测定。被测物质加入ABTS+溶液后,所含抗氧化成分能与ABTS+发生反应而使反应体系褪色。在ABTS+的最大吸收波长734 nm 处检测吸光度的变化,可用于测定样品对ABTS+自由基的清除能力。猴头菇不同溶剂提取物对ABTS+自由基的清除作用见图3。
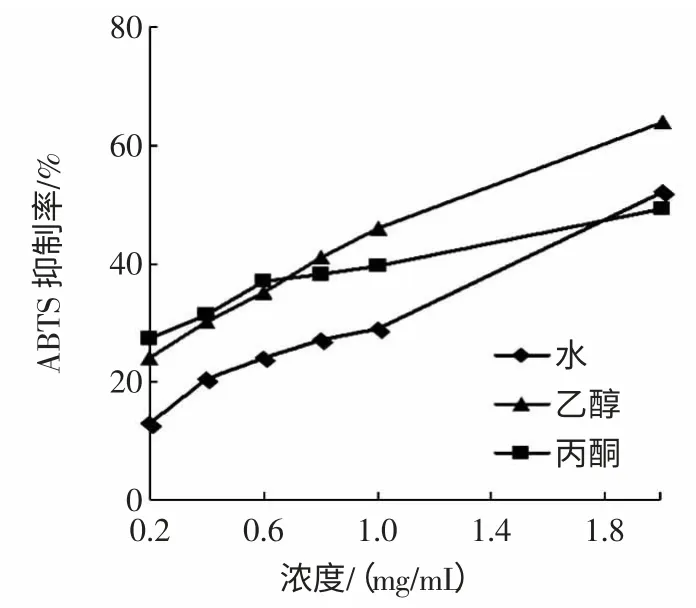
图3 ABTS+自由基的清除作用Fig.3 ABTS+radical scavenging capacity of VCand the different solvents extraction
结果可知3 种溶剂提取物对ABTS+自由基都有一定的清除作用,且随着浓度的增大清除能力增强。在各浓度下乙醇提取物显对ABTS+自由基清除作用著优于丙酮提取物(P<0.01),在0.2 mg/mL~1.0 mg/mL 浓度范围内,乙醇提取物与热水提取物无显著性差异(P>0.05),当浓度为2.0 mg/mL 时,乙醇提取物对ABTS+自由基的清除能力显著优于热水提取物(P<0.01)。热水、乙醇及丙酮提取物对ABTS+自由基的清除率分别为(52.06±2.31)%、(63.84±1.72)%,(49.59±2.16)%,结果表明乙醇提取物对ABTS+自由基清除作用最好。
4 结论
本研究比较猴头菇的热水、乙醇及丙酮提取物的体外抗氧化能力,以·OH 自由基、DPPH·自由基和ABTS+自由基的清除率为指标,筛选合适的提取溶剂,制备出具有较好抗氧化活性的提取物。研究结果表明以乙醇作为提取溶剂,制备提取物对·OH 自由基、DPPH·自由基及ABTS+自由基均表现出良好的清除能力,仅在0.2 mg/mL~1.0 mg/mL 的较低浓度下,水提物对DPPH·自由基的清除优于乙醇提取物,但是在较高浓度2 mg/mL 浓度下,醇提物对DPPH·自由基的清除率略高于水提物。
以体外药理活性为导向,比较猴头菇不同的提取溶剂的抗氧化效果,结果发现乙醇为最佳溶剂,本研究为猴头菇保健品开发提供思路和参考。
[1]Su X Y,Wang Z Y,Liu J R.In vitro and in vivo antioxidant activity of Pinuskoraiensis seed extract containing phenolic compounds[J].Food chemistry,2009,117(4):681-686
[2]杜志强,杨晨晨,王建英.猴头菇多糖对小鼠血清抗氧化能力的影响[J].食品研究与开发,2011,32(9):57-59
[3]Knight J A.Diseases related to oxygen-derived free radicals[J].Annals of clinical and laboratory seience,1995,25(2):111-121
[4]Yun Z F,Sheng Y,Guoyao W.Free radicals,antioxidants,and nutrition[J].Nutrition,2002,18(10):872-879
[5]方玉梅,张春生,谭萍,等.金针菇黄酮类化合物的抗氧化性作用[J].食品研究与开发,2012,33(3):15-18
