魔芋葡甘寡聚糖硫酸酯的纯化与结构表征
2013-07-22黄皓杨忠华王光辉陈俊秦晓蓉
黄皓,杨忠华,王光辉,陈俊,秦晓蓉
(武汉科技大学化学工程与技术学院,湖北武汉 430081)
魔芋是食药两用的多年生草本植物,属天南星科魔芋属。魔芋葡甘聚糖(KGM)在魔芋块茎中含量高达55%~80%,KGM 单体的分子中C2、C3、C6均具有较强的反应活性,表现出优良的生物亲和性,易制成各种化学衍生物[1]。
由于多糖硫酸酯具有显著的抗病毒活性,且其活性与相对分子质量大小、硫酸基含量和取代位置及构象密切相关[2]。为更好地拓展魔芋作为功能食品的应用范围,研究其体外抗病毒活性的可能性,为糖类生化药物开发奠定基础,本文报道了经改良的氯磺酸-甲酰胺法制备的聚阴离子产物魔芋葡甘寡聚糖硫酸酯[3](Hydroxylpropyl Oligo-konjac Glucomannannuroate Sulfate,HOGS)的分离纯化及结构表征研究。
1 材料与方法
1.1 材料与试剂
寡聚KGM 醛酸丙酯(HOG)、寡聚KGM 醛酸丙酯硫酸酯(HOGS):武汉科技大学化工学院生物工程实验室自制;D-甘露糖、D-葡萄糖(分析纯)、葡聚糖凝胶Sephadex G.25、醋酸纤维素薄膜:美国Sigma 公司;甲苯胺蓝(分析纯):武汉顺天生物技术有限公司;葡聚糖:瑞典Pharmacia 公司。
1.2 仪器设备
傅里叶变换红外光谱仪(Nexus 型):美国Thermo Nicolet 公司;超导核磁共振波谱仪(AS 600 型):美国Varian 公司;凝胶渗透色谱仪(Waters 510 型):美国Waters 公司。
1.3 方法
1.3.1 离子交换层析分离HOGS
由于HOGS 带负电荷,采用离子交换法将其与HOG 分离。取适量干燥的717 阴离子树脂经NaCl 溶液预处理后使用。200 mg 合成的HOGS 粗品溶于10 mL蒸馏水,沿管壁加入。流出液接自动收集器,流出液中加2 滴α-萘酚试剂,沿试管壁加1 mL 浓硫酸,有糖则在液面间形成紫色复合物。去离子水展开直至流出液中无糖为止。
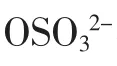
1.3.2 葡聚糖凝胶层析纯化HOGS
利用分子筛效应[4],根据相对分子质量的差异对HOGS 进一步纯化。Sephadex G.25 凝胶柱用0.2 mol/L NaCl 溶液平衡、流速为5 mL/h~6 mL/h,上样(10 mg 样品溶于1 mL 蒸馏水),保持流速,用0.04 mol/L 吡啶:0.02 mol/L 醋酸(1 ∶1)缓冲液洗脱,BSZ.160 自动部分收集器收集洗脱分离样品,转速4.0 r/min,按3 mL 体积分步收集,作洗脱曲线。
1.3.3 醋酸纤维素薄膜电泳鉴定HOGS 纯度
取醋酸纤维素薄膜(2×8 cm)放在pH 12.5 的0.025 mol/L 硼酸盐缓冲液中浸泡15 min~20 min,取膜条,夹在两层滤纸内吸去多余的缓冲液。另切1 mm~5 mm 薄膜浸渍样品溶液约1 μL(10 μg),紧贴离膜条一端2 cm 处,使膜条点上细条状的多糖样品。按常规电泳方法,经过电泳、染色、漂洗至无糖区染色剂的底色完全脱去为止。
1.3.4 凝胶渗透色谱(GPC)测定HOGS 相对分子质量
凝胶渗透色谱法测定HOGS 的重均相对分子质量(Mw)、数均相对分子质量(Mn)和多分散系数(Mw/Mn)。采用TSKG-3000SW 凝胶过滤柱(300 mm×7.5 mm),在Waters 510 型HPLC 仪上进行分离,检测器为410 型示差检测器,并以葡聚糖为标准品进行测定[5]。色谱条件为:柱温,210 ℃(自动柱温控制系统);柱压,5MPa(600 型恒压泵);进样器50μL;进样量20μL;流动相:HAc-NaAc 缓冲液(pH5);流速,1.0 mL/min;洗脱时间,60 min。数据处理采用Astra 软件。
1.3.5 傅里叶红外光谱(FT-IR)分析
取冻干后的HOG 和HOGS 辗细,采用Nexus 傅里叶红外光谱仪进行红外光谱测定,选用欧米采样器直接测定。波数范围:4 000 cm-1至400 cm-1;分辨率:0.09 cm-1;扫描次数:32/64[6]。
1.3.6 氢核磁共振波谱(1H-NMR)分析
取冻干后的HOG 和HOGS 各0.5 mg 分别溶于1 mL D2O,以D2O 为内标,定为4.8 ppm,在599.78 MHz 的磁场中,谱线宽度为6 631.8 Hz,操作温度为298 K,HOD信号在前3S 预饱和进行抑制,记录质子去偶的1HNMR[7]。
2 结果与分析
2.1 HOGS 与HOG 的分离
离子交换层析的样品洗脱液用硫酸-蒽酮法检测糖含量,离子交换洗脱曲线见图1。

图1 HOGS 离子交换层析洗脱曲线Fig.1 Ion exchange chromatography analysis of HOGS
由图1 可以看出,在较低浓度0.4 mol/L NaCl 溶液的洗脱下,0~15 管收集液的糖含量为零,未有糖峰出现,表明HOGS 完全被阴离子树脂吸附,可见本试验中HOG 样品经硫酸化后引入了负电荷的硫酸基团。在0.4、0.8 mol/L 和1.6 mol/L NaCl 的梯度洗脱下,随着NaCl 浓度的增加,HOGS 与阴离子树脂的吸附被Cl-竞争取代,与树脂分离,被洗脱下来,在24 管时糖含量达到最大,洗脱曲线出现的糖峰为单一峰,表明HOGS 组分均一。
2.2 HOGS 葡聚糖凝胶层析纯化结果
经乙醇沉淀、离子交换、透析、冷冻干燥后的HOGS 溶于水,用Sephadex G-25 凝胶层析柱进一步纯化,以收集管号为横坐标,糖浓度为纵坐标,作凝胶层析洗脱曲线如图2。
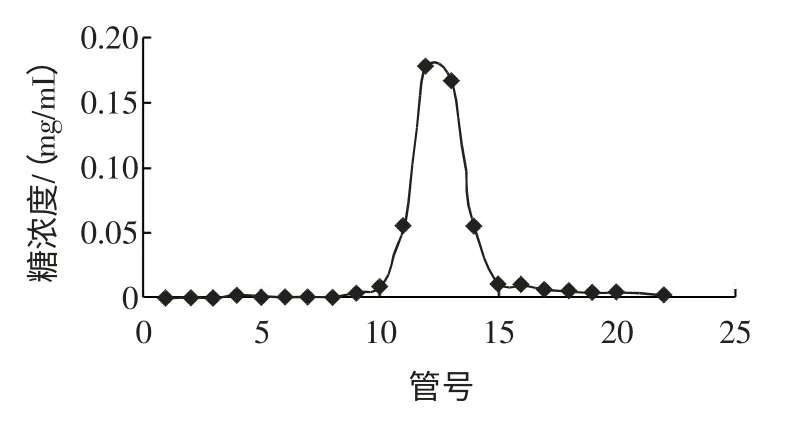
图2 HOGS 凝胶过滤Sephadex G-25 柱层析图Fig.2 Sephadex G-25 gel filtration analysis of HOGS
由图2 可知,在洗脱的初始阶段,1~10 管收集液基本上没有HOGS 成分,糖含量极少。随着洗脱的继续进行,从11 管开始,吸光度逐渐增加,表明糖含量逐渐增加,在12~13 管时达到最大,此后又逐渐下降。
多糖分子的大小和形状不同,在层析柱中的移动速度也不同,从分部收集中出现的峰的多少和形状,判断该多糖的纯度,因此,根据洗脱曲线出现的糖峰为单一对称峰,可以判断HOGS 为分子大小和形状均一的组分。
2.3 醋酸纤维素薄膜电泳鉴定纯度结果

图3 醋酸纤维素薄膜电泳图Fig.3 The acetyl cellulose thin film electrophoresis
采用以pH12.5 的硼酸盐缓冲液为电泳介质,在250 V 电压下电泳20 min。电泳的结果如图3,可以看出醋酸纤维素薄膜上面显示单一蓝色的条带,表明所得的糖的组分比较均一。
2.4 HOGS 相对分子质量分布
HOGS 相对分子质量采用凝胶色谱法测定,如图4 所示。
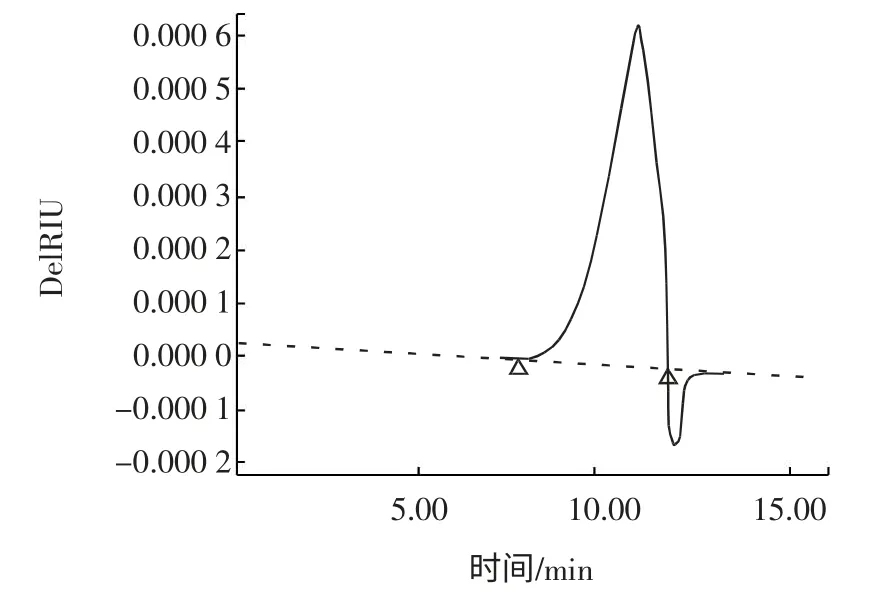
图4 HOGS 凝胶渗透色谱图Fig.4 GPC spectra of HOGS
结果表明,示差检测器得到的凝胶渗透色谱图呈正态分布,多分散系数Mw/Mn=1.01,HOGS 的相对分子质量峰值Mp 为1 608 D,重均相对分子质量Mw 为1 595 D,数均相对分子质量Mn 为1 572 D。相对分子质量分布宽度指数σn 计算公式:σ2n=Mn(2Mw/Mn-1)=3.62×104。
HOGS 纯品为相对分子质量分布窄的硫酸多糖。
2.5 HOGS 硫酸基团表征
KGM、HOG、HOGS 红外光谱分析如图5 所示。
图5 KGM(a)、HOG(b)和HOGS(c)红外光谱图Fig.5 FT-IR spectra of KGM(a)、HOG(b)and HOGS(c)

2.6 HOGS 引入硫酸基团位置表征
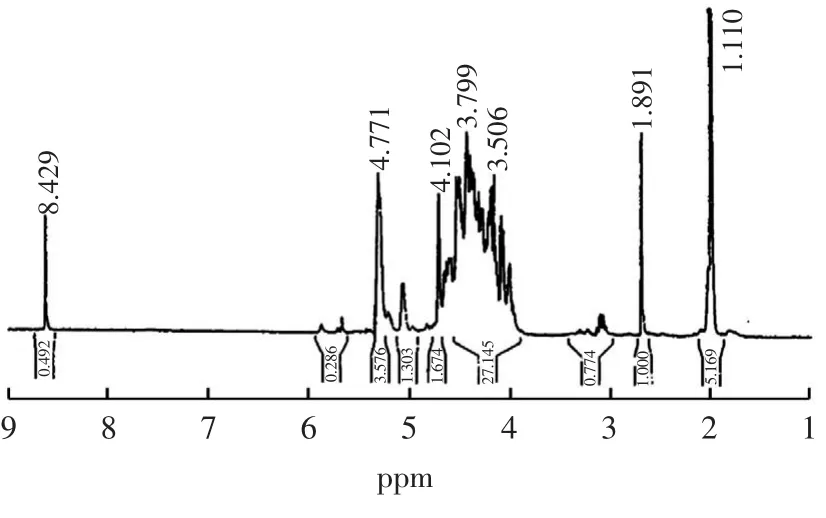
图6 HOG 的1H-NMR 谱图Fig.6 1H-NMR spectra of HOG
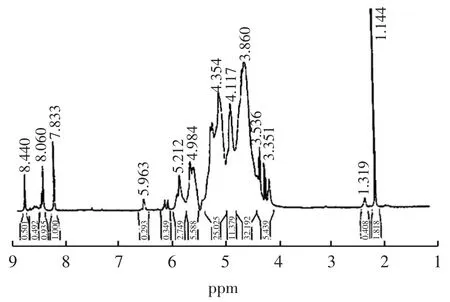
图7 HOGS 的1H-NMR 谱图Fig.7 1H-NMR spectra of HOGS
引入硫酸基团的碳,化学位移将移向低场约8 ppm,由谱图6 和谱图7 对比可以看出,糖环质子堆积的区域峰型发生了变化,部分质子信号移向低场,说明强电负性的硫酸基团的引入,对糖环质子信号产生影响,导致吸电子诱导效应的增加,相应的质子化学位移值越大,表明在糖环的C2和C3位的羟基上接有硫酸基团。同时,δ=1.10 ppm 处质子吸收峰的积分面积与糖环上质子信号堆积区域吸收峰面积之比在硫酸化前后发生显著变化,硫酸酯化前约为1 ∶9,硫酸化后约为1 ∶35,表明C6位连接的羟丙基的甲基氢的信号明显减弱,说明甲基氢的化学位移发生改变,可能受酯化反应的影响,在C6位连接的羟丙基上的羟基也发生了硫酸酯化反应,接有硫酸基团。
3 讨论
多糖混合物纯化的方法很多,有盐析法、金属络合法、亲和色谱法、高效毛细管电泳法、制备性区域电泳法等。低聚糖的纯度标准不能用普通的小分子化合物的纯度标准来衡量,因为即使是纯品的低聚糖也存在微观不均一的问题,其纯度只代表某一类糖相似链长的均一组分。HOGS 的纯度直接影响其作为功能食品的抗病毒活性,在后续的研究中,HOGS 的纯度与收率是纯化工艺的关键。
结构表征结果表明,HOGS 为相对分子质量分布很窄的低相对分子质量硫酸多糖,其易为机体吸收的特点能够更好地发挥抗病毒活性。FT-IR 显示分子已连上硫酸基。核磁共振波谱分析表明,硫酸基团的连接位置可能在葡萄糖和甘露糖C2、C3和C6位上,符合硫酸多糖抗病毒活性与硫酸基团连接位置的构效关系规律。
鉴于硫酸聚阴离子含量即硫酸基取代度也是抗病毒活性的关键因素;同时,组成多糖的单糖连接形式对多糖的构象也会产生影响,从而引起抗病毒活性的改变。因此,后续结构表征可运用X-射线衍射光电子能谱对HOGS 进行表面S 元素定量分析,并结合高碘酸氧化法分析HOGS 的单糖连接形式,从而进一步阐明HOGS 抗病毒的构效关系。
[1]Xiao C B,Weng L H,Zhang L N.Improvements of physical properties of cross linked alginate and carboxymethyl konjac glumannan blend films[J].Journal of Applied Polymer Science,2002,84(13):2554-2560
[2]Hirohashi N,Vilela S A C.Structural requirements for species specific induction of the sperm acrosome reaction by sea urchin egg sulfated fucan[J].Biochemical and Biophysical Research Communications,2002,298(3):403-407
[3]熊郃,干信.β-甘露聚糖酶产生菌R10 的产酶特性研究.工业微生物,2004(3):42-45
[4]Case S E,Hamann D D.Fracture properties of konjac mannan gel:effect of gel[J].Food hydrocoll,2000,8(2):147-154
[5]Lehrfeld J.Simultaneous gas-liquid chromatographic determination of aldoses and alduronic acids[J].J Chromatography,2004,408:245
[6]Joung Han Yim,Sung Jin Kim,Se Hoon Ahn,et al.Optimal conditions for the production of sulfated polysaccharide by marine microalga Gyrodinium impudicum strain KG03[J].Bimolecular Engineering,2003,20:273-280
[7]Katsuraya K,Okuyama K,Hatanaka K,et al.Constitution of konjac glucomannan:chemical analysis and 13C NMR spectroscopy[J].Carbohydrate Polymers,2003,53:183-189
