胃肠道间质瘤治疗新方法的探讨
2013-07-19盛剑秋赵晓军王海红李爱琴余东亮
郭 花,盛剑秋,金 鹏,李 娜,赵晓军,王海红,王 昕,李爱琴,余东亮,谢 惠
北京军区总医院消化内科,北京 100700
既往胃肠道间质瘤(gastrointestinal stromal tumor,GIST)的传统治疗方式是手术切除,而目前以创伤小、痛苦小的微创治疗为主。随着内镜技术的不断发展,ESE、STER可切除位于黏膜肌层或固有肌层的GIST,但对于瘤体较大、起源于固有肌层深层时,发生出血和穿孔的风险增加。而单独腹腔镜治疗却存在不易寻找病变、定位困难等缺点,因此将胃镜与腹腔镜双镜联合实现了两者的优势互补,是目前治疗GIST 有效、微创的新方法。本文回顾性分析我院联合应用经胃(肠)镜检查发现消化道黏膜下肿物,经超声内镜及病理学、免疫组化证实为GIST患者86例,探讨采用ESE、胃镜与腹腔镜双镜联合或STER 治疗的效果及安全性。现报道如下。
1 资料与方法
1.1 一般资料 我院2011年4月-2013年4月胃(肠)镜检查发现消化道黏膜下肿物,经超声内镜及病理学、免疫组化证实为GIST患者86例,男39例,女47例,年龄31~79岁,平均年龄(58.6±8.7)岁。
1.2 EUS 检查 胃(肠)镜检查发现消化道黏膜下隆起性病变,同时行EUS 检查,使用电子线阵式超声内镜(Olympus GF-UE260)或微型超声探头(Olympus EndoEcho EU-M2000),确定病变大小、起源、回声、与周围脏器的关系等。
1.3 治疗方法
1.3.1 ESE:适用于瘤体小于3 cm、起源于黏膜肌层或固有肌层的瘤体,首先标记切除范围,黏膜下注射甘油果糖-美兰使病变抬起,用IT 刀或Dual 刀逐步剥离、挖除病灶,最后钛夹闭合创面。
1.3.2 胃镜与腹腔镜双镜联合切除:适用于瘤体大于3 cm、位于固有肌层深层、向腔外生长为主、估计内镜下难以完整切除时。手术方法分为两种:①腹腔镜辅助胃镜手术:内镜下逐层剥离病灶,若剥离瘤体时出现胃壁穿孔或出血,立即行腹腔镜下胃壁修补、缝合或止血治疗;②内镜辅助腹腔镜手术:通过胃镜下“顶”、“推”等方法对肿物进行精确定位,同时腹腔镜下监视胃镜定位效果,腹腔镜切除瘤体、缝合切口。
1.3.3 STER:适用于位于固有肌层的瘤体。在肿物近端约3~5 cm 用Dual 刀作一横行切口,用IT 刀、三角刀或钩刀建立黏膜下隧道,在隧道内逐步剥离肿物与周边组织后,完整切除瘤体,最后钛夹封闭隧道开口。
1.4 病理学检查 所有组织在我院病理科行苏木精-伊红(hematoxylin-eosin,HE)染色,并使用免疫组化法测定CD34、CD117、DOG-1、SMA、S-100、Desmin和Ki-67。
1.5 随访及术后辅助治疗 依据美国国立卫生研究所(NIH)对原发GIST 切除后的风险分级(2008版),对所有内镜下完整切除瘤体进行风险分级评估。对于中、高危GIST患者每3个月进行一次随访,对于低危患者每6个月进行一次随访,随访内容包括复查胃镜、腹腔、盆腔增强CT、胸部X 线片等[1]。
1.6 统计学方法 采用SPSS 13.0 进行统计学分析,所有资料采用计量资料或计数资料表示,计量资料间比较采用t 检验,计数资料采用χ2分析。
2 结果
2.1 瘤体大小及分布 GIST 在内镜下表现为球形或半球形隆起,大多数瘤体表面可光滑,部分瘤体顶端出现充血、糜烂、凹陷、溃疡或出血,瘤体直径约0.3~6 cm,平均直径(2.2±1.8)cm,其中87.2%(75/86)的GIST 位于胃内(胃底54例、胃体18例、胃窦3例),消化道其他部位也可见(见图1)。
2.2 超声内镜结果 超声内镜显示病变起源于固有肌层(64/86)或黏膜肌层(22/86),大多数病例呈低-中密度回声(79/86),部分瘤体(25/86)内部还可出现高密度回声,内部回声均匀或不均匀。
2.3 超声内镜对GIST 诊断的符合情况 将我研究中心经免疫组化确诊的260例黏膜下肿物的超声内镜结果与GIST的免疫组化金标准比较,发现超声内镜对GIST 诊断的灵敏度为93%,特异度为94%,阳性预测值为82%,阴性预测值为98%(见表1)。
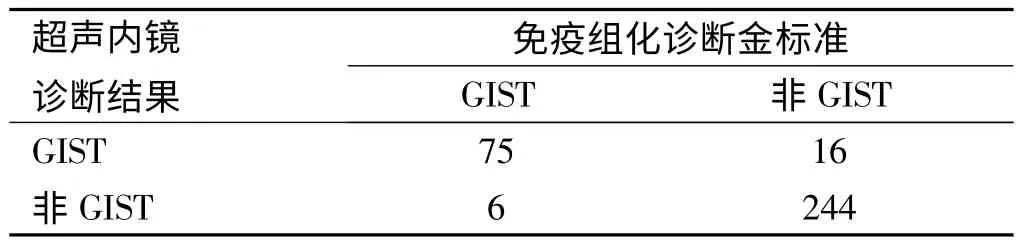
表1 超声内镜对GIST 诊断的符合情况Tab 1 The accordance of endoscopic ultrasound in GIST diagnosis
2.4 治疗结果 86例患者中53例采用ESE 法、29例采用胃镜与腹腔镜双镜联合、4例采用STER 法切除瘤体。所有患者均完整切除瘤体(见图2、图3),无术中及术后迟发性出血、剧烈腹痛发生。
2.5 病理及免疫组化结果 病理学显示为梭形细胞肿瘤或上皮样细胞,CD34 阳性率为96%,CD117 阳性率为97.3%,DOG-1 阳性率为90.7%,部分组织散在表达SMA及Desmin(9.3%),不表达S-100。术后对所有内镜下完整切除瘤体进行风险分级评估,极低危56例,低危17例,中危8例,高危5例(见图4~5)。其中3例高危患者的最大瘤体直径均小于1 cm。
2.6 术后风险分级及随访 术后对患者进行电话及门诊随访,随访2~25个月,患者术后无烧心、嗳气等症状,有1例中危GIST患者因术后未按医嘱要求服用格列卫而发生盆腔转移,其他患者无复发及远处转移。
3 讨论
过去认为外科手术切除是治疗GIST的首选方法,但外科手术创伤较大,患者恢复时间长,远期出现反流性食管炎,患者生活质量降低。随着微创时代的到来,腹腔镜及内镜下治疗具有创伤小、恢复快等优势,在临床中得到广泛应用。由于GIST的主要转移途径是血行转移,较少发生淋巴结转移,因此其治疗目标为完整切除瘤体,术中无需淋巴结清扫,这一特性使内镜或腹腔镜手术的优势得以发挥。
Mochizuki等[2]认为腹腔镜适合切除直径<5 cm的胃GIST,但Nguyen等[3]研究报道在腹腔镜下成功完整切除直径11.5 cm的胃GIST。本研究中采用胃镜腹腔镜双镜联合的方式,对6例直径大于5 cm的胃GIST 进行了成功切除,术后患者一般情况及创面愈合良好。

图2 胃镜与腹腔镜双镜联合切除胃GIST A:胃底间质瘤;B:超声内镜图;C:内镜下剥离瘤体;D:剥离后发生胃壁穿孔;E:内镜下钛夹缝合创面;F:治疗后复查胃镜见腹腔镜缝合线图3 胃镜与腹腔镜双镜联合切除胃底近贲门间质瘤 A:胃底近贲门间质瘤;B:超声内镜图;C:内镜下剥离瘤体;D:腹腔镜下缝合切除后的胃壁穿孔;E:切除肿物;F:治疗后复查胃镜见贲门结构保持完好Fig 2 Laparoscopy combined with gastroscopy removal GIST A:gastric GIST;B:endoscopic ultrasound chart;C:endoscopic dissection the tumor;D:gastric perforation after dissection;E:the wound was sutured by endoscopic titanium clip;F:laparoscopic suture was seen after treatment in gastroscopyFig 3 Laparoscopy combined with gastroscopy removal GIST in the gastric bottom near cardia A:GIST in gastric bottom near cardia;B:endoscopic ultrasound chart;C:endoscopic dissection the tumor;D:laparoscopic suturing gastric perforation after dissection;E:resection of tumor;F:gastroscopy cardiac structures remained intact after the treatment
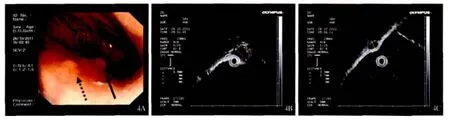
图4 高危GIST A:胃内多源发GIST 病灶,病灶一,病灶二;B:病灶一的超声内镜;C:病灶二的超声内镜Fig 4 High risk GIST A:polygenetic GIST in gastriclesion onelesion two;B:the endoscopic ultrasound manifestations of lesion one;C:the endoscopic ultrasound manifestations of lesion two

图5 高危GIST的内镜下表现 A~C:高危GIST,行胃镜腹腔镜双镜联合切除术;D:高危GIST,经外科手术治疗Fig 5 The endoscopy manifestation of high risk GIST A~C:high risk GIST were removed by laparoscopy combined with gastroscopy;D:high risk GIST were removed by surgery operation
由于较大GIST 瘤体的质地脆,因此在腹腔镜下切除GIST 后尽量使用取物袋,避免取出时GIST 瘤体破裂在腹腔及盆腔造成种植转移[4]。因此我们认为只要术中操作细心得当,直径>5 cm的GIST可以安全、完整的在双镜联合下切除。
对于胃后壁肿物,常规腹腔镜探查是不能直接发现肿物,本研究中有1例胃底后壁GIST 瘤体深大,腹腔镜下分离系膜及韧带过程较长,延长了手术时间,患者术后出现肺部感染、腹腔感染,但后经抗感染治疗痊愈。从此例我们总结到,对于胃底体后壁肿物,若估计分离系膜及韧带过程较长,或分离大网膜及系膜后仍无法翻转暴露病变者,则应在胃镜的定位作用下,切开肿物对应胃前壁,将后壁肿物从胃前壁切口提出后切除,采取这种术式可节省术中操作时间,减少患者术后并发症的发生。
本研究中有10例GIST 位于胃底贲门附近,最近者距贲门仅0.5 cm,部分瘤体直径达6 cm,由于贲门具有重要功能,是防止反流的最重要结构,若行外科手术切除瘤体,则无法保留贲门功能[5],患者还会出现严重并发症,如重度反流性食管炎甚至食管狭窄等,本研究采用胃镜与腹腔镜双镜联合技术不仅可完整切除瘤体,而且避免过多组织切除,使患者贲门功能保存良好,最大程度地减少了术后并发症,术后随访患者无反流、烧心等症状,无复发及转移。
本研究成功运用STER 法对4例GIST 进行切除,术中无穿孔、出血发生,术后患者进食良好。由于STER 法切除瘤体的部位黏膜层是完整的,可避免穿孔和继发感染的发生,即可完整切除肿物,又能保持消化道的完整性,使得切除固有肌层的GIST 更加安全。但仍需要注意观察肿物切除后患者有无皮下气肿发生,若条件许可,操作时采用比空气吸收、弥散快的二氧化碳气体可以减轻患者术后腹胀等不适。
本研究对5例高危GIST 进行了内镜下切除,另有9例高危GIST 内镜下表现为表面不光整,出现溃疡、出血等,经活检证实为GIST 后未实施内镜下切除,而采用分子靶向治疗或外科手术治疗。结合分析这14例高危GIST,我们发现有10例高危GIST 瘤体顶端凹陷,伴有溃疡形成,还有2例伴有明显出血,另4例高危GIST 瘤体表面光滑,无顶端凹陷或溃疡形成。我们的研究还发现14例高危GIST中一半瘤体直径在4 cm 以上(7例),另一半瘤体直径小于4 cm(7例),其中还有3例高危GIST的直径在1 cm 以下,这提示虽然高危GIST 多见于瘤体直径大于4 cm 者,但是对于直径较小的瘤体也不能排除高危GIST的可能,瘤体大小与其危险等级评估可能并不成正比,应结合核分裂像、原发部位、是否发生瘤体破裂等指标进行综合判断。
本研究中仅发现1例GIST(中危)患者因术后未按医嘱口服分子靶向药物而发生盆腔转移,遂后该患者行开腹手术切除盆腔转移灶,手术后按时口服格列卫分子靶向治疗,目前随访无再次复发及转移。这表明对于中高危GIST,即使完整切除瘤体,仍需靶向药物辅助治疗防止转移与复发,推荐中危患者服药1年,高位患者服药3年[6]。大多数GIST 均为单发病灶,但我们在研究中还发现1例GIST 在胃内呈多源性生长,这两处病灶相距2 cm,最大直径分别为0.7 cm和0.6 cm,超声内镜显示病灶为中低回声,密度欠均匀,其中一处病灶完整切除后病理提示为高危GIST,术后给予患者口服格列卫分子靶向治疗[7],目前随访情况稳定。目前,关于多源性GIST的相关性问题,国内外报道少见,尚有待进一步研究。
综上所述,胃镜与腹腔镜双镜联合、ESE及STER是治疗GIST的微创、安全、科学、有效的新方法,具有准确定位、创伤小、并发症少、对器官功能影响小等优点[8],双镜联合技术能很好地弥补腹腔镜和内镜治疗的局限性,增加治疗的安全性,对GIST的治疗具有广阔的应用前景。
[1]CSCO Gastrointestinal stromal tumor Expert Committee.Gastrointestinal stromal tumor diagnosis and treatment of Chinese expert consensus(The 2011 Edition)[J].Chinese Clinical Oncology,2011,16 (9):836-844.CSCO 胃肠道间质瘤专家委员会.胃肠道间质瘤诊断与治疗中国专家共识(2011年版)[J].临床肿瘤学杂志,2011,16(9):836-844.
[2]Mochizuki Y,Kodera Y,Fujiwara M,et al.Laparoscopic wedge resection for gastrointestinal stromal tumors of the stomach:initial experience[J].Surg Today,2006,36(4):341-347
[3]Nguyen SQ,Divino CM,Wang JL,et al.Laparoscopic management of gastrointestinal stromal tumors[J].Surg Endosc,2006,20(5):713-716.
[4]Hohenberger P,Ronellenfitsch U,Oladeji O,et al.Pattern of recurrence in patients with reptured primary gastrointestinal stromal tumour[J].Br J Surg,2010,97(12):1854-1859
[5]Frankel TL,Wong SL.Surgical management of gastriintestianl stromal tumours[J].Curr Probl Cancer,2011,35(5):271-282.
[6]Eisenberg BL.The SSG XVIII/AIO trial:results change the current adjuvant treatment recommendations for gastrointestinal stromal tumors[J].Am J Clin Oncol,2013,36(1):89-90.
[7]Roggin KK,Posner MC.Modern treatment of gastric gastrointestinal stromal tumors[J].World J Gastroenterol,2012,18(46):6720-6728.
[8]De Vogelaere K,Van Loo I,Peters O,et al.Laparoscopic resection of gastric gastrointestinal stromal tumors (GIST)is safe and effective,irrespective of tumor size[J].Surg Endosc,2012,26(8):2339-2345.
