抗Sclerostin 单链抗体基因的构建、表达及活性分析
2013-07-17张立才刘长振郁卫东张里程
姚 琦,张立才,倪 杰,侯 宇,刘长振,郁卫东,张里程
骨质疏松症理想的治疗方法是促进成骨[1]。骨硬化蛋白(sclerostin,SOST)[2]是SOST 基因的产物,而且由骨细胞特异性表达。最新研究表明,骨硬化蛋白单克隆抗体具有增加骨量和骨密度,促进正常板层骨结构形成及增加骨强度作用[3-8]。目前,一种人源化的骨硬化蛋白单克隆抗体(AMG785)已经开始了临床随机对照试验,并被证实能有效增加绝经后妇女骨密度[9,10]。然而骨硬化蛋白单克隆抗体存在分子质量过大、免疫原性强等缺点。单链抗体(single chain Fv,scFv)是在单克隆抗体基础上发展起来的一种新型抗体,具有分子量小、渗透性高、抗原结合活性高的优点。scFv 由免疫球蛋白重链可变区(VH)及轻链可变区(VL)通过一段连接肽连接而成的单一肽链重组蛋白,是具有完全抗原结合位点的最小抗体片断,临床应用前景非常广阔[11,12]。本研究在获得抗SOST 单克隆抗体基础上,对VH 和VL 基因采用RT-PCR 技术进行扩增,并组装单链抗体基因SOST-scFv,采用NCBIblast技术分析SOST-scFv,同时构建单链抗体原核表达载体SOST-scFv-22b 体系,并对SOST-scFv-22b 表达蛋白活性进行初步研究。
1 材料与方法
1.1 试剂 单克隆抗体基因序列,pET-22b(+)载体,HEK293 细胞由课题组制备并冻存。PrimeStarDNA 聚合酶、限制性内切酶、T4 连接酶,pMD18-T 载体和琼脂糖等试剂均购自takara 公司。质粒提取试剂盒(BIOMIGA),胶回收及纯化试剂盒(康为世纪),Trizo1 和反转录试剂盒为Roche 公司产品,氯仿、异丙醇、无水乙醇均购自国药集团化学试剂有限公司,大鼠骨髓间充质干细胞,维持培养液和诱导分化培养液均购自美国ScienCell 公司。
1.2 方法
1.2.1 总RNA 提取及cDNA 的合成 收集生长状态良好的杂交瘤细胞,采用TRIzo1 试剂破碎细胞后,氯仿抽取、异丙醇沉淀后用75%乙醇洗涤,干燥后用焦碳酸二乙酯处理过的水溶解RNA。以提取的RNA 为模板,按照RT-PCR 试剂盒操作流程要求进行合成cDNA。
1.2.2 设计引物 依据兔单克隆抗体的可变区设计VL 和VH 引物,并采用简并密码子适应轻重链的多样性(S=G,C;M=A,C;R=A,G;W=A,T;Y=C,T);将Linker 设计在VL 下游引物和VH 上游引物,两端设有Not I 和BamHI 酶切点及保护性碱基。轻链可变区上游引物VL-F:5'TTCGGATCC GACSCTATGCTRACCCWGACT 3',5'端画线处引入了BamH I 酶切位点,轻链可变区下游引物VL-R:5'TGGCTACCGGAGCCACTACCTAGGATCTCCAGCTCGGTCC 3'。重链可变区上游引物VH-F:5'TAGTGGCTCCGGTAGCCAGTCGGTGGAGGAGTCCGG 3';重链可变区下游引物VH-R:5'ATAAgAATGCGGCCGC TGAGRAGYCGGTGAMCAG SGTGCC 3',5'端画线处引入了Not I 酶切位点。
1.2.3 V 区基因克隆及SOST-scFv 基因的构建以合成的cDNA 为模板,以VL-F/VL-R,VH-F/VH-R 为引物,分别扩增VL、VH 基因,采用DNA 回收纯化试剂盒回收纯化扩增产物。反应体系为:加入1 L 浓度均为20 mol 的引物,并加入1 L cDNA 模板、12.75 L ddH2O、0. 25 L PrimeStarDNA 酶,总体积20 L。以VL-F 和VH-R 为引物,以纯化回收的VL和VH 基因片段为模板,通过SOE PCR 扩增获得VL–liner-VH 结构基因片段。反应体系:加入2 L 浓度为20 mol 的引物,加入3 L VL 和VH 基因片段、29.5 L ddH2O、0.5 L PrimeStarDNA 聚合酶,总体积50 L。反应条件:经过95 ℃5 min,95 ℃12 s,49 ℃15 s,72 ℃60 s,5 个循环后再进行95 ℃5 min,95 ℃12 s,67 ℃15 s,72 ℃60 s,25 个循环后再72 ℃延伸10 min,PCR 产物经琼脂糖电泳后切胶,采用康为世纪公司凝胶回收试剂盒回收DNA 片段。
1.2.4 SOST-scFv 基因的克隆与鉴定 采用DNA 纯化试剂盒回收纯化SOST-scFv 基因,引入PMD18-T 载体,并转入HEK293 细胞,经TA 连接及PCR 鉴定阳性克隆菌(命名为pMD18-SOST-scFv)送公司测序,测序结果经NCBI blast 分析。
1.2.5 重组载体SOST-scFv 的构建、表达及分析 通过将SOST-scFv 定向克隆到表达载体PET-22b(+)Not I 及BamH I 酶切位点之间,构建重组pET-SOST-scFv 质粒,经鉴定(酶切及PCR)为阳性克隆后,将重组质粒pET-SOST-scFv 转入表达宿主HEK293 细胞中,挑取其中3 个克隆进行PCR鉴定,将鉴定结果正确的克隆进行可溶性蛋白表达。
1.2.6 SOST-scFv 基因诱导表达 将鉴定正确的重组克隆子接种2 YTG 培养液,30 ℃过夜培养,次日按1∶100 接种培养液2YTA,30 ℃培养,待A600 值达1.0 左右时,加入IPTG 使其终浓度为1 mmol/L,30 ℃诱导培养。
1.2.7 SDS-PGAE 评估SOST-scFv 的表达293EBNA 细胞传代用1 L 的摇瓶,工作体积200 ml,在37 ℃,5% CO2摇床中培养。取对数生长期细胞,用新鲜培养液直接稀释到要转染的密度。转染后的细胞在摇瓶中放摇床上培养,根据不同培养体积选择不同大小的摇瓶或反应器。培养过程加料使得细胞高表达,然后培养3 ~6 d 后,收集上清液去纯化,浓缩,SDS-PAGE 检测后,-20 ℃冷冻保存。
1.2.8 ELISA 检测表达产物抗原结合活性 分别采用2 μg/ml、10 μg/ml 重组蛋白SOST 包被ELISA板4 ℃过夜后20 g/L BSA 37 ℃条件下封闭。分别加入上清、破碎上清、破碎沉淀,阴性对照组采用未诱导菌液,37 ℃孵育1 h,以HRP 标记的羊抗小鼠IgG 为二抗,37 ℃孵育1 h,TMB 显色分析。纯化后scFv 经SDS-PAGE 电泳,转移至硝酸纤维素膜上,封闭液4 ℃封闭过夜,PBST 洗涤,一抗加入scFv,二抗采用鼠抗SOST 单克隆抗体,三抗羊抗鼠特异性抗体,最后选用二氨基联苯胺(DAB)底物显色液显色,边摇动边观察,至条带清晰后加入双蒸水终止其反应,观察结果。
1.2.9 成骨分化实验 采用茜素红染色观察培养骨髓间充质细胞成骨分化及矿化结节的形成情况,实验分为实验组维持培养液+ sost 单链抗体(50 ng/ml 培养液),空白组维持培养液,对照组仅为维持培养液+诱导分化液,持续培养并观察14 d,期间每4 ~5 d 更换一次培养液,连续培养14 d,将预置玻片采用95%乙醇固定10 min,然后用0.1%茜素红茜素红-Tris-Hcl(pH 为8.3)染色30 min、PBS冲洗4 次,镜下观察。
2 结果
2.1 杂交瘤细胞总RNA 提取 如图1 所示,从单克隆抗体杂交瘤细胞5H3D1 中提取的总RNA 经电泳检测,可见明显的18S、28S 条带,表明提取的总RNA 良好。
2.2 可变区基因克隆结果 以轻链可变区和重链可变区为引物,并采用RT-PCR 合成的cDNA 为模板进行PCR 扩增,分别扩增出轻链和重链可变区基因VL 和VH,产物经1%琼脂糖凝胶电泳鉴定。如图2 所示VH 基因片段为330 bp 左右,VL 基因片段为340 bp 左右。
2.3 scFv 的构建及鉴定 如图3 所示,纯化回收VL、linker 及VH 基因经SOE-PCR 扩增得到linker连接的scFv 基因(VL– linker-VH )。1%琼脂糖凝胶电泳结果显示,组装片段大小约为700 bp 左右。将构建的scFv 片段插入到PMD-T 载体中,构建重组质粒。克隆经PCR 鉴定,挑选插入条带与预期基因片段大小相符的阳性克隆送测序。
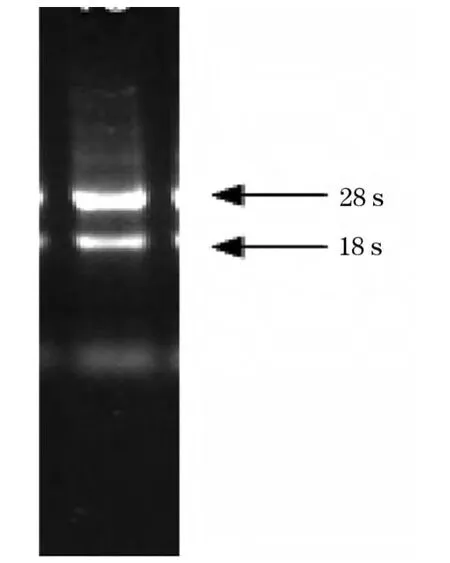
图1 单克隆抗体杂交瘤细胞提取的总RNA

图2 PCR 扩增scFv 基因

图3 抗体纯化后的电泳鉴定
2.4 VH、VL、scFv 基因序列分析 基因序列分析显示:VH 和VL 基因符合小鼠免疫球蛋白可变区基因特征,均包含3 个抗原互补决定区(CDR)、4 个框架区(FR )及具有抗体特征性的2 个半胱氨酸残基。所构建的scFv 全长687 bp,编码229 个氨基酸;VH 基因序列全长330 bp,编码110 个氨基酸;VL 基因序列全长339 bp,编码氨基酸113 个;VL 与VH 基因之间连接结构为linker。VH 基因片段3 端带有Linker 12 个碱基的互补序列,5 端带有BamH I酶切位点;VL 基因片段3 端带有Not I 酶切位点,5 端带有Linker 30 个碱基的重叠序列。两者测序结果通过GenBank IgB last 数据库在线分析显示框架区序列同源性在95%以上,只有抗原互补决定区有个别碱基突变。构建的SOST-scFv 测序结果与轻链、重链序列对比序列完全一致。
2.5 pET-SOST-scFv 表达载体构建 以转化菌提取质粒pMD18-SOST-scFv 为模板,分别对重链可变区下游引物VH-R 和轻链可变区上游引物VL-F进行PCR 扩增,得到产物大小为700 bp 左右的目的带(图4)。PCR 产物经Not I,BamH I 双酶切后插入表达载体PET-22b(+)。挑取PCR 鉴定为阳性的克隆做表达。

图4 SOST-scFv 重组质粒鉴定结果
2.6 表达产物的SDS-PAGE 检测 离心提取包涵体蛋白,经尿素梯度溶解、复性、超滤后通过SDS-PAGE 分析得到相对纯化的sost-scFv 表达蛋白带,蛋白分子量大小35KD,与预计相符(图5)。
2.7 表达产物的ELISA 分析 ELISA 分析显示,表达蛋白sost-scFv 可以和SOST 抗原特异结合(图6)。
2.8 Western-blot 检测结果 Western-blot 检测证实scFv 与sost 蛋白在相对分子质量35 ku 处有一条明显的特异性反应带,与sost 抗原的分子量大小相符,说明获得的scFv 可与sost 抗原发生特异性免疫反应(图7)。
2.9 体外诱导分化检测结果 茜素红染色的方法证实实验组(抗sost 单链抗体)有较多茜素红染色阳性的钙化结节形成,钙化结节呈橘红染色;对照组(诱导分化培养液)钙结节形成数量较实验组少;而空白组未经诱导的骨髓间充质细胞染色结果为阴性,未发现钙化结节(图8)。以上结果显示抗sost能够有效促进骨髓间充质细胞的成骨诱导与矿化。
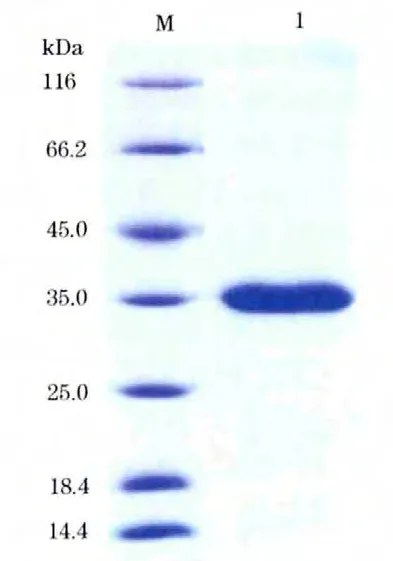
图5 SDS-PAGE 分析纯化后scfv 蛋白
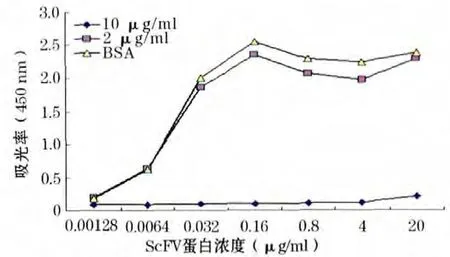
图6 2 μg/ml 的sost-scFv 表达蛋白可以和SOST 抗原特异结合

图7 scFv 表达的Western-bolt 的分析

图8 体外诱导分化检测结果(茜素红染色,×100)
3 讨论
骨质疏松症已成为全球范围内普遍关注的健康问题,由其导致的脆性骨折具有很高的发病率和病死率,因此关于骨质疏松病因机制及治疗研究已成为生命科学中富有挑战性且意义重大的领域。发掘作用于特定靶点的新型抗骨质疏松药物是当今治疗骨质疏松的重要研究方向[13-15],而以骨硬化蛋白(sclerostin)为靶点的抗体药物研发已成为国际抗骨质疏松药物研究的热点[16,17]。而与目前SOST 单克隆抗体相比,单链抗体具有构建表达方便、结构简单、组织穿透力强、免疫原性小,以及便于生产等优点,临床应用前景更加广阔。
scFv 是目前报道最多的基因工程抗体之一,在多种疾病的诊断中具有非常高的应用价值。本研究选择具有抗SOST 特异性的高亲和力mAb 抗体,克隆其可变区基因,并在轻链可变区上游引物前加上与linker 重叠的部分,同时在重链可变区下游引物前端加上12 个H 链铰链区部分碱基,形成与linker上游互补结构;同时采用SOE-PCR 方法构建VL-liner-VH 片段。所得可变区基因片段经过DNA 测序及在线NCBI G enBank 分析比较,证实所得可变区重链基因和轻链基因均为小鼠抗体基因,同源性在90%以上。VL 基因位于linker 上游,VH基因位于linker 下游,scFv 基因全长687bp,序列构建正确。
单链抗体的免疫学活性及其表达量与构建方法密切相关,而VH 和VL 连接顺序、Linker 种类、二聚或多聚化倾向性均会影响单链抗体表达产量及其三维空间构象,进而影响单链抗体生物活性。研究表明,VL-Linker-VH 基因比VH-Linker-VL 表达量高10 ~20 倍[18,19],这也是笔者选择VL-Linker-VH 顺序的原因之一。而Linker 的长度、序列对scFv 的表达水平、稳定性、亲和性均有重要作用。本研究选用含有15 个氨基酸的连接肽(Gly4Ser)3,主要因为丝氨酸属于亲水性强的氨基酸,可增加其亲水性;而甘氨酸的分子量较小、侧链最短,可增加侧链的柔性,该处理方法可使scFv 具有更强的生物活性[20]。
常用测定单链抗体活性方法包括免疫荧光技术、酶联免疫技术、放射免疫分析技术等,然而由于单链抗体缺少抗体恒定区,因此与完整抗体相比,其活性测定相对复杂和困难;最直接的测定方法是制备抗体可变区的抗体,直接与单链抗体反应,但方法复杂费时。本研究首先纯化得到可溶性scFv 蛋白,并通过间接ELISA 法检测其抗原性。结果表明诱导的可溶性scFv 蛋白与抗soso 抗体有较好的特异性和亲和力。在进一步研究中,笔者观察了抗sost单链抗体对体外培养骨髓间充质干细胞诱导成骨作用,从实验结果看,较之自然的诱导分化剂,抗sost单链抗体能够提高骨髓间充质干细胞的体外成骨矿化能力。但体外实验并不能完全反映出抗体注入体内可能发生的生物学效应,因此在下一步研究中仍需要动物体内实验来进一步检测单链抗体的生物学活性。而目前制备单链抗体存在稳定性差、只能与一种抗原特异性结合、功能单一等不足,如何提高其稳定性并进一步提高结合活性及功能,将是进一步研究方向。
综上所述,笔者首次成功构建了单链抗体scFv的表达载体,并证实其表达的scFv 蛋白具有较好的免疫结合活性以及较强的体外诱导分化成骨矿化作用,本研究scFv 单链抗体的成功制备为骨质疏松类疾病治疗提供了一种新的思路和方法。
[1] Rachner T D,Khosla S,Hofbauer L C. Osteoporosis:now and the future[J]. Lancet,2011,377:1276-1287.
[2] Lewiecki E M. Sclerostin:a novel target for intervention in the treatment of osteoporosis [J]. Discovery medicine,2011,12:263-273.
[3] Ominsky M S,Li C,Li X,et al. Inhibition of sclerostin by monoclonal antibody enhances bone healing and improves bone density and strength of nonfractured bones[J]. JBMR,2011,26:1012-1021.
[4] Tian X,Jee W S,Li X,et al. Sclerostin antibody increases bone mass by stimulating bone formation and inhibiting bone resorption in a hindlimb-immobilization rat model[J]. Bone,2011,48:197-201.
[5] Li X,Warmington K S,Niu Q T,et al. Inhibition of sclerostin by monoclonal antibody increases bone formation,bone mass,and bone strength in aged male rats[J]. JBMR,2010,25:2647-2656.
[6] Tian X,Setterberg R B,Li X,et al. Treatment with a sclerostin antibody increases cancellous bone formation and bone mass regardless of marrow composition in adult female rats[J]. Bone,2010,47:529-533.
[7] Agholme F,Li X,Isaksson H,et al. Sclerostin antibody treatment enhances metaphyseal bone healing in rats[J]. JBMR,2010,25:2412-2418.
[8] Ominsky M S,Vlasseros F,Jolette J,et al. Two doses of sclerostin antibody in cynomolgus monkeys increases bone formation,bone mineral density,and bone strength[J]. JBMR,2010,25:948-959.
[9] Lewiecki E M. Sclerostin monoclonal antibody therapy with AMG 785:a potential treatment for osteoporosis[J]. Expert Opin Biol Ther,2011,11:117-127.
[10] Padhi D,Jang G,Stouch B,et al. Single-dose,placebo- controlled,randomized study of AMG 785,asclerostin monoclonal antibody[J]. JBMR,2011,26:19-26.
[11] Ahmad Z A,Yeap S K,Ali A M,et al. scFv antibody:principles and clinical application[J]. Clin Dev Immunol,2012,2012:980250.
[12] McCafferty J,Griffiths A D,Winter G,et al. Phage antibodies:filamentous phage displaying antibody variable domains[J]. Nature,1990,348:552-554.
[13] Silva B C,Bilezikian J P. New approaches to the treatment of osteoporosis[J]. Annu Rev Med,2011,62:307-322.
[14] Lane N E,Silverman S L. Anabolic therapies[J]. Curr Osteop Rep,2010,8:23-27.
[15] Sibai T,Morgan E F,Einhorn T A. Anabolic agents and bone quality[J]. Clin Orthop Relat Res,2011,469:2215-2224.
[16] Papapoulos S E. Targeting sclerostin as potential treatment of osteoporosis [J]. Ann Rheum Dis,2011,70(Suppl 1):119-122.
[17] Moester M J,Papapoulos S E,Lowik C W,et al. Sclerostin:current knowledge and future perspectives[J]. Calcif Tissue Int,2010,87:99-107.
[18] Geng S S,Feng J,Li Y,et al. Binding activity difference of anti-CD20 scFv-Fc fusion protein derived from variable domain exchange[J]. Cell Mol Immunol,2006,3:439-443.
[19] Luo D,Mah N,Krantz M,et al. Vl-linker-Vh orientation-dependent expression of single chain Fv-containing an engineered disulfide-stabilized bond in the framework regions[J]. J Biochem,1995,118:825-831.
[20] Robert B,Dorvillius M,Buchegger F,et al. Tumor targeting with newly designed biparatopic antibodies directed against two different epitopes of the carcinoembryonic antigen (CEA)[J].Int J Cancer,1999,81:285-291.
