单唾液酸四己糖神经节苷脂对颅脑损伤患者血清中神经元特异性烯醇化酶的影响及其临床意义
2013-07-16李计成李晓明戴如飞
李计成,李晓明,戴如飞,蔡 军
单唾液酸四己糖神经节苷脂 (GM1)是含唾液酸的糖神经鞘脂,存在于哺乳类动物细胞膜,神经系统中含量尤其丰富,是神经细胞膜的组成成分,在神经发生、生长、分化过程中起必不可少的作用,对于损伤后的神经修复也非常重要,具有促进神经再生、促进神经轴突生长和突触形成、恢复神经支配功能;改善神经传导、促进脑电活动及其他神经电生理指标的恢复;保护细胞膜、促进细胞膜各种酶活性恢复等作用。中、重型颅脑损伤不但引起严重的脑挫裂伤等原发性损伤,还引起颅内血肿及脑水肿等继发性损伤,脑细胞水肿崩解死亡,导致严重的并发症和后遗症。而神经元特异性烯醇化酶 (neuron-specific enolase,NSE)广泛存在于神经元内,神经元和神经胶质细胞结构破坏后,其在血清浓度的变化能在一定程度上反映脑损伤的严重程度及预后。本研究把血清NSE水平及患者预后作为评价外源性GM1对颅脑损伤患者神经元损伤的保护及改善预后的作用。现报道如下。
1 资料与方法
1.1 一般资料 选择2009年5月—2012年9月在我院住院治疗的颅脑损伤患者96例,其中男63例,女33例;年龄19~71岁,平均41.3岁;格拉斯哥评分8~11分。手术治疗者62例,保守治疗者34例,其中脑挫裂伤患者79例。排除标准:既往有明确的肝、肾、心脏及内分泌疾病史者,严重多发伤或复合伤者,休克及低血压者,双侧瞳孔散大、濒临死亡者。
1.2 主要试剂仪器 ELISA检测NSE试剂盒 (德国DRG公司),GM1(申捷,齐鲁制药有限公司),Bio-rad酶标仪 (美国伯乐公司)。
1.3 研究方法
1.3.1 分组 将其随机分为GM1治疗组 (48例),常规治疗组 (48例)。GM1治疗组手术者30例,非手术者18例;常规治疗组手术者32例,非手术者16例。
1.3.2 治疗及用药方法 颅内血肿或广泛性脑挫裂伤待CT检查后具备手术指征者入院后即行手术治疗,所有患者进行常规治疗。GM1治疗组急性期应用GM1 100mg/d,静脉滴注;2~3周后改为维持量,20~40mg/d,一般疗程为6周。
1.3.3 标本采集及处理 采集外周静脉血进行离心,取血清置于-70℃冰箱保存,采用放射免疫分析法测定血清NSE含量。GM1治疗组和常规治疗组患者的样品保存以及测定方法均相同。
1.4 预后评定 采用格拉斯哥预后评分 (GOS)评定患者预后。
1.5 统计学方法 应用SPSS 12.0软件包对数据进行统计分析,计量资料以(±s)表示,组间比较采用t检验,以P<0.05为差异有统计学意义。
2 结果
2.1 两组未手术患者血清NSE水平比较 两组未手术患者治疗前血清NSE水平比较,差异无统计学意义 (P>0.05);治疗后24h、48h、72h血清NSE水平比较,差异均有统计学意义 (P<0.05);治疗后7h血清NSE水平比较,差异无统计学意义 (P>0.05,见表1)。
2.2 两组手术患者血清NSE水平比较 两组手术患者治疗前血清NSE水平比较,差异无统计学意义 (P>0.05);治疗后24h、48h、72h血清NSE水平比较,差异均有统计学意义 (P<0.05);治疗后7h血清NSE水平比较,差异无统计学意义(P >0.05,见表2)。
2.3 两组患者预后比较 治疗后14d,两组患者GOS评分比较,差异无统计学意义 (P>0.05);治疗后3个月,两组患者GOS比较,差异有统计学意义 (P<0.05,见表3)。
表1 两组未手术患者血清NSE水平比较(±s,μg/L)Table 1 Comparison of serum NSE level between two groups did not operation

表1 两组未手术患者血清NSE水平比较(±s,μg/L)Table 1 Comparison of serum NSE level between two groups did not operation
.7 15.7±3.1 GM1治疗组 18 9.0±2.5 17.4±2.8 24.5±1.9 25.8±3.3 22.2±3 7d常规治疗组 16 9.2±2.1 20.6±2.1 27.9±2.2 33.1±3.5 30.2±2例数 治疗前 治疗后12h 治疗后24h 治疗后48h 治疗后72h 治疗后.1 12.2±2.5
表2 两组手术患者血清NSE水平比较(±s,μg/L)Table 2 Comparison of serum NSE level between two groups did operation
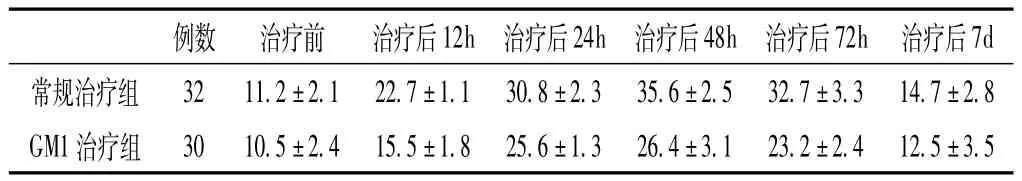
表2 两组手术患者血清NSE水平比较(±s,μg/L)Table 2 Comparison of serum NSE level between two groups did operation
3.3 14.7±2.8 GM1治疗组 30 10.5±2.4 15.5±1.8 25.6±1.3 26.4±3.1 23.2±7d常规治疗组 32 11.2±2.1 22.7±1.1 30.8±2.3 35.6±2.5 32.7±例数 治疗前 治疗后12h 治疗后24h 治疗后48h 治疗后72h 治疗后2.4 12.5±3.5
表3 两组患者GOS比较(±s,分)Table 3 Comparison of GOS score between two groups

表3 两组患者GOS比较(±s,分)Table 3 Comparison of GOS score between two groups
个月组别 例数 治疗后14d 治疗后3 48 2.45 ±0.45 4.31 ±0.98 48 2.35 ±0.55 3.23 ±1.03 GM1治疗组常规治疗组
3 讨论
NSE特异性存在神经元胞质中,其阳性表达计数间接反映神经元缺失程度[1],正常情况下血液中含有极少量NSE。但是当发生颅脑损伤、脑卒中时神经遭破坏,NSE可经细胞间隙释放入血和脑脊液中,更甚者血-脑脊液屏障破坏,大量神经元崩解坏死,NSE大量释放,非特异性的脑损伤越严重释放的NSE越多,NSE被认为评价脑外伤损伤程度及预后恢复的特异性敏感性指标之一[2-4]。本研究中GM1治疗组较常规治疗组NSE指标无论手术组和非手术组在治疗后24h、48h、72h都明显降低,排除早期手术影响,提示在早期抑制神经细胞继发损伤上有明确意义。在后期神经修复上,临床GOS评分GM1治疗组也较常规治疗组有显著性差异。
在中枢神经系统中的许多部位已发现GM1受体,GM1与其受体结合,被逆行转运到神经元内。促进蛋白质合成能量合成,发挥神经趋化作用,能够防止损伤的神经元死亡。促神经元的再生和脑功能恢复,它对受损细胞的分化、功能维持和生存起着十分重要的作用[5],主要作用体现在GM1可以对抗兴奋神经毒性,它通过抑制神经细胞Ca持续内流及抑制谷氨酸对蛋白激酶C的激活,从而防止兴奋毒性发生,而外源性GM1与细胞膜的特异区域结合,改变Na-K-ATP酶周围环境或膜的稳定性,减低细胞耗氧量;GM1可通过抑制胱冬酶-3,调节Bcl-2和BaX的表达及激活磷酸肌醇3-激酶及活化鞘氨醇肌酶而抑制凋亡。从而促进神经修复改善神经功能[6],另外GM1能活化多种神经营养因子,其本身也具有营养神经作用,可促进神经元修复和神经功能恢复;GM1通过抑制神经元型一氧化氮合酶来源的一氧化氮合成防止神经元迟发性损害,对神经元有保护作用[7];另外它还在诱导热休克蛋白70表达调节神经递质方面改善和保护神经功能。长期随访表明,外源性GM1至少可以改善部分认知与运动功能[8-9]。脑挫裂伤引起脑水肿等继发性损伤病理基础是缺血缺氧性损伤,通过使用GM1减少早期神经细胞继发损伤,增强神经元对抗损伤耐受性,加强损伤后脑神经元修复,并通过NSE量化评价,反映出使用GM1治疗脑挫裂伤具有良好的脑神经保护和后期明显提高认知和运动的作用。
本研究因临床原因采用测定血清NSE水平变化来评定临床疗效,且选取检查时间区间较短,可在以后研究中行脑脊液NSE含量变化和增长时间跨度进一步检验疗效及寻找最佳监测时间窗。研究中非手术患者病例较少无法对比评价手术对NSE的早期影响,随着样本量的增加相信可以得到进一步阐明。
1 Vos PE,Lamers KJ,Hendriks JC,et al.Glial and neuronal proteins in serum predict outcome after severe traumatic brain injury[J].Neurology,2004,62(18):1303-1310.
2 Hergenroeder GW,Redell JB,Moore AN,et al.Biomarkers in the clinical diagnosis and management of traumatic brain injury[J].Mol Diagn Ther,2008,12(6):345-358.
3 Guzel A,Er U,Tatli M,et al.Serum neuro-specific enolase as a predictor of short-term outcome and its correlation with Glasow Coma Scale in traumatic brain injury[J].Neurosury Rev,2008,31(4):439-445.
4 Chiaretti A,Barone G,Riccardi R,et al.NGF,DCX and NSE upregulation correlates with severity and outcome of head trauma in children[J].Neurology,2009,72(7):609-616.
5 Putcha GV,LE S,Fmk S,et al.JNK-mediated BIM phosphorylation potentiates BAX-dependent apoptosis[J].Neuro,2003,38(6):899-914.
6 梁庆成,臧召霞,刘佩芳,等.神经节苷脂GM1在缺血性脑血管病中的神经保护机制 [J].国外医学:脑血管疾病分册,2005,13(1):50-54.
7 Guegan C,Ceballos-Picot I,Chevalier E,et al.Reduction of ischemic damage in NGF-transgenic mice:correlation with enhancement of antioxidant enzymeactivities[J].Neurobiol Dis,1999,6(3):180-189.
8 刘卫平,伊西才,甄海宁,等.鼠神经生长因子预防颅脑损伤后功能障碍临床观察[J].中华神经医学杂志,2010,9(2):193-195.
9 潘树义,王苏平,钟世镇.神经生长因子对脑保护作用的对比研究[J].中国临床神经科学,2002,10(2):112-114.
