hper1基因3′端UTR区双荧光素酶报告系统构建*
2013-07-16赵溪岩成姝婷勾洵王正荣肖静郭慧玲汪宇辉
赵溪岩 成姝婷 勾洵 王正荣 肖静 郭慧玲 汪宇辉△
(1.四川大学华西基础医学与法医学院生物医学工程研究室卫生部时间生物学重点实验室,四川 成都610041;2.四川大学生物治疗国家重点实验室,四川 成都610041;3.四川大学“985工程——创新药物研究科技创新平台”,四川 成都610041)
生物体内各个组织器官中均存在周期约为24h的近日节律。近日节律受内在振荡器-近日钟控系统调控[1-2]。核心的近日钟基因有clock,bmal1和per1、2等。其中per1基因,是生物节律分子振荡系统的重要组成部分[3-4],在调节生物节律和器官功能方面起重要作用,并与肿瘤细胞增殖[5-6]、抑制[9]及凋亡[7-8]有密切关系。研究发现,microRNA可与3′UTR区结合调控基因表达[10]。Targetscan分析显示,microRNA138,microRNA24,microRNA29a/b/c可能与hper1基因3′UTR区结合,提示microRNA通过3′UTR区域调控hper1基因转录表达。本实验采用双荧光素报告酶系统为载体构建hper1基因3′UTR的双荧光素酶报告系统PMIR-3′UTR,以进一步研究microRNA对hper1基因的调控机制。
1 材料与方法
1.1 材料
1.1.1 细胞株
A549细胞株来源于四川大学华西医学中心时间生物学实验室。
1.1.2 PMIR载体
载体pmiR-RB-REPORTTM购自广州锐博生物。
1.1.3 主要试剂和仪器
Trizol(Invitrogen),限制性内切酶 XhoI,NotI(TaKaRa),DNA 聚合酶(TaKaRa),PrimeSTAR HS DNA 聚合酶(TaKa-Ra),Fermantas逆转录试剂盒,质粒提取试剂盒(天根生化),DNA凝胶纯化试剂盒(天根生化),DNA产物纯化试剂盒(天根生化),DH5α感受态细胞(天根生化),Lipo2000(Invitrogen)。PCR仪(Bio-RAD),核酸蛋白测定仪(Eppendorf),荧光酶标仪(Synery 4)。
1.1.4 引物
引物由上海生工合成,产物长度为617bp,见表1。

表1 引物序列
1.2 方法
1.2.1hper1基因3′UTR区基因序列分析及引物设计
根据Pubmed Genebank NM_002616确定hper1基因3′UTR区,设计特异性引物,在上下游引物中加入保护碱基和限制性内切酶XhoI,NotI的酶切位点。
1.2.2 细胞培养
A549细胞用DMEM高糖培养基+10%胎牛血清培养,在细胞对数生长期进行实验。
1.2.3 PMIR-3′UTR构建及鉴定
RT-PCR合成序列片段,经双酶切、纯化,与PMIR双荧光素酶报告载体进行酶连接。将构建PMIR-3′UTR转染至DH5α感受态细胞,提取PMIR-3′UTR。重组PMIR-3′UTR交北京六合华大基因科技股份有限公司测序。
1.2.4 PMIR-3′UTR荧光素(Luminescence)表达检测
转染24h后,荧光酶标仪分别检测转染PMIR-3′UTR报告系统与阳性对照载体的荧光(Luminescence)值。
2 结果
2.1 hper1基因3′UTR区域PCR扩增,PMIR载体双酶切及纯化
PCR产物进行1%琼脂糖电泳分析,特异性扩增条带清晰明显(如图1)。PMIR载体经限制性内切酶Xhol,NotI双酶切及纯化后,特异性条带清晰明显(如图1)。

图1 hper1基因3′端UTR区PCR产物及PMIR载体酶切纯化产物电泳图
2.2 PMIR-3′UTR双酶切鉴定
双荧光素酶报告系统PMIR-3′UTR酶切产物进行1%的琼脂糖电泳鉴定,得到两个酶切片段,分别为双荧光素酶报告载体片段和PCR扩增的hper1基因3′端UTR区片段,结果如图2:

图2 PMIR-3′UTR双酶切电泳图
2.3 PMIR-3′UTR测序鉴定
双荧光素酶报告系统PMIR-3′UTR测序结果显示插入的3′UTR序列正确。
2.4 双荧光素酶报告系统 PMIR-3′UTR 荧光值(Luminescence)表达
荧光酶标仪测定结果显示,PMIR-3′UTR双荧光素酶报告系统与阳性对照报告基因载体分别转染入A549细胞后,PMIR-3′UTR与和PMIR阳性对照均能在细胞内产生荧光素(Luminescence)表达,见图3。
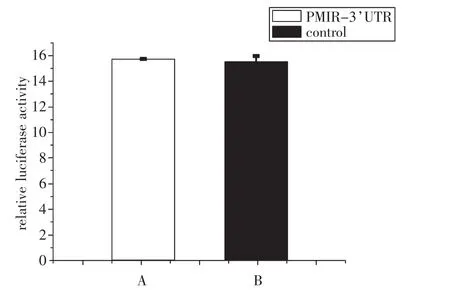
图3 PMIR-3′UTR与阳性对照相对荧光活性比较
3 讨论
生物钟基因调控机制尚不完全清楚,前期对钟基因的调控主要研究集中在转录因子与5′端转录调控区结合调控转录表达[11-14]。近来研究发现,microRNA可与某些生物钟基因的3′UTR区结合,调控基因表达[15-18],从而调控细胞增殖与细胞周期。本文通过扩增hper1基因3′UTR区,连接至双荧光素酶报告载体中,并检测PMIR-3′UTR萤光值,证实 PMIR-3′UTR双荧光素酶报告系统在细胞中可以正常表达。在构建PMIR-3′UTR后,将其与通过生物信息学分析提示可能与其作用的microRNA138,miroRNA24,microRNA29a,microRNA29b 及microRNA29c共转染入细胞中,继续探究这些microRNA对hper1基因的调控机制。本实验成功构建PMIR-3′UTR,以其为平台来研究microRNA对近日节律核心基因hper1 3′UTR区的调控功能,进一步完善近日节律钟系统的分子振荡机制,揭示与节律失调的相关疾病发病机制,为疾病治疗提供新的思路。
1 Hastings MH,Reddy AB,Maywood ES.A clockwork web:circadian timing in brain and periphery,in health and disease[J].Nat Rev Neurosci,2003,4(8):649-661.
2 Reppert SM,Weaver DR.Molecular analysis of mammalian circadian rhythms[J].Annu Rev Physiol,2001,63:647-676.
3 Albrecht U,Zheng B,Larkin D,et al.MPer1and mper2are essential for normal resetting of the circadian clock[J].J Biol Rhythms,2001,16(2):100-104.
4 Rath MF,Rohde K,Miller M.Circadian oscillations of molecular clock components in the cerebellar cortex of the rat[J].Chronobiol Int,2012,29(10):1289-1299.
5 Yang X,Wood PA,Ansell CM,et al.The circadian clock gene Per1suppresses cancer cell proliferation and tumor growth at specific times of day[J].Chronobiol Int,2009,26(7):1323-1339.
6 Suzuki T,Sato F,Kondo J,et al.Period is involved in the proliferation of human pancreatic MIA-PaCa2cancer cells by TNF-alpha[J].Biomed Res,2008,29(2):99-103.
7 Sato F,Wu Y,Bhawal UK,et al.PERIOD1(PER1)has anti-apoptotic effects,and PER3has pro-apoptotic effects during cisplatin(CDDP)treatment in human gingival cancer CA9-22cells[J].Eur J Cancer,2011,47(11):1747-1758.
8 Sato F,Nagata C,Liu Y,et al.PERIOD1is an anti-apoptotic fac-tor in human pancreatic and hepatic cancer cells[J].J Biochem,2009,146(6):833-838.
9 Yang X,Wood PA,Ansell C,et al.Circadian time-dependent tumor suppressor function of period genes[J].Integr Cancer Ther,2009,8(4):309-316.
10 Bartel DP.MicroRNAs:target recognition and regulatory functions[J].Cell,2009,136(2):215-233.
11 Lee KH,Kim SH,Kim DY,et al.Internal ribosomal entry sitemediated translation is important for rhythmic PERIOD1expression[J].PLoS One,2012,7(5):e37936.
12 Kim DY,Woo KC,Lee KH,et al.hnRNP Q and PTB modulate the circadian oscillation of mouse Rev-erb alpha via IRES-mediated translation[J].Nucleic Acids Res,2010,38(20):7068-7078.
13 Ovadia A,Tabibian-Keissar H,Cohen Y,et al.The 5′UTR of CCA1includes an autoregulatory cis element that segregates between light and circadian regulation of CCA1and LHY[J].Plant Mol Biol,2010,72(6):659-671.
14 Severino G,Manchia,M,Contu P,et al.Association study in a Sardinian sample between bipolar disorder and the nuclear receptor REV-ERBalpha gene,a critical component of the circadian clock system[J].Bipolar Disord,2009,11(2):215-220.
15 Shende VR,Goldrick MM,Ramani S,et al.Expression and rhythmic modulation of circulating microRNAs targeting the clock gene Bmal1in mice[J].PLoS One,2011,6(7):e22586.
16 Tan X,Zhang P,Zhou L,et al.Clock-controlled mir-142-3p can target its activator,Bmal1[J].BMC Mol Biol,2012,13:27-27.
17 Shi L,Ko ML,Ko GY.Rhythmic expression of microRNA-26a regulates the L-type voltage-gated calcium channel alpha1Csubunit in chicken cone photoreceptors[J].J Biol Chem,2009,284(38):25791-25803.
18 Saus E,Soria V,Escaramis G,et al.Genetic variants and abnormal processing of pre-miR-182,a circadian clock modulator,in major depression patients with late insomnia[J].Hum Mol Genet,2010,19(20):4017-4025.
