TNF-α增强膀胱上皮细胞清除细胞内肺炎克雷伯杆菌*
2013-07-16张虎山路会侠熊文碧刘伟吴琦
张虎山 路会侠 熊文碧 刘伟 吴琦△
(1.四川大学华西基础医学与法医学院感染免疫研究室,四川 成都610041;2.四川大学华西基础医学与法医学院药理教研室,四川 成都610041)
上皮细胞是宿主与细菌相互接触的前沿,除了物理屏障功能,作为宿主防御病原体感染的第一道防线,上皮细胞有复杂的免疫防御及炎症反应机制。肺炎克雷伯杆菌(Klebsiella pneumoniae,KP)是一种重要的条件致病菌,当机体免疫力低下时,能引起疾病的发生。从泌尿道到呼吸道,肺炎克雷伯杆菌感染的发病率都很高,且在临床上易反复发作。
吞噬细胞(中性粒细胞、单核/巨噬细胞)在吞噬病原微生物后发生“呼吸爆发”(Respiratory burst),产生大量活性氧(Reactive oxygen species,ROS)或活性氮(RNI),以活性氧或者活性氮破坏微生物核算、蛋白等来杀灭细菌,是重要的杀菌机制[1-2]。细菌进入上皮细胞无论在体外培养细胞模型或体内细菌感染都是重要生物学现象,并与疾病的发生发展密切相关。迄今研究提示,上皮细胞能对抗进入细胞内的细菌,但其中涉及哪些分子机理,仍然缺乏深入探讨。本研究以肺炎克雷伯杆菌感染 T24细胞为实验模型,使用 TNF-α、IFN-γ、IL-1β等重要炎症细胞因子,初步探讨膀胱上皮细胞对抗细胞内细菌的作用机制。
1 材料与方法
1.1 材料
肺炎克雷伯杆菌(Klebsiellapneumoniae,KP)编号K5株,为临床尿路感染分离株,由本实验室保存。人膀胱上皮细胞株 T24为本实验室保存。细胞因子 TNF-α、IFN-γ、IL-1β为PeproTech公司产品。1640细胞培养基,非必需氨基酸购自Gibco公司。LB培养基为Oxoid公司产品。胎牛血清购自兰州民海公司产品。胰蛋白酶购自Merck公司。过氧化氢酶(Catalase CATA),一氧化氮合酶抑制剂(L-NAME),Triton X-100购自Sigma。其余试剂为国产分析纯。
1.2 方法
1.2.1 细胞培养
T24细胞用含10%胎牛血清的1640培养基(无抗生素),37℃5%CO2常规培养。待细胞进入快速生长期,以1.2×105·孔-1接种于 24 孔板,待细胞融合时(约 2.5×105·孔-1)进行实验。
1.2.2 细菌培养
从LB平板中挑取肺炎克雷伯杆菌K5株单个菌落接种于5ml LB液体培养基,150转·min-1振荡培养3h,取100μl菌液铺于LB固体培养板,倒置于37℃孵箱,培养16h后收集活菌,紫外分光光度计测定650nm OD值确定细菌数量,用RPMI-1640培养基将细菌稀释到适当浓度。
1.2.3 细菌感染入侵T24细胞
用PBS洗T24细胞三次,每孔加入细菌悬液500μl,细菌数与细胞数的比例为100∶1,每个实验组为3复孔。让细菌与T24细胞共孵育2h,采用含庆大霉素(100μg·ml-1)培养基孵育2h杀灭细胞外的细菌,分别在加入细菌后的4、8、18、24h用0.25%Triton X-100裂解细胞,释放出细胞内的细菌,用平板菌落计数法计算细胞内细菌数量(将裂解液作10倍系列稀释,每个稀释样品涂2个LB平板,置于37℃温箱中培养,24h后计数菌落)。
1.2.4 细胞因子对T24细胞内活菌数量的影响
K5株细菌与T24细胞共孵育2h,用PBS洗T24细胞三次,加入含有庆大霉素的1640培养基孵育2h杀灭细胞外细菌,然后加入含不同浓度细胞因子(TNF-α、IFN-γ或IL-1β)的新鲜培养基,继续培养细胞至细菌感染细胞后的24及48h,以Triton X-100裂解细胞,平板菌落计数法确定细胞内细菌数量。
1.2.5 过氧化氢酶(CATA)、L-NAME对细胞因子刺激的抗菌作用的影响
K5株细菌与T24细胞共孵育2h,用PBS洗T24细胞三次,加入含有庆大霉素的RPMI-1640培养基孵育2h杀灭细胞外细菌,然后加入含CATA或L-NAME的培养基预处理细胞1h,再加入同时含细胞因子及抑制剂的培养基继续培养,于24 h裂解细胞,确定细胞内细菌数量。
1.3 统计学处理
采用SPSS13.0进行统计学处理,数值以±s表示,采用t检验。
2 结果
2.1 K5株细菌在T24细胞内的数量动态变化
平板菌落计数结果显示,K5株细菌进入T24细胞在细胞内生长,以细菌进入细胞后8h胞内活菌数量最多,以后缓慢减少。8、18、24h细胞内活菌数量分别比4h增加36%、34%、22%,见图1。
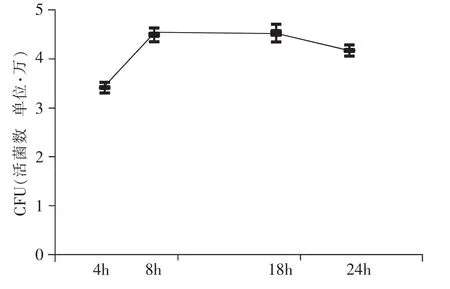
图1 细菌内活菌随时间变化趋势
2.2 TNF-α对T24细胞抗菌活性的影响
在细菌进入细胞后,分别以5、10、20ng·ml-1TNF-α作用于细胞。结果显示,在实验24h,TNF-α20ng组细胞内活菌数量明显低于实验对照组,统计学分析有显著差异(P<0.01),TNF-α5ng组、10ng组细胞内活菌数量与对照组相比无显著差异。在实验48h,TNF-α10ng、20ng组细胞内活菌数量低于对照组(P<0.01),5ng组与对照组无显著差异(P>0.05)。说明使用TNF-α可以促进膀胱上皮细胞杀灭胞内K5株细菌,并呈浓度依赖关系,见图2。
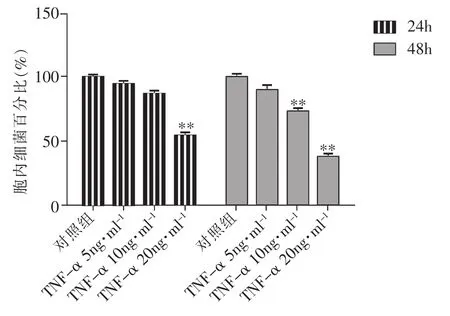
图2 TNF-α对细胞内活菌数量的影响
2.3 联合使用TNF-α和IFN-α对T24细胞抗菌活性的影响
与空白对照组相比,TNF-α(20ng· ml-1)和INF-γ(20ng·ml-1)联合使用组在12h、24h、48h细胞内活菌数量分别减少36.1%、74.1%、94.4%。结果说明 使用 TNF-α和INF-γ能更加显著地促进T24细胞清除胞内的细菌,提示这两种细胞因子联合使用可能存在协同效应,见图3。

图3 联合使用TNF-α和IFN-α对T24细胞抗菌活性的影响
2.4 CATA、L-NAME对细胞因子刺激的抗菌作用的影响
实验24h裂解细胞,平板菌落计数胞内活菌数结果显示:TNF-α+INF-γ+CATA 组与 TNF-α+INF-γ组比较,24h细胞内活菌数增加了3.16倍,统计学分析有显著意义(P<0.01),表明CATA能够抑制由 TNF-α+INF-γ刺激产生的T24细胞抗菌活性。L-NAME对细胞因子刺激的抗菌作用无明显影响。结果见图4。
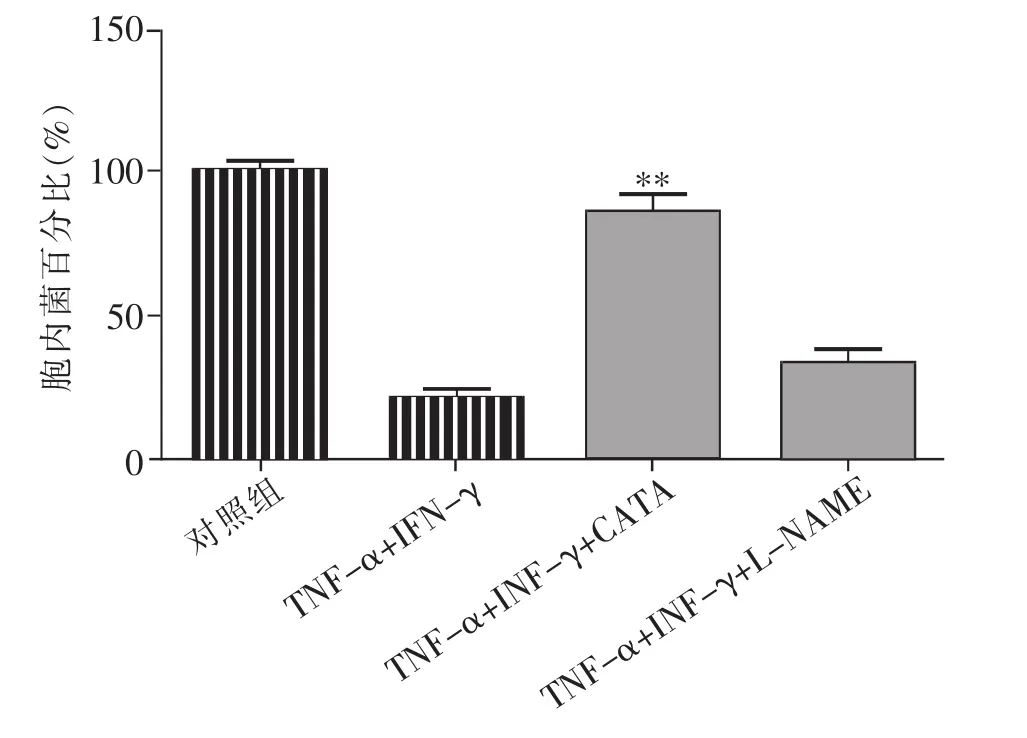
图4 CATA、L-NAME对K5在TNF-α+INF-γ刺激后的细胞内细菌数量的影响
2.5 IL-1β对T24细胞抗菌作用的影响
在实验24h,实验各组之间细胞内的活菌数无明显差异(P>0.05)。在实验48h,IL-1β5ng、10ng组与空白对照组无显著差异(P>0.05),IL-1β20ng组比空白对照组细胞内活菌数量有一定程度减少(P<0.05),说明IL-1β仅在较高浓度(20ng·ml-1)对膀胱上皮细胞抗菌作用有轻微的促进作用,见图5。
3 讨论
早在20世纪60年代,动物实验显示,即使把大量的大肠杆菌直接注入豚鼠、大鼠、兔膀胱(甚至有实验把大肠杆菌注入到人的膀胱),结果并不能造成慢性尿路感染,经过72h,膀胱已清除注入的细菌[3-6]。正常膀胱粘膜究竟是如何清除这些细菌的呢,这是一个值得深究的问题。
近年来研究提示,通过与细菌的直接接触,或者吞噬摄取细菌,上皮细胞也许有与吞噬细胞同样重要的抗菌作用。Deitch[7]的实验显示与铜绿假单胞菌、金黄色葡萄球菌共同培养的肠上皮细胞对这些细菌有很强的杀菌活性(甚至强过中性粒细胞)。Dolapci[8]的研究则展现了口腔粘膜上皮细胞对链球菌的抗菌能力。Schulte-Wissermann[9]与 Schofer[10]观察到大肠埃希菌与正常人尿液中脱落的上皮细胞接触后死亡,而来自反复尿路感染患者的尿液脱落上皮细胞缺乏类似的抗菌活性。最近,Mulvcy[11]在以小鼠为模型的研究中发现,尿路致病性大肠埃希菌进入膀胱上皮细胞,并可以在细胞内生长,形成细胞内细菌集团(Intracellular bacterial communities,IBC),这个现象可能有助于细菌逃避宿主免疫防御,成为尿路感染容易反复发作的原因。然而注入小鼠膀胱的细菌达到108,在每个膀胱中只观察到数十个胞内细菌集团,提示膀胱上皮细胞存在抗菌功能,大多数细菌生长被限制。
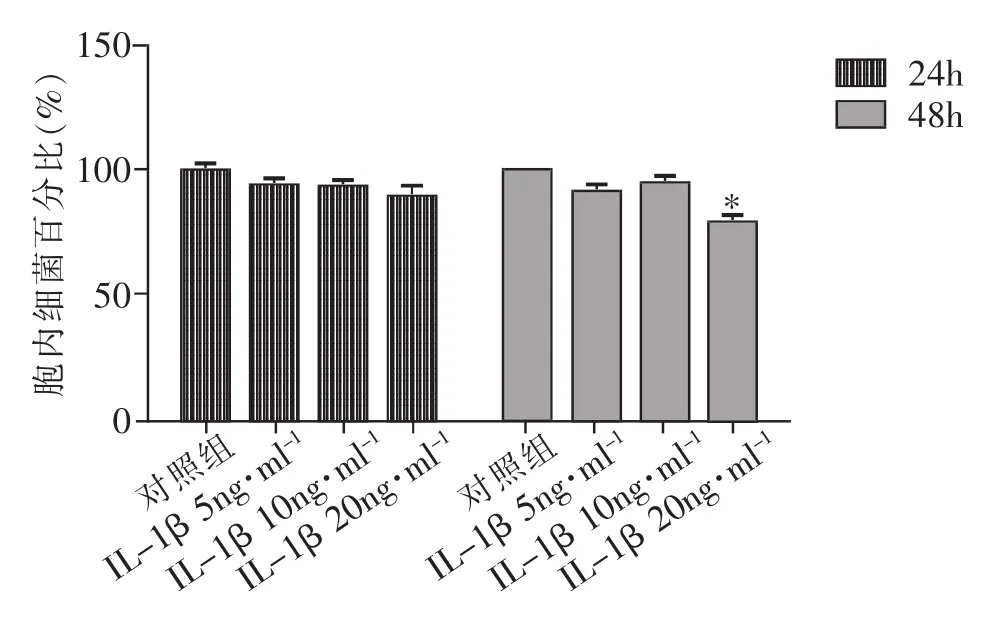
图5 IL-1β不同浓度对T24细胞抗菌影响
我们采用临床分离的肺炎克雷伯杆菌K5株感染T24细胞,发现细菌在T24细胞内早期有一定程度的生长(细菌数量增加一般不超过1倍),以后即逐渐减少。这表明在没有任何刺激的情况下,膀胱上皮细胞有效限制了胞内细菌的生长,并可能逐渐将它们清除。本试验结果与Tobias等[12]的报道相似,他们的研究显示肺炎克雷伯杆菌进入T24细胞后在24h内细菌数量有轻微增加,以后则逐渐减少。
对于上皮细胞限制胞内细菌生长或杀灭胞内细菌的机制,目前所知甚少。Lajarin等[13]发现鼠伤寒沙门菌能在肝细胞内生长,采用 TNF-α、IL-lβ和 LPS联合刺激后,肝细胞中鼠伤寒沙门菌的生长能力下降。Mellouk等[14]报道IFN-α刺激可以增加肝细胞活性氮(NO)的浓度,从而抑制肝细胞内恶性疟原虫的生长。在以血管内皮为模型进行的实验中,Assis等[15]发现采用TNF-α和IFN-α刺激脐静脉内皮细胞后,进入细胞的铜绿假单胞菌生长能力显著下降。
细胞因子对尿路上皮细胞抗菌功能的影响还未见文献报道。在本文研究中,我们比较系统的观察了TNF-α、IL-lβ等细胞因子对进入膀胱上皮细胞的肺炎克雷伯杆菌生存的影响,发现单独使用TNF-α能够不同程度的促进膀胱上皮细胞抗菌活性,联合使用TNF-α与IFN-γ能更加显著地促进T24细胞的抗菌作用。实验同时发现使用过氧化氢酶(CATA),显著抑制T24细胞抗菌活性,表明上皮细胞抗菌过程中H2O2起着重要的作用。L-NAME是一氧化氮合酶的抑制剂,本研究显示LNAME对T24细胞抗菌活性无明显影响,因此NO可能不涉及膀胱上皮细胞抗菌作用。
与吞噬细胞相似,上皮细胞也可以表达抗菌活性多肽或者蛋白(如β-防御素),但是这些分子是否参与对抗胞内细菌缺乏细胞或动物模型实验证据。一般认为上皮细胞产生的抗菌肽分泌到粘膜表面形成抗菌生化屏障。IL-lβ可以显著刺激上皮细胞表达抗菌肽,本研究发现IL-lβ并不能显著增强T24细胞抗菌功能,提示抗菌活性多肽或蛋白与T24细胞对抗胞内肺炎克雷伯杆菌无关。上皮细胞清除胞内细菌是极为复杂的生物学过程,这中间涉及了细菌对上皮细胞粘附,上皮细胞吞噬(摄取)细菌,上皮细胞天然免疫受体对细菌的识别,细胞内炎症反应及信号传递,功能基因的表达等,值得我们深入探讨。
1 Finkel T.Oxidant signals and oxidative stress[J].Curr Opin Cell Biol,2003,15(2):247-254.
2 Geiszt M,Leto TL.The Nox family of NAD(P)H oxidases:host defense and beyond[J].J Biol Chem,2004,279(50):51715-51718.
3 Cox CE,Hinman F Jr.Experiments with induced bacteriuria,vesical emptying and bacterial growth on the mechanism of bladder defense to infection[J].J Urol,1961,86(10):739-748.
4 Norden CW,Green GW,Kass EH,et al.Antibacterial mechanisms of urinary bladder[J].J Clin Invest,l968,47(12):2689-2700.
5 Hand WL,Smith JW,Sanford JP,et al.The antibacterial effect of normal and infected urinary bladder[J].J Lab Clin Med,1971,77(4):605-615.
6 Harrison G,Cornish J,Vanderwee MA,et al.Host defence mechanisms in the bladder.I.Role of mechanical factors[J].Br J Exp Pathol,1988,69(2):245-254.
7 Deitch EA,Haskel Y,Cruz N,et al.Caco-2and IEC-18intestinal epithelial cells exert bactericidal activity through an oxidant-dependent pathway[J].Shock,1995,4(5):345-350.
8 Dolapci N,Salo RJ,Cross AS,et al.Antibacterial capacity of oral(epithelial cells from healthy donors and patients with Behcet′s disease[J].Arch Delmatol Res,2003,295(3):124-126.
9 Schulte-Wissermann H,Mannhardt W,Schwarz J,et al.Comparison of the antibacterial effect of uro-epithelial cells from healthy donors and children with asymptomatic bacteriuria[J].Eur J Pediatr,1985,144(3):230-233.
10 Schofer O,Ludwig KH,Mannhardt W,et al.Antibacterial capacity of buccal epithelial cells from healthy donors and children with recurrent urinary tract infections[J].Eur J Pediatr,1988,147(3):229-232.
11 Mulvey MA,Schilling JD and HuRgren SJ.Establishment of a persistentEscherichiacolireservoir during the acute phase of a bladder infection.Infect[J].Immun,2001,69(7):4572-0579.
12 Tobias A,Todaro I,Neziroglu F,et al.Invasion of cultured human epithelial cells byKlebsiellapneumoniaeisolated from the urinary tract[J].Infect Immun,1997,65(7):2950-2958.
13 Lajarin F,Rubio G,Galvez J,et al.Adhesion,invasion and intracellular replication of Salmonella typhimurium in a murine hepatocyte cell line.Effect of cytokines and LPS on antibacterial activity of hepatocytes[J].Microb Pathog,1996,21(5):319-329.
14 Mellouk S,Hoffman SL,Liu zz,et al.Nitric oxide-mediated antiplasmodial activity in human and murine hepatocytes induced by gamma interferon and the parasite itself:enhancement by exogenous tetrahydrobiopterin[J].Infect.Immun,1994,62(9):4043-4046.
15 Asis MC,Diamond MP,DeChemey AH,et al.Human endothelial cells are activated by interferon-γplus tumor necrosis factor-αto kill intracellularPseudomonasaeruginosa[J].Immunology,2000,101(2):271-278.
