对乙酰基偶氮羧光度法测定大豆中可溶性蛋白
2013-07-12冯爱青胡秋娈侯晓慧
冯爱青,胡秋娈,侯晓慧
(1.洛阳师范学院生命科学系,河南 洛阳 471022;2.洛阳师范学院化学化工学院,河南 洛阳 471022)
2006 年在上海召开的“中国大豆食品产业圆桌峰会议”提出了发展中国大豆产业,实施“双蛋白(大豆+牛奶)工程”振兴计划[1],人们对大豆蛋白的研究与开发倍加重视。大豆是最丰富、最优质的植物蛋白资源,其水溶性蛋白质可以被人体直接吸收利用,因此对大豆水溶性蛋白的研究及测定具有重要意义[2-3]。
国内对大豆水溶性蛋白质的测定主要采用经典的凯氏定氮法,此法操作繁杂,而且测定的是样品中的含氮量,除了蛋白质组成中的氮外,还包括非蛋白质组成中的其他有机或无机态氮[4-5]。如何科学准确地测定蛋白质含量,是现代食品检测研究中最活跃的领域之一,也是解决食品安全方面所面临的重要问题。
蛋白质测定的光谱分析方法有直接紫外光谱法、分光光度法、荧光光度法、共振瑞利散射光谱法等。其中分光光度法具有操作简便、成本低、灵敏度高、重现性好等优点[6]。研究发现,在pH2.90 的Britton-Robinson缓冲介质中,紫红色的有机试剂对乙酰基偶氮羧能与蛋白质形成蓝色复合物,λmax 669 nm,该波长下的表观摩尔吸光系数为3.09×105L/(mol·cm),蛋白质在10 μg/mL~100 μg/mL(BSA)范围内遵循比尔定律,以此建立的蛋白质测定新方法,线性范围宽,灵敏度高。用于大豆水溶性蛋白的测定,操作简便,重现性好,基本无干扰,取得满意结果。
1 材料与方法
1.1 仪器与试剂
UV-3010 型紫外可见分光光度计:日本日立公司;pHS-3C 精密pH 计:上海雷磁仪器厂;722 型光栅分光光度计:上海欣茂仪器有限公司;10 mL 具塞比色管。
对乙酰基偶氮羧:上海长科试剂研究所,2.0×10-4mol/L;牛血清白蛋白、人血清白蛋白:BSA、HSA,北京百泰生化技术公司;卵蛋白(OVA):上海伯奥生物科技公司;溶菌酶(LYS):上海丽珠东风生物技术有限公司;酪蛋白(CAS):上海华硕精细化学品有限公司;蛋白质浓度均为1 mg/mL;Britton--Robinson(B-R)缓冲溶液;十二烷基硫酸钠(SDS),0.1%;TritonX-100(TX-100),1%;溴代十六烷基吡啶(CPB),0.1%;聚乙醇辛基苯基醚(OP),2%。所用试剂均为分析纯,试验用水为二次去离子水。
1.2 方法
于10 mL 具塞比色管中依次加入1.0 mLB-R 缓冲溶液,2.0 mL 对乙酰基偶氮羧溶液,0.5 mLBSA 标准溶液,1.0 mLTX-100 溶液,水稀释至刻度,摇匀,以相应试剂为参比,用1 cm 比色皿扫描吸收光谱或于669 nm 测定溶液的吸光度。
2 结果与讨论
2.1 吸收光谱
吸收光谱如图1。

图1 吸收光谱图(pH2.90)Fig.1 Absorption spectra(pH2.90)
在pH2.90 的B-R 缓冲溶液中,对乙酰基偶氮羧的λmax 为577 nm(a),加入BSA 后,溶液颜色由透明紫红色变为蓝色,在669 nm 处产生最大吸收(b),表明有新的物质生成。从对乙酰基偶氮羧和BSA 在酸性条件下的结构可知,二者主要靠静电引力形成了复合物,使λmax 红移约92 nm。在一定浓度范围内,BSA 浓度与吸光度值呈良好的线性关系,实验选择669 nm 作为测定波长。
2.2 缓冲溶液及用量选择
在不同pH 的缓冲溶液中,测定复合物的吸光度。结果表明:在VB-R=0.5 mL~2.0 mL 的缓冲溶液中,体系稳定,吸光度值最大。实验用1.0 mL 的B-R 缓冲溶液,控制反应体系的pH 为2.90。
2.3 试剂用量选择
固定蛋白质的用量,改变对乙酰基偶氮羧的用量,随着对乙酰基偶氮羧用量的增加,吸光度在不断的增加,VR=1.8 mL~2.2 mL 时吸光度基本保持不变,实验取对乙酰基偶氮羧的用量为2.0 mL,CR/CBSA=54∶1。
2.4 反应时间及稳定性
对乙酰基偶氮羧与BSA 反应迅速,室温下(15 ℃~20 ℃)瞬间达到稳定,1 h 内吸光度保持不变。试验了30 ℃和35 ℃(水浴)的反应时间及稳定性,结果表明温度影响不明显。
2.5 离子强度的影响
加入NaCl 测试了体系的离子强度,结果表明,NaCl 的浓度为0.01 mol/L,体系的吸光度提高7.6%,随着NaCl 加入量增加,吸光度又逐渐降低,当NaCl 浓度达到0.1 mol/L 吸光度提高7.6%,随着NaCl 加入量增加,吸光度又逐渐降低,当NaCl 浓度达到0.1 mol/L时,体系吸光度降低50%。离子强度的影响进一步表明对乙酰基偶氮羧与BSA 之间主要是通过静电作用结合的。
2.6 表面活性剂和有机溶剂的影响
分别试验了阳离子表面活性剂(CPB),阴离子表面活性剂(SDS),中性表面活性剂(OP、TrittonX-100),无水乙醇对体系吸光度的影响,结果表明:加入CPB、SDS,体系吸光度迅速减小,当CPB 为0.005%时,吸光度减少99.3%,SDS 为0.001%,吸光度减少27.8%;OP 对吸光度影响不大;TrittonX-100 和无水乙醇,使吸光度增加,其中TrittonX-100 加入0.1%,吸光度提高23%。实验选用0.1%的TrittonX-100。
2.7 精密度
取10 份浓度均为7.35×10-6mol/L 的BSA 溶液,按照试验方法进行平行测定,吸光度的平均值0.404,RSD0.46%。
2.8 标准曲线
在试验条件下,研究了对乙酰基偶氮羧与牛血清白蛋白(BSA)、人血清白蛋白(HSA)、卵蛋白(OVA)、溶菌酶(LYS)、酪蛋白(CAS)的响应情况,绘制相应的标准曲线列于表1。
从表1 中结果可知,灵敏度高,线性范围宽是本方法的突出优点,一向响应较低的卵蛋白也有较高的灵敏度。还具有BSA 和HSA 响应接近、酪蛋白灵敏度更高的特点。
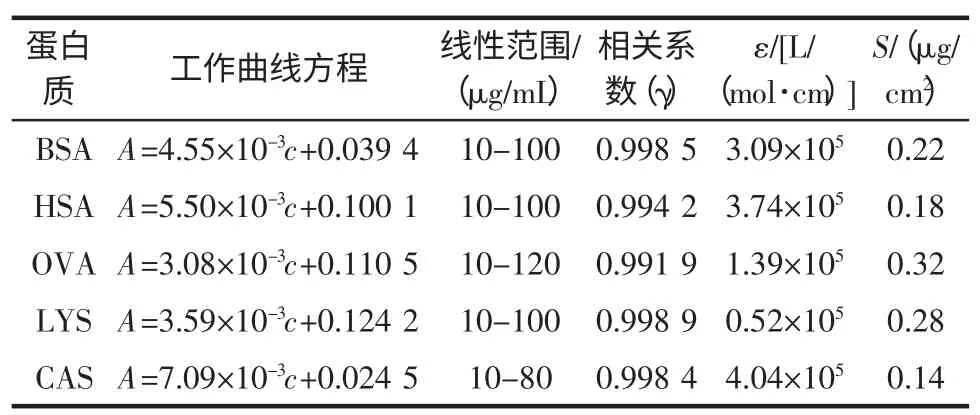
表1 蛋白质的工作曲线Table 1 Calibration curve of proteins
2.9 干扰离子的影响
用本方法对有可能干扰的一些物质,按大豆中各组分物质的实际含量进行测定[7-8],结果列于表2。
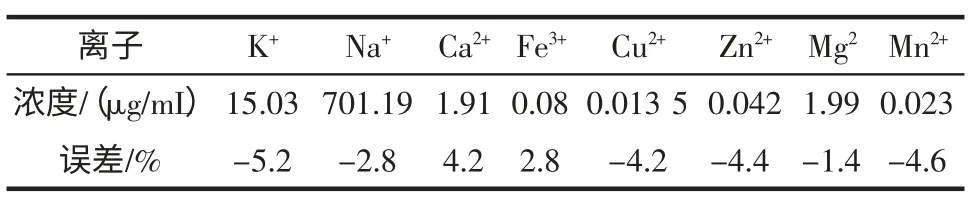
表2 干扰物质的影响Table 2 Interfering of substances
结果表明,大豆中存在的无机离子,产生的误差均在±5%以内,基本不干扰。
3 样品测定
样品制备:准确称取干豆粉(黄豆,黑豆)1 g 于60 ℃烘干,粉碎,过100 目筛,加温水10 mL 浸泡30 min,于50 ℃下搅拌50 min,于4 000 r/min 下离心分离。取5 mL上层提取液,加2 mL 四氯化碳,搅拌,离心分离,取上层液1 mL,稀释50 倍备用。
样品测定:按照试验方法,测其结果及回收率见表3。
结果表明,对乙酰基偶氮羧光度法测定豆类中可溶性蛋白含量为:黄豆0.36 mg/mL,黑豆0.38 mg/mL,回收率符合生化分析要求。

表3 样品中蛋白质测定结果(n=3)Table 3 Assay results of proteins of sample(n=3)
4 结论
在酸性条件下,有机试剂对乙酰基偶氮羧与无色的大豆蛋白及TrittonX-100 形成三元反应体系,生成蓝色多元可溶性复合物,该复合物在波长669 nm 处的表观摩尔吸光系数为3.09×105L/(mol·cm),蛋白质在10 μg/mL~100 μg/mL(BSA)范围内遵循比尔定律,以此建立了选择性及灵敏度较高的蛋白质测定新方法,用于大豆中可溶蛋白质的测定,操作简便,克服了经典方法中测定非蛋白氮的不足,为准确测定大豆水溶性蛋白质提供了一种科学安全的原理和方法。
[1]伊宗伦,王婧,涂顺明,等.“双蛋白工程”与中华民族的强盛[J].中国食品学报,2007,7(1):1-5
[2]刘志胜,李里特,辰巳英三.大豆蛋白营养品质和生理功能研究进展[J].大豆科学,2000,19(3):263-268
[3]程莉君,石雪萍,姚惠源.大豆加工利用研究进展[J].大豆科学,2007,26(5):775-780
[4]盛成乐.关于凯氏定氮法测定蛋白质的几个问题[J].中国酿造,2002(2):43-44
[5]许家喜.蛋白质的检测方法与乳制品中蛋白含量测定[J].大学化学,2009,24(1):66-69
[6]鲁秀恒,鲁金昌.大豆水溶性蛋白质快速测定方法的研究[J].食品工业科技,2006,27(6):177-178
[7]马立安,江涛.大豆的药用价值[J].食品研究与开发,2000,21(2):43-44
[8]韩立德,盖钧镒,张文明.大豆营养成分研究现状[J].种子,2003(5):57-59
