饵料中添加芽孢杆菌BC26对刺参幼参消化酶、免疫反应和抗病力的影响
2013-07-07刘姣韩华孙飞雪张丛尧曹淑青赵乃锡马悦欣
刘姣,韩华,孙飞雪,张丛尧,曹淑青,赵乃锡,马悦欣
(1.大连海洋大学农业部北方海水增养殖重点实验室,辽宁大连116023;2.大连海洋学校,辽宁大连116023)
饵料中添加芽孢杆菌BC26对刺参幼参消化酶、免疫反应和抗病力的影响
刘姣1,韩华2,孙飞雪1,张丛尧1,曹淑青1,赵乃锡1,马悦欣1
(1.大连海洋大学农业部北方海水增养殖重点实验室,辽宁大连116023;2.大连海洋学校,辽宁大连116023)
将浓度为105、107、109CFU/g(饵料)的芽孢杆菌BC26添加到基础饵料中,用每一浓度的饵料投喂一组刺参幼参(1.374 g±0.558 g),对照组投喂基础饵料,每组均设3个平行,试验在12个盛有100 L过滤海水的塑料桶中进行,每桶放50头幼参,饲养试验共进行45 d。试验结束后,分析芽孢杆菌BC26对幼参肠道消化酶活力、免疫反应和抗病力的影响。结果表明:投喂芽孢杆菌BC26饵料的各组幼参肠道中的胰蛋白酶、脂肪酶活力,以及体腔液中的酚氧化酶、总一氧化氮合酶活力均极显著高于对照组(P<0.01);投喂浓度为107、109CFU/g(饵料)的芽孢杆菌BC26组幼参体腔细胞的吞噬活力极显著高于对照组(P<0.01);用病原菌灿烂弧菌NB13攻毒各组幼参,投喂芽孢杆菌BC26组的幼参发病率和死亡率明显低于对照组。研究表明,饵料中添加芽孢杆菌BC26可促进刺参消化和增强免疫功能,并提高其抗病力。
刺参;芽孢杆菌BC26;消化酶;免疫反应
刺参Apostichopus japonicus隶属于棘皮动物门、海参纲,又名仿刺参,是中国北方地区重要的海珍品养殖种类。随着其养殖密度的迅速增加,刺参传染性疾病经常发生,如稚参培育阶段的细菌性溃烂病,幼参培育、养成阶段的皮肤溃烂病和急性口围肿胀症等,给刺参养殖业造成巨大的经济损失,限制了该产业的可持续发展[1-5]。近年来,环境友好的生物控制疾病方法(如饲喂益生菌)已成为水产养殖研究的重要课题,Qi等[6]对水产养殖中有关益生菌种类、效果、机制的研究应用以及存在的问题进行了详细的综述。益生菌在刺参养殖业中的应用已受到国内一些学者的关注,张涛等[7]将从刺参肠道中分离的乳酸菌L-2和芽孢杆菌K-3混合添加到饵料中养殖刺参,发现幼参肠道蛋白酶和淀粉酶活力明显提高。Zhao等[8]发现,用添加枯草芽孢杆菌T13的饵料饲养刺参,幼参的体腔细胞吞噬作用、呼吸爆发活力、总一氧化氮合酶活力和抗病力均显著提高。Ma等[9]和Liu等[10]将从野生刺参肠道中分离的仙人掌有孢汉逊酵母C21和梅奇酵母C14[11]分别添加到饵料中投喂刺参,结果均可刺激幼参的免疫反应,提高其抗病力。杨志平等[12]从健康刺参肠道中筛选出潜在产酶益生菌芽孢杆菌BC26,本研究中,笔者用保存在农业部北方海水增养殖重点实验室的该菌株对幼参进行了消化酶活力、免疫反应和抗病力影响的试验,旨在为BC26菌株在刺参养殖中的应用提供参考。
1 材料与方法
1.1 材料
试验用健康幼参购买于大连某刺参养殖场。试验用基础饵料配方同文献 [12]。
1.2 方法
1.2.1 含菌饵料的制备与试验设计 将芽孢杆菌BC26种子接种于胰蛋白胨大豆肉汤(TSB)培养基中,于25℃下振荡培养16 h,将菌悬液以4 500 r/min离心15 min,细胞用生理盐水重悬,平板菌落计数,再将细胞悬液添加到刺参基础饵料中,制成浓度为105、107、109CFU/g(饵料)的含菌饵料。
将刺参幼参在水温约14℃的条件下暂养2周后开始正式试验。选择大小为(1.374±0.558)g的健康幼参随机分配到12个盛有100 L过滤海水的塑料桶中,每桶放50头幼参,用3个浓度的含菌饵料和基础饵料分别投喂一组刺参幼参,每组均设3个平行,每日投喂一次,投喂量为刺参体质量的5%,每2天换水1/2,并吸底去除残饵及粪便。试验期间,温度为7~14℃,pH为7.8~8.2,盐度为33~34。
1.2.2 指标的测定与计算
1)肠道消化酶活力。将刺参幼参养殖45 d后,从每桶随机取5头移至仅有海水的桶中16 h,以便幼参将肠道内容物排空。解剖取其肠道,用滤纸吸干,称重后以9倍体积的冰冷生理盐水匀浆,在4℃下以6 000 r/min离心10 min,取上清液备用。
依据Holm等[13]的方法,使用南京建成科技有限公司胰蛋白酶试剂盒测定胰蛋白酶活力。胰蛋白酶活力单位定义为:在pH 8.0、37℃条件下,每毫克蛋白中含有的胰蛋白酶每分钟使吸光度变化0.003即为一个酶活力单位(U)。依据 Shihabi等[14]的方法,使用南京建成科技有限公司脂肪酶试剂盒测定脂肪酶活力。脂肪酶活力单位定义为:在37℃条件下,每克组织蛋白在本反应体系中与底物反应1 min,每消耗1 μmol底物为一个酶活力单位(U)。
2)免疫指标。幼参养殖45 d后,先饥饿16 h,从每桶随机取5头幼参,以灭菌海水冲洗幼参体表,解剖取其体腔液500 μL,加入至盛有等体积抗凝剂(0.02 mol/L EGTA,0.34 mol/L NaCl, 0.019 mol/L KCl,0.068 mol/L Tris-HCl,pH 8.0)[15]的离心管中,混合均匀后,取300 μL用于吞噬试验,剩余的体腔液在6 000 r/min下离心10 min,取上清液,用于测定酚氧化酶和总一氧化氮合酶活力。
依据Hannam等[16]的方法,通过测定中性红染过的酿酒酵母颗粒确定体腔细胞的吞噬活力,体腔细胞对酵母颗粒的吞噬吸收通过标准曲线计算,以50 μL样品中每毫克蛋白吞噬的酵母细胞数量表示吞噬活力。根据 Smith等[17]的方法,测定酚氧化酶活力,以L-dopa为底物,胰蛋白酶为诱导因子。将50 μL待测样品和50 μL CAC缓冲液(含有0.1%的胰蛋白酶)混匀后在25℃下孵育10 min,然后加入100 μL L-dopa(3 mg/mL)混匀,读取490 nm处的吸光值。酚氧化酶活力单位定义为:在试验条件下,每分钟 OD490nm值增加0.001为一个酶活力单位(U)。使用南京建成科技有限公司总一氧化氮合酶试剂盒测定总一氧化氮合酶活力,总一氧化氮合酶活力单位定义为:每毫升体腔液每分钟生成1 nmol NO为一个酶活力单位(U)。
1.2.3 蛋白含量的测定及攻毒试验 采用考马斯亮蓝法,以牛血清白蛋白为标准[18],测定幼参肠道匀浆液上清液、体腔液中总蛋白的含量。
饲养试验结束后,从每组分别取10头幼参进行攻毒试验,对每头幼参注射灿烂弧菌NB13菌株0.1 mL(密度为107CFU/mL),该菌株是幼参急性口围肿胀症的病原菌[2],观察并记录幼参被攻毒后一个月中的发病和死亡情况。
1.3 数据处理
试验数据均用平均值±S.D.表示,用 SPSS 19.0软件进行单因素方差分析(One-way ANOVA),用Dunncan法进行多重比较,显著性水平设为0.05。
2 结果
2.1 芽孢杆菌BC26对刺参幼参肠道消化酶活力的影响
从表1可见,试验结束后,投喂芽孢杆菌BC26的各组幼参肠道的胰蛋白酶和脂肪酶活力均较对照组极显著提高(P<0.01),说明添加该菌能增强幼参肠道消化酶的活力,从而促进幼参对食物中蛋白质和脂肪的消化利用。
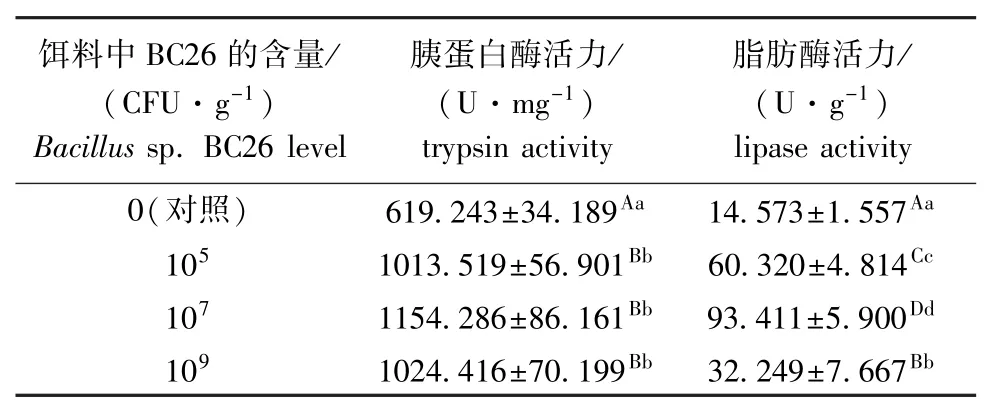
表1 芽孢杆菌BC26对幼参肠道胰蛋白酶和脂肪酶活力的影响(n=3)Tab.1 Effects of dietary Bacillus sp.BC26 on activities of trypsin and lipase in intestine of sea cucumber Apostichopus japonicus(n=3)
2.2 芽孢杆菌BC26对刺参幼参免疫指标的影响
从表2可见:试验结束后,投喂浓度为107和109CFU/g(饵料)芽孢杆菌BC26的试验组幼参的体腔细胞的吞噬活力均极显著高于对照组(P<0.01);投喂芽孢杆菌BC26的各组幼参体腔液中酚氧化酶活力和总一氧化氮合酶活力均极显著高于对照组(P<0.01)。
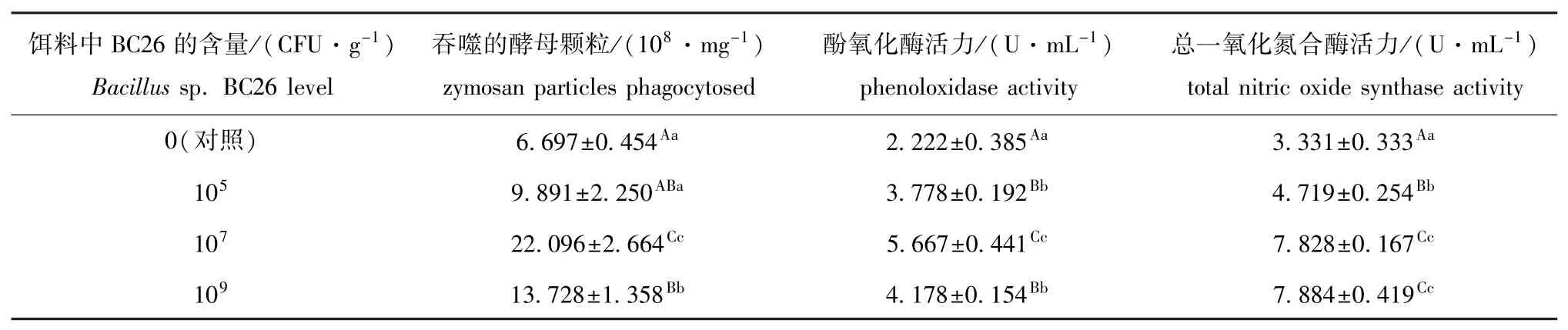
表2 芽孢杆菌BC26对幼参体腔细胞的吞噬活力以及体腔液中酚氧化酶和总一氧化氮合酶活力的影响(n=3)Tab.2 Effects of dietary Bacillus sp.BC26 on phagocytic activity of coelomocytes,and activities of phenoloxidase and total nitric oxide synthase in coelomic fiuid of sea cucumber Apostichopus japonicus(n=3)
2.3 芽孢杆菌BC26对刺参幼参抗灿烂弧菌NB13感染能力的影响
攻毒试验结果表明,饵料中添加芽孢杆菌BC26可提高幼参抗灿烂弧菌 NB13感染的能力(表3),用灿烂弧菌NB13攻毒后的一个月内,对照组幼参的发病率为70%,死亡率为30%,而投喂添加芽孢杆菌BC26饵料的试验组幼参发病率仅为10%,且无死亡现象。

表3 用灿烂弧菌NB13攻毒后各组幼参的累计发病率和死亡率Tab.3 Cumulative incidence and mortality of sea cucumber Apostichopus japonicus challenged with Vibrio splendidus NB13 in each group
3 讨论
适宜浓度的益生菌在水生动物的消化过程中起着有益的作用。Liu等[19]用添加产蛋白酶益生菌枯草芽孢杆菌E20[108CFU/kg(饵料)]的饵料投喂凡纳滨对虾,对虾肠道及内含物中的蛋白酶活力显著增加。本试验中,用添加不同浓度芽孢杆菌BC26的饵料投喂幼参后,幼参肠道胰蛋白酶和脂肪酶活力均显著提高,不过很难区分是由刺参合成的酶还是由细菌合成的酶,因为芽孢杆菌BC26可分泌胞外蛋白酶和脂肪酶[12,20]。另外,不同浓度的芽孢杆菌BC26对脂肪酶活力的影响也不同,其中添加107CFU/g(饵料)的芽孢杆菌BC26时效果最佳。
一般认为,刺参缺乏适应性免疫,完全依赖其先天性免疫来防御外来物质。近年来,免疫刺激剂和益生菌等能增强宿主免疫力和抗病力的制品正被应用于刺参疾病的预防中[8-10,21-22]。 本研究证明,添加芽孢杆菌BC26的饵料对幼参具有免疫刺激效果。体腔细胞是棘皮动物抵御感染和损伤的第一道防线,起着吞噬、诱捕和包裹入侵微生物的作用[23]。Zhao等[8]和Zhang等[21]分别用添加内源枯草芽孢杆菌T13[109CFU/g(饵料)]的饵料投喂刺参30 d,用添加外源枯草芽孢杆菌 [107CFU/g(饵料)]的饵料投喂刺参56 d,均提高了刺参体腔细胞的吞噬活力。本试验中,用添加芽孢杆菌BC26[107、109CFU/g(饵料)]的饵料投喂幼参45 d后,其体腔细胞的吞噬活力显著增强。类似的报道还有:用添加枯草芽孢杆菌E20[108CFU/kg(饵料)]的饵料投喂凡纳滨对虾98 d[24]和用添加芽孢杆菌S11[约1010CFU/g(饵料)]的饵料投喂斑节对虾60 d后[25],对虾血细胞的吞噬活力均显著增强;用添加枯草芽孢杆菌AB1[107cells/g(饵料)][26]和芽孢杆菌 JB-1[108cells/g(饵料)][27]分别投喂虹鳟14 d后,其头肾白细胞的吞噬活力均显著提高。
酚氧化酶系统是无脊椎动物免疫防御的重要组成部分。给斑节对虾和凡纳滨对虾分别投喂芽孢杆菌S11[约1010CFU/g(饵料)][25]和枯草芽孢杆菌E20[108CFU/kg(饵料)][24]的饵料,其血细胞裂解液上清液中酚氧化酶活力明显增加。Canicatti等[28]研究发现,在刺参体腔细胞裂解液中酚氧化酶以酶原形式存在,外源的胰蛋白酶可激活酚氧化酶活力,在寄生虫封入过程中,酚氧化酶负责黑色素沉积。本研究中,用添加芽孢杆菌 BC26 [107、109CFU/g(饵料)]的饵料投喂幼参45 d后,其体腔液的酚氧化酶活力明显提高,这可能是酚氧化酶从体腔细胞分泌到胞外的缘故。Li等[29]也有类似的发现,给凡纳滨对虾投喂含芽孢杆菌OJ[1010CFU/g(饵料)]的饵料28 d后,其血清中的酚氧化酶活力显著高于对照组。
软体动物和甲壳动物血细胞中存在一氧化氮合酶[30-32]。由一氧化氮合酶催化L-精氨酸与氧分子经多步氧化还原反应生成一氧化氮,软体动物和甲壳动物免疫细胞利用一氧化氮作为杀细菌分子[32-33],刺参体腔细胞裂解液的高一氧化氮合酶活力可以由枯草芽孢杆菌 T13[109CFU/g(饵料),30 d]诱导产生[8]。本研究表明,投喂含芽孢杆菌BC26的饵料45 d后,幼参体腔液的一氧化氮合酶活力明显增加。
已有资料证明,饵料中添加芽孢杆菌能通过刺激细胞和体液免疫功能提高对虾[24-25,29,34]和鱼[26-27]对病原细菌或病毒的抵抗力。本研究结果表明,口服芽孢杆菌BC26可以降低刺参幼参被灿烂弧菌NB13攻毒后的累计死亡率,这可能是刺参细胞免疫和体液免疫反应增强的缘故。
[1]马悦欣,徐高蓉,常亚青,等.大连地区刺参幼参溃烂病细菌性病原的初步研究[J].大连水产学院学报,2006,21(1):13-17.
[2]马悦欣,徐高蓉,张恩鹏,等.仿刺参幼参急性口围肿胀症的细菌性病原[J].水产学报,2006,30(3):378-382.
[3]王印庚,荣小军,张春云,等.养殖海参主要疾病及防治技术[J].海洋科学,2005,29(3):1-7.
[4]Deng H,He C B,Zhou Z C,et al.Isolation and pathogenicity of pathogens from skin ulceration disease and viscera ejection syndrome of the sea cucumber Apostichopus japonicus[J].Aquaculture,2009,287:18-27.
[5]Li H,Qiao G,Li Q,et al.Biological characteristics and pathogenicity of a highly pathogenic Shewanella marisflavi infected sea cucumber(Apostichopus japonicus)[J].Journal of Fish Disease, 2010,33:865-877.
[6]Qi Z Z,Zhang X H,Boon N,et al.Probiotics in aquaculture of China-current state,problems and prospect[J].Aquaculture,2009, 290:15-21.
[7]张涛,白岚,李蕾,等.不同添加量的益生菌组合对仿刺参消化和免疫指标的影响[J].大连水产学院学报,2009,24(增刊): 64-68.
[8]Zhao Y C,Zhang W B,Xu W,et al.Effects of potential probiotic Bacillus subtilis T13 on growth,immunity and disease resistance against Vibrio splendidus infection in juvenile sea cucumber Apostichopus japonicus[J].Fish and Shellfish Immunology,2012,32: 750-755.
[9]Ma Y X,Liu Z M,Yang Z P,et al.Effects of dietary live yeast Hanseniaspora opuntiae C21 on the immune and disease resistance against Vibrio splendidus infection in juvenile sea cucumber Apostichopus japonicus[J].Fish and Shellfish Immunology,2013,34: 66-73.
[10]Liu Z M,Ma Y X,Yang Z P,et al.Immune responses and disease resistance of the juvenile sea cucumber Apostichopus japonicus induced by Metschnikowia sp.C14[J].Aquaculture,2012,368: 10-18.
[11]李明,马悦欣,刘志明,等.刺参机体酵母菌组成及其拮抗活性的研究[J].大连海洋大学学报,2012,27(5):436-440.
[12]杨志平,孙飞雪,刘志明,等.刺参肠道潜在产酶益生菌的筛选和鉴定[J].大连海洋大学学报,2013,28(1):17-20.
[13]Holm H,Hanssen L E,Krogdahl A,et al.High and low inhibitor soybean meals affect human duodenal proteinase activity differently:in vivo comparison with bovine serum albumin[J].Journal of Nutrition,1988,118:515-520.
[14]Shihabi Z K,Bishop C.Simplified turbidimetric assay for lipase activity[J].Clinical Chemistry,1971,17:1150-1153.
[15]Xing J,Leung M F,Chia F S.Quantitative analysis of phagocytosis by amebocytes of a sea cucumber,Holothuria leucospilota[J].Invertebrate Biology,1998,117:67-74.
[16]Hannam M L,Bamber S D,Moody J A,et al.Immunotoxicity and oxidative stress in the Arctic scallop Chlamys islandica:effects of acute oil exposure[J].Ecotoxicology and Environmental Safety, 2010,73:1440-1448.
[17]Smith V J,Söderhöll K.A comparison of phenoloxidase activity in the blood of marine invertebrates[J].Developmental and Comparative Immunology,1991,15:251-261.
[18]Bradford M M.A rapid and sensitive method for the quantification of microgram quantities of protein utilizing the principle of protein-dye binding[J].Analytical Biochemistry,1976,72:248-254.
[19]Liu C H,Chiu C S,Ho P L,et al.Improvement in the growth performance of white shrimp,Litopenaeus vannamei,by a proteaseproducing probiotic,Bacillus subtilis E20,from natto[J].Journal of Applied Microbiology,2009,107:1031-1041.
[20]Ziaei-Nejad S,Rezaei M H,Takami G A,et al.The effect of Bacillus spp.bacteria used as probiotics on digestive enzyme activity,survival and growth in the Indian white shrimp Fenneropenaeus indicus[J].Aquaculture,2006,252:516-524.
[21]Zhang Q,Ma H,Mai K S,et al.Interaction of dietary Bacillus subtilis and fructooligosaccharide on the growth performance,non-specific immunity of sea cucumber,Apostichopus japonicus[J]. Fish and Shellfish Immunology,2010,29:204-211.
[22]Zhao Y C,Ma H M,Zhang W B,et al.Effects of dietary β-glucan on the growth,immune responses and resistance of sea cucumber, Apostichopus japonicus against Vibrio splendidus infection[J].Aquaculture,2011,315:269-274.
[23]Gliński Z,Jarosz J.Immune phenomena in echinoderms[J].Archivum Immunologiae et Therapiae Experimentalis(Warszawa), 2000,48(3):189-193.
[24]Tseng D Y,Ho P L,Huang S Y,et al.Enhancement of immunity and disease resistance in the white shrimp,Litopenaeus vannamei, by the probiotic,Bacillus subtilis E20[J].Fish and Shellfish Immunology,2009,26:339-344.
[25]Rengpipat S,Rukpratanporn S,Piyatiratitivorakul S,et al.Immunity enhancement in black tiger shrimp(Penaeus monodon)by a probiont bacterium(Bacillus S11)[J].Aquaculture,2000,191: 271-288.
[26]Newaj-Fyzul A,Adesiyun A A,Mutani A,et al.Bacillus subtilis AB1 controls Aeromonas infection in rainbow trout(Oncorhynchus mykiss,Walbaum)[J].Journal of Applied Microbiology,2007, 103:1699-1706.
[27]Brunt J,Newaj-Fyzul A,Austin B.The development of probiotics for the control of multiple bacterial diseases of rainbow trout,Oncorhynchus mykiss(Walbaum)[J].Journal of Fish Disease, 2007,30:573-579.
[28]Canicatti C,Seymour J.Evidence for phenoloxidase activity in Holothuria tubulosa(Echinodermata)brown bodies and cells[J]. Parasitology Research,1991,77:50-53.
[29]Li J,Tan B,Mai K.Dietary probiotic Bacillus OJ and isomaltooligosaccharides influence the intestine microbial populations,immune responses and resistance to white spot syndrome virus in shrimp(Litopenaeus vannamei)[J].Aquaculture,2009,291(1/ 2):35-40.
[30]Conte A,Ottaviani E.Nitric oxide synthase activity in molluscan hemocytes[J].FEBS Letters,1995,365:120-124.
[31]Novas A,Cao A,Barcia R,et al.Nitric oxide release by hemocytes of the mussel Mytilus galloprovincialis Lmk was provoked by interleukin-2 but not by lipopolysaccharide[J].The International Journal of Biochemistry and Cell Biology,2004,36:390-394.
[32]Yeh F C,Wu S H,Lai C Y,et al.Demonstration of nitric oxide synthase activity in crustacean hemocytes and antimicrobial activity of hemocyte-derived nitric oxide[J].Comparative Biochemistry and Physiology Part B,2006,144:11-17.
[33]Ottaviani E,Paemen L R,Cadet P,et al.Evidence for nitric oxide production and utilization as a bacteriocidal agent by invertebrate immunocytes[J].European Journal of Pharmacology,1993,248: 319-324.
[34]Balcázar J L,Rojas-Luna T,Cunningham D P.Effect of the addition of four potential probiotic strains on the survival of Pacific white shrimp(Litopenaeus vannamei)following immersion challenge with Vibrio parahaemolyticus[J].Journal of Invertebrate Pathology,2007,96:147-150.
Effects of dietary live Bacillus sp.BC26 on digestive enzyme activity, immune response and disease resistance against Vibrio splendidus infection in juvenile sea cucumber Apostichopus japonicus
LIU Jiao1,HAN Hua2,SUN Fei-xue1,ZHANG Cong-yao1,CAO Shu-qing1,ZHAO Nai-xi1,MA Yue-xin1
(1.Key Laboratory of Mariculture&Stock Enhancement in North China's Sea,Ministry of Agriculture,Dalian Ocean University,Dalian 116023, China;2.Dalian Ocean School,Dalian 116023,China)
Juvenile sea cucumber Apostichopus japonicus was randomly divided into 12 plastic tanks of each filled with 100 L filtered sea water at a rate of 50 individuals per tank and fed basal diet(control group)and the basal diets containing bacterium Bacillus sp.BC26 at a dose of 105,107and 109CFU/g diet for 45 d with triplication. At the end of the feeding trial,effects of Bacillus sp.BC26 on digestive enzyme activity,immune response and disease resistance against Vibrio splendidus infection were studied in the sea cucumber fed the various diets.Results showed that there were significantly higher trypsin and lipase activities in the intestine,and phenoloxidase and total nitric oxide synthase activities in the coelomic fluid in the sea cucumber in the experimental groups than those in the control group(P<0.01).The sea cucumber fed the diet containing Bacillus sp.BC26 at 107and 109CFU/g diet had significantly higher phagocytic activity than the sea cucumber in the control group(P<0.01).Cumulative incidence and mortality of the sea cucumber fed the Bacillus sp.BC26 were found to be lower than those in the control group when 10 sea cucumber samples in each group were challenged with V.splendidus NB13.The findings show the supplementation of Bacillus sp.BC26 lead to improvement of digestive enzyme activity and the immune response of the sea cucumber juveniles,thus enhancing their resistance against V.splendidus.
Apostichopus japonicus;Bacillus sp.BC26;digestive enzyme;immune response
Q939.1;S968.9
A
2013-03-26
国家 “863”计划重大项目(2012AA10A412)
刘姣(1989-),女,硕士研究生。E-mail:jiaojiao.123.456@163.com
马悦欣(1963-),女,教授。E-mail:mayuexin@dlou.edu.cn
2095-1388(2013)06-0568-05
