响应面试验设计优化鲢鱼鳞胶原蛋白抗氧化活性肽的制备条件
2013-07-07陈日春郑宝东
陈日春,郑宝东
(1.福建农林大学食品科学学院,福建福州350002;2.福州市食品工业研究所,福建福州350013)
响应面试验设计优化鲢鱼鳞胶原蛋白抗氧化活性肽的制备条件
陈日春1、2,郑宝东1
(1.福建农林大学食品科学学院,福建福州350002;2.福州市食品工业研究所,福建福州350013)
采用酶解法制备抗氧化活性肽,研究了鲢鱼鳞胶原蛋白抗氧化活性肽制备的优化条件。以水解度(DH)、DPPH·、超氧阴离子和羟基(·OH)自由基清除率为指标,比较碱性蛋白酶、中性蛋白酶和木瓜蛋白酶对鲢鱼鳞胶原蛋白的酶解效果及酶解产物的抗氧化活性。结果表明:碱性蛋白酶酶解产物的抗氧化活性最强,对DPPH·、和·OH自由基的清除率分别为76.9%、43.1%和58.2%;采用响应面试验设计优化碱性蛋白酶制备鲢鱼鳞胶原蛋白抗氧化活性肽的条件,得到最优的制备条件为底物浓度5.47%,酶解时间4.24 h,酶添加量4 200 U/g,在此条件下,所得抗氧化肽对DPPH·、和·OH的清除率分别为79.6%、46.3%和63.5%。
鲢鱼鳞;胶原蛋白;抗氧化活性肽;碱性蛋白酶;响应面设计
鱼类加工副产物是低值资源,采用酶解技术将副产物转化成有使用价值的产品被广泛应用于食品领域[1-2]。由自由基媒介作用导致的食品氧化,不仅会引起食品产生不正常的气味,而且是导致食用者心血管病发生的重要原因[3],因此,丁基羟基茴香醚(BHA)和二丁基羟基甲苯(BHT)等合成抗氧化物质已被广泛用于食品的储藏中。但合成抗氧化物质在食品中的用量和应用范围是被严格限制的,所以寻找天然安全高效的抗氧化物质已成为研究的热点[4]。胶原蛋白在鱼皮、鱼鳞、鱼骨等鱼类加工副产物中含量非常丰富。目前,国内外利用鱼皮胶原蛋白制备抗氧化活性肽的报道很多,如鲤鱼皮、 鳕鱼皮[5]、 鱿鱼皮[6]、 皮氏叫姑鱼皮[7]、鲮鱼皮[8]、 金枪鱼皮[9]、 三文鱼皮[10]、 河豚鱼皮[11]等胶原蛋白抗氧化肽,也有少量利用鱼鳞制备抗氧化活性肽的报道,如鲤鱼鳞[12]、罗非鱼鱼鳞[13]和草鱼鱼鳞[14]胶原蛋白抗氧化肽。本研究中以鲢鱼鳞胶原蛋白为原料,以水解度(DH)、DP-PH·、超氧阴离子和羟基(·OH)自由基清除率为试验指标,筛选鱼鳞胶原蛋白的水解酶,继而采用响应面试验设计对酶解条件进行优化,获得优化的抗氧化肽制备条件。
1 材料与方法
1.1 材料
试验用鲢鱼鳞收集于福州市华林永辉超市。
主要试剂:胃蛋白酶、氯化硝基四氮唑蓝、烟酰胺腺嘌呤二核苷酸、吩嗪硫酸甲酯和透析袋(截留蛋白相对分子质量10 000)由上海源聚生物科技有限公司提供;L-羟脯氨酸由国药集团上海化学试剂有限公司提供;碱性蛋白酶、木瓜蛋白酶和中性蛋白酶由南宁庞博生物工程有限公司提供; 1,10-菲啰啉和1,1-二苯基-2-苦基肼(DPPH)由中科瑞泰(北京)生物科技有限公司提供;其他化学试剂均为分析纯。
主要仪器:XMTD-8222自动恒温振荡器(上海精宏试验室设备有限公司产品);UV-1600紫外可见分光光度计(上海美谱达仪器有限公司产品)。
1.2.1 鲢鱼鳞胶原蛋白肽的制备流程 鱼鳞除杂→清洗→晾干(含水量为17%)→EDTA溶液浸泡脱钙(料液比为1 g∶30 L,EDTA浓度为0.17 mol/L,浸泡时间为30 h)→清洗至中性→氢氧化钠溶液浸泡脱杂蛋白(料液比为1 g∶8 L,氢氧化钠溶液浓度为0.1 mol/L,浸泡时间为6 h)→酶法提取胶原蛋白 [料液比为1 g∶18 L,胃蛋白酶添加量为25.51 U/mg,提取时间为61.9 h→300目滤布过滤→滤液→盐析(0.9 mol/L氯化钠,盐析24 h)→离心(16 000 g,15 min)]→透析袋中透析24 h→冻干→胶原蛋白→酶解制备胶原蛋白肽。
根据酶的最适作用条件,在温度为50℃,底物浓度为3.5%,酶添加量为5 000 U/g的酶解条件下,分别考察碱性蛋白酶(pH为8.0)、中性蛋白酶(pH为7.0)和木瓜蛋白酶(pH为6.5)对胶原蛋白水解度的影响以及酶解产物对DPPH·、和·OH自由基的清除活性,依据水解度对抗氧化活性的影响关系,筛选出最佳的水解用酶。
1.2.2 水解度的测定 按GB/T 5009.39-2003甲醛滴定法[15]进行测定,计算公式为

其中:DH为水解度;A1为水解后氨基态氮的含量;A0为水解前氨基态氮的含量;A为样品总氮的含量。
参照Wang等[17]的方法稍加改进,测定自由基的清除活性。取1 mL样品溶液置于试管中,加入 1 mL氯化硝基四氮唑蓝(NBT,2.52 mmol/L)和1 mL烟酰胺腺嘌呤二核苷酸(624 mmol/L),添加1 mL吩嗪硫酸甲酯溶液(PMS, 120 μmol/L)启动反应,于25℃下反应5 min后测量产物在560 nm处的吸光度,同时以蒸馏水代替样品液作空白对照。
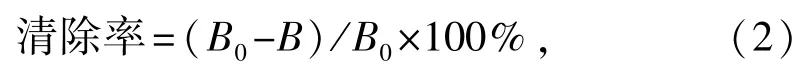
其中:B0为空白对照吸光度;B为样品吸光度。样品液对·OH自由基清除活性的计算公式为
基于此论文中提出了一种磁敏感的低频、高灵敏加速度传感装置,应用永磁体作为加速度传感装置的质量块,以提供稳定的梯度磁场。固定位置的磁传感器用于检测距永磁体一定远处的磁场强度。采用PDMS柔性材料制备成薄膜对质量块起到支撑的作用。PDMS薄膜柔韧性强、易于制备,且可以根据传感装置的需要,制备出对应参数的薄膜。论文提出的传感装置结构简单,不需要复杂的加工工艺。其固有频率为10 Hz,可以实现对低频振动信号的检测,灵敏度达到4.68 Gauss/gn,且可实现8.57 μgn的检测分辨。

其中:C为样品吸光度;C1为阴性对照吸光度; C0为空白对照吸光度。
1.2.4 鲢鱼鳞胶原蛋白肽制备条件的优化设计
以DPPH·自由基清除率为主要考察指标,采用响应面试验设计对最佳水解用酶的酶解胶原蛋白制备抗氧化活性肽的条件进行优化。
1.3 数据处理
采用DPS 7.05和Design Expert 8.05软件对试验结果进行分析,用Tukey法进行组间比较,显著性水平设为0.05。所有试验均设3个平行,试验结果以平均值±S.D.表示。
2 结果与讨论
2.1 蛋白酶酶解试验
2.1.1 酶解时间对胶原蛋白水解度的影响 从图1可见:酶解时间对3种蛋白酶酶解产物水解度的影响趋势基本一致,在酶解开始2 h内,水解度增加较快,水解度随酶解时间而增加;2 h后,水解度变化不明显;5.0 h时,碱性蛋白酶、木瓜蛋白酶、中性蛋白酶酶解产物的水解度均达到最大,分别为31.8%、27.2%、24.2%。多重比较结果表明,酶解时间为5.0时,碱性蛋白酶酶解产物的水解度显著高于木瓜蛋白酶、中性蛋白酶酶解产物(P<0.05),而木瓜蛋白酶与中性蛋白酶酶解产物的水解度之间无显著性差异(P>0.05)。

图1 酶解时间对水解度的影响Fig.1 Effect of enzymatic times on the degree of hydrolysis(DH)
2.1.2 酶解时间对胶原蛋白肽抗氧化活性的影响
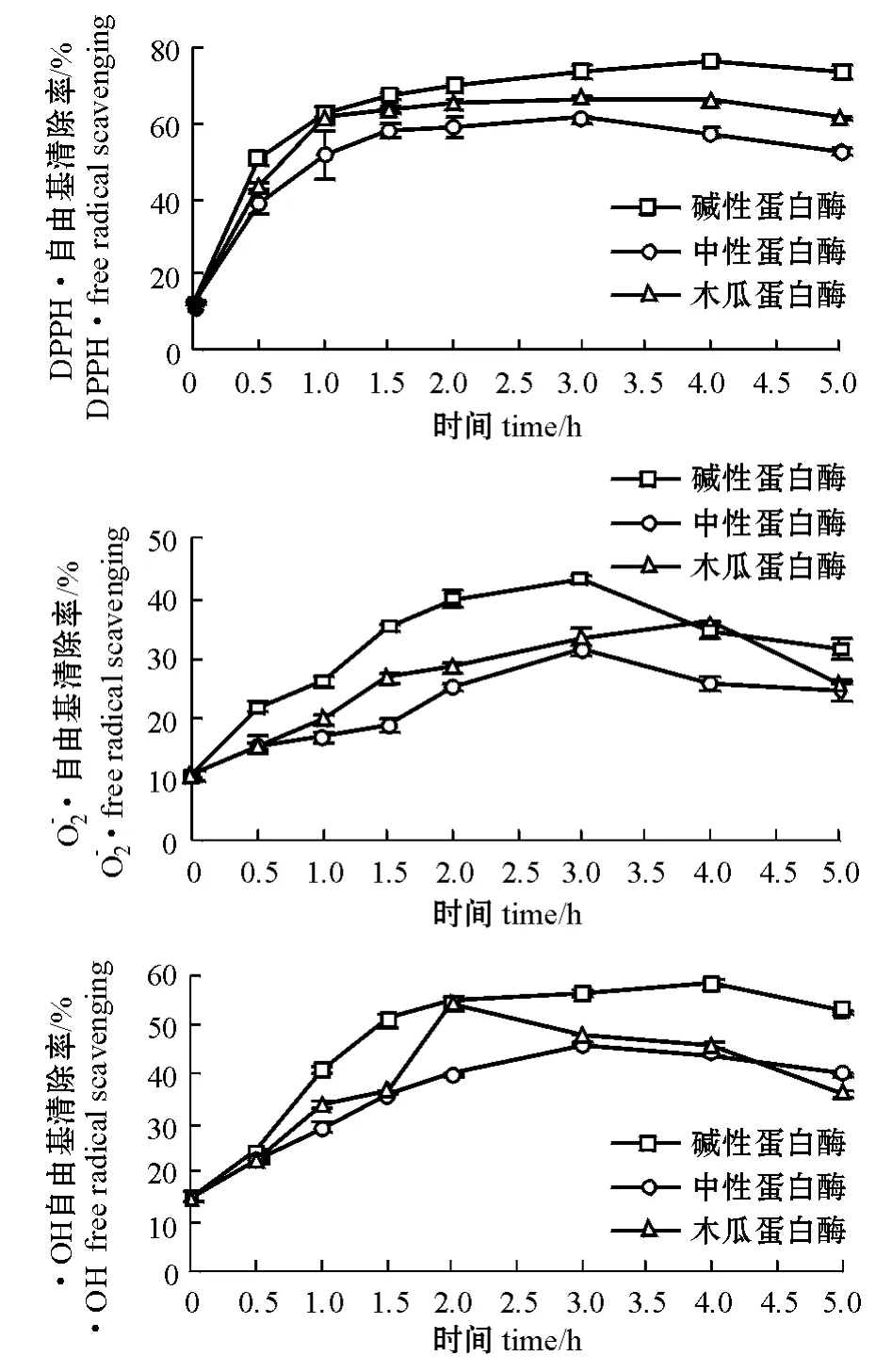
图2 酶解时间对DPPH·、和·OH 自由基清除率的影响Fig. 2 Effects of enzymatic time on DPPH ·,, and·OH free radical scavenging
碱性蛋白酶、木瓜蛋白酶和中性蛋白酶酶解产物对DPPH·自由基的清除率分别在酶解时间为4、3、3 h时最高,分别为74.9%、66.8%和61.1%(图2)。多重比较结果表明,3种蛋白酶酶解产物对DPPH·自由基的最高清除率之间存在显著性差异(P<0.05)。
碱性蛋白酶、木瓜蛋白酶和中性蛋白酶酶解产物对·OH自由基的清除率分别在酶解时间为4、2、 3 h时最高,分别为58.2%、53.8%和45.8%(图2)。多重比较结果表明,3种蛋白酶酶解产物对·OH自由基的最高清除率之间存在显著性差异(P<0.05)。
根据上述单酶酶解试验结果,确定碱性蛋白酶为酶解鲢鱼鳞胶原蛋白制备抗氧化活性肽的最佳用酶。
2.2 胶原蛋白抗氧化活性肽制备条件的优化
2.2.1 响应面试验设计 以DPPH·自由基清除率(y)为主要试验指标,对碱性蛋白酶酶解鲢鱼鳞胶原蛋白制备抗氧化肽的条件进行优化,响应面优化试验设计方案与试验结果见表1、表2。
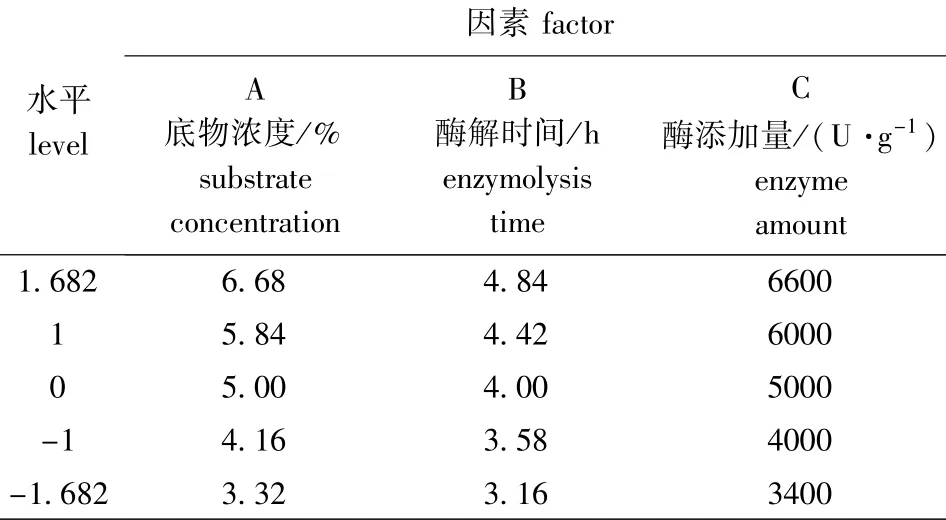
表1 试验因素水平Tab.1 Factors and levels in the experiment
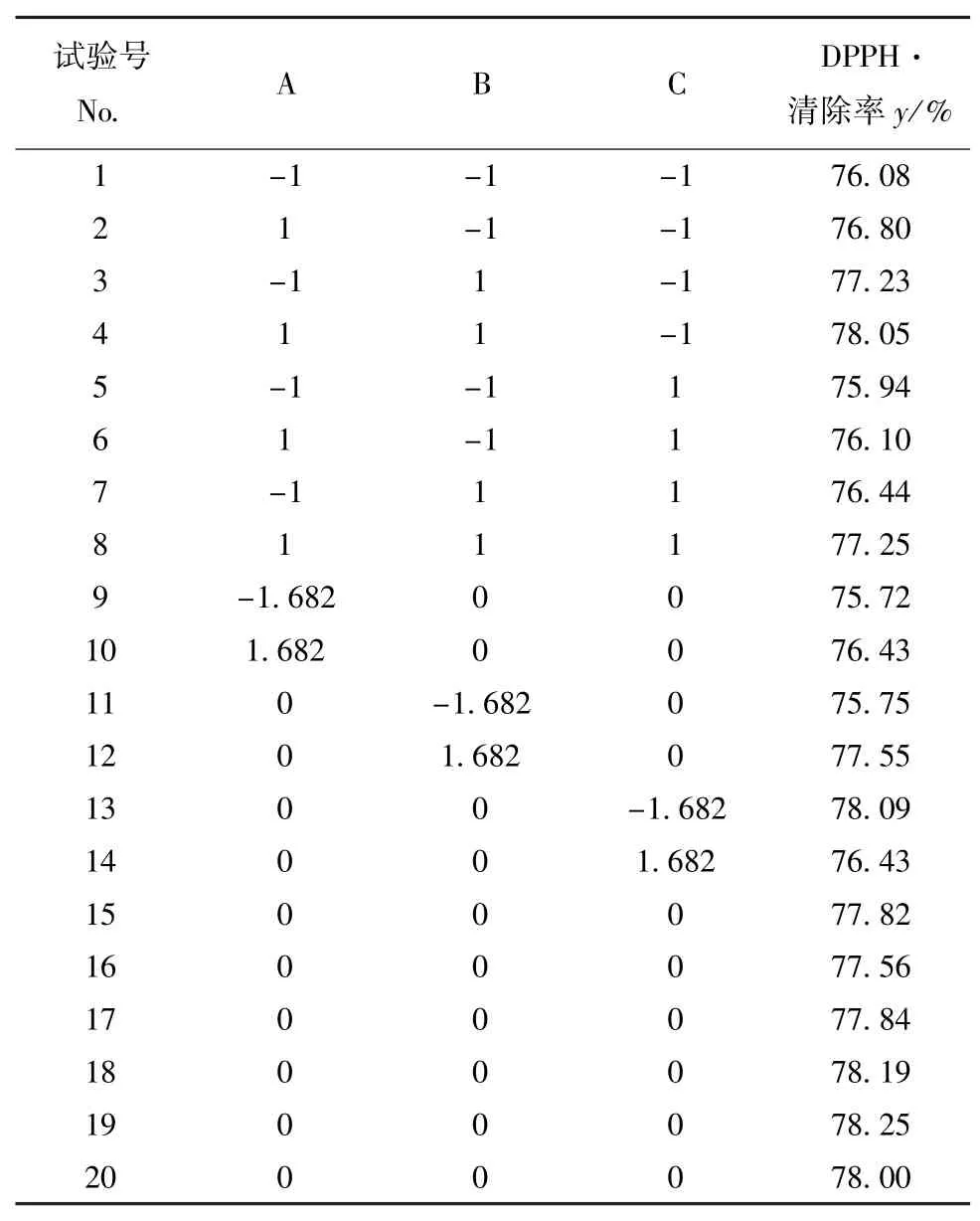
表2 响应面试验设计与结果Tab.2 The response surface experimental designs and results
2.2.2 方差分析与回归分析 采用Design Expert 8.05软件对表2中的试验结果进行方差分析和多元回归拟合,各试验因子的一次项与二次项对清除率的影响均达到了显著水平(P<0.05);因素间的交互作用对清除率的影响均不显著(P>0.05)。剔除P>0.05的不显著项,得到DPPH·自由基的清除率随底物浓度、酶解时间和酶添加量变化的回归方程如下:

其中:y为DPPH·自由基清除率的预测值;A、B、C分别为底物浓度、酶解时间和酶添加量的编码值。
方差分析结果显示,回归方程(4)的回归项极显著(P<0.01),失拟项不显著(P>0.05),表明方程拟合度高,可用于预测底物浓度、酶解时间和酶添加量对DPPH·自由基清除率的影响。同时比较方程中一次项偏回归系数的绝对值大小,结果表明,各因子对清除率影响的主次顺序为:酶解时间>酶添加量>底物浓度。
2.2.3 响应面分析 采用Design Expert 8.05软件对表2中的试验结果进行响应面分析,分析各因素对DPPH·自由基清除率的交互作用(图3)。在试验因素水平范围内,各因素间的交互作用对DPPH·自由基清除率的影响并不显著(P>0.05)。其中DPPH·自由基清除率对酶解时间的变化较底物浓度更为敏感,对酶添加量的变化较底物浓度更为敏感,对酶解时间的变化较酶添加量更为敏感。综合分析,只有在底物浓度处于合适的水平下,适当增加酶添加量和酶解时间均有利于DPPH·自由基清除率的提高。
2.2.4 胶原蛋白抗氧化活性肽最优制备条件的确定与验证 采用Design Expert 8.05软件对优化试验结果进行分析,得到最优提取条件为:底物浓度5.47%,酶解时间4.24 h,酶添加量4 200 U/g。在此条件下,由回归方程(4)计算DPPH·自由基清除率的预测值为78.3%。
为进一步验证回归方程预测值的可靠性与准确性,对最优条件进行验证实验。验证实验设3个平行,取其平均值,得到抗氧化肽对DPPH·自由基的清除率为79.6%,与预测值差异不显著(P> 0.05),对和·OH自由基的清除率分别为46.3%和63.5%,表明在优化条件下制备的蛋白肽其抗氧化活性均有所提高。
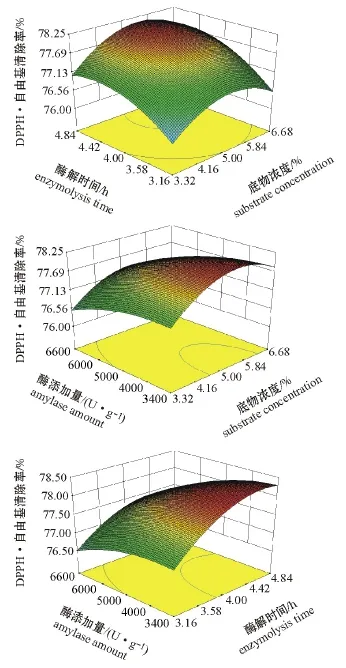
图3 底物浓度与酶解时间、底物浓度与酶添加量、酶解时间与酶添加量分别对DPPH·自由基清除率的影响Fig.3 Effects of substrate concentration and enzymatic time,substrate concentration and doses of enzyme,and enzymatic time on DPPH·free radical scavenging
3 结论
2)采用响应面试验设计优化碱性蛋白酶制备鲢鱼鳞胶原蛋白抗氧化肽的条件,得到最优的制备条件为:底物浓度5.47%,酶解时间4.24 h,酶添加量4 200 U/g。在此条件下,所得抗氧化肽对DPPH·、和·OH自由基的清除率分别为79.6%、46.3%和63.5%。
3)鲢鱼鳞胶原蛋白肽在动物体外显示出良好的抗氧化活性,其对动物体内的丙二醛含量、谷胱甘肽过氧化酶和超氧化物歧化酶活性的影响,以及抗氧化活性肽的纯化和序列分析还有待进一步研究。
[1]刘远平,张琳琳,张慧怡,等.海燕体壁胶原蛋白提取工艺的初步研究[J].大连海洋大学学报,2011,26(1):54-57.
[2]谢智芬,刘俊荣,赵艳秋,等.质地改良剂对北太平洋鱿鱼肌肉蛋白凝胶特性的影响[J].大连海洋大学学报,2012,27(2): 190-194.
[3]Liu R H.Potential synergy of phytochemicals in cancer prevention: mechanism of action[J].The Journal of Nutrition,2004,134(12):3479S-3485S.
[4]Finkel T,Holbrook N J.Oxidant,oxidative stress and the biology of aging[J].Nature,2000,408:239-247.
[5]林琳.鱼皮胶原蛋白的制备及胶原蛋白多肽活性的研究[D].青岛:中国海洋大学,2006.
[6]Giménez B,Alemán A,Montero P,et al.Antioxidant and functional properties of gelatin hydrolysates obtained from skin of sole and squid[J].Food Chemistry,2009,114(3):976-983.
[7]Mendis E,Rajapakse N,Kim S K.Antioxidant properties of a radical-scavenging peptide purified from enzymatically prepared fish skin gelatin hydrolysate[J].Journal of Agricultural and Food Chemistry,2005,53(3):581-587.
[8]韩凤杰,赵征,胡晓鹏.酶法制取鲮鱼皮胶原蛋白寡肽工艺的研究[J].现代食品科技,2006,22(2):135-137.
[9]Aleman A,Giménez B,Montero P,et al.Antioxidant activity of several marine skin gelatins[J].LWT-Food Science and Technology, 2011,44(2):407-413.
[10]Nagai T,Nagashima T,Abe A,et al.Antioxidative activities and angiotensin I-converting enzyme inhibition of extracts prepared from chum salmon(Oncorhynchus keta)cartilage and skin[J]. International Journal of Food Properties,2006,9(4):813-822.
[11]任俊凤,任婷婷,朱蓓薇.河豚鱼皮胶原蛋白肽的提取及其抗氧化活性的研究[J].中国食品学报,2009,9(1):77-83.
[12]沈澎.鲤鱼鱼鳞胶原肽的制备及特性研究[D].长春:吉林农业大学,2011.
[13]胡娟.酶解鱼鳞明胶制备生物活性肽的研究[D].广州:华南理工大学,2010.
[14]申锋,杨莉莉,熊善柏,等.胃蛋白酶水解草鱼鱼鳞制备胶原肽的工艺优化[J].华中农业大学学报,2010,29(3):387-391.
[15]中华人民共和国卫生部,中国国家标准化管理委员会.GB/T 5009.39-2003酱油卫生标准的分析方法[S].北京:中国标准出版社,2004:319-320.
[16]Shimada K,Fujikawa K,Yahara K,et al.Antioxidative properties of xanthan on the autoxidation of soybean oil in cyclodextrin emulsion[J].Journal of Agricultural and Food Chemistry,1992,40(6):945-948.
[17]Wang B,Li Z R,Chi C F,et al.Preparation and evaluation of antioxidant peptides from ethanol-soluble proteins hydrolysate of Sphyrna lewini muscle[J].Peptides,2012,36(2):240-250.
Preparation process optimization of antioxidant active peptides from silver carp scale collagen by response surface test design
CHEN Ri-chun1,2,ZHENG Bao-dong1
(1.College of Food Science,Fujian Agriculture and Forestry University,Fuzhou 350002,China;2.Fuzhou Institute of Food Industry,Fuzhou 350013,China)
The preparation conditions of antioxidant active peptides using enzymatic method were optimized from sliver carp Hypophthamichthys molitrix scale collagen.The degree of hydrolysis(DH),DPPH·,and·OH free radical scavenging rate were analyzed to evaluate the effects and the antioxidant activity of alkaline protease,neutral protease and papain hydrolytic products on silver carp scale collagen.The results showed the hydrolysate of alkaline protease had the greatest antioxidant activity with DPPH rate of 76.9%,rate of,43.1%and·OH free radical scavenging rate of 58.2%.Optimal conditions of the preparation of antioxidant activity peptides by alkaline protease hydrolysis were shown as the following:the substrate concentration of 5.47%,hydrolysis time 4.24 h,and enzyme dose of 4 200 U/g,with DPPH·of 79.6%,of 46.3%and·OH free radical scavenging rate of 63.5%.
sliver carp scale;collagen;antioxidant active peptide;alkaline protease;response surface test design
TS201.1
A
2013-10-30
福建省区域重大项目(2011N3004)
陈日春(1963-),男,博士研究生,高级工程师。E-mail:rcchen111@163.com
郑宝东(1967-),男,教授。E-mail:zbdfst@163.com
2095-1388(2013)06-0617-05
