刺参养殖池塘围隔环境特征及生态育苗的初步研究
2013-07-07谢玺赵文
谢玺, 赵文
(1.中国科学院海洋研究所,山东青岛266071;2.中国科学院大学研究生院,北京100039;3.大连海洋大学辽宁省水生生物学重点实验室,辽宁大连116023)
刺参养殖池塘围隔环境特征及生态育苗的初步研究
谢玺1、2, 赵文3
(1.中国科学院海洋研究所,山东青岛266071;2.中国科学院大学研究生院,北京100039;3.大连海洋大学辽宁省水生生物学重点实验室,辽宁大连116023)
为探索高效安全的刺参生态苗种培育途径,在刺参Apostichopus japonicus养殖池塘运用陆基围隔法比较了池塘围隔内外的环境特征(2010年10月至2011年11月),并采用搅底、施用微生态制剂、培养底栖硅藻和换水等技术方法,对刺参幼虫、稚参进行了生态育苗试验(2011年6—11月)。结果表明:试验池塘的水温与盐度呈负相关,温幅和盐幅较大却变化缓慢,pH稳定于7.9~8.2,COD含量小于10 mg/L,透明度较高,营养盐含量低;浮游生物小型化明显,浮游植物以硅藻占优势,浮游动物以桡足类占优势;围隔内刺参幼虫由小耳期发育到中耳期,成活率为50%,发育到大耳期,成活率为25%;稚参转入围隔48 h后的成活率为20.0%,70 d后的成活率为2.2%,每个围隔内稚参的平均质量从5 g/m3增加到37.9 g/m3。研究表明,在刺参养殖池塘中设置围隔,对幼虫和稚参进行生态育苗是可行的。
刺参;池塘;围隔;环境特征;生态育苗
刺参Apostichopus japonicus又名仿刺参,隶属于棘皮动物门、海参纲,分布于北纬35~44°N的太平洋西北沿岸[1-2],是典型的温带种类[3],具有较高的营养与药用价值[4]。近年来,刺参池塘养殖在中国北方沿海发展较快,规模效益显著[5-6],而安全生产刺参生态绿色苗种是刺参增养殖业健康可持续发展的先决条件。目前,对海上网箱生态育苗[7]和池塘网箱生态育苗[8-12]的研究表明,采用生态育苗方法确实能降低生产成本,增强刺参体质,是刺参生态绿色苗种生产的发展趋势。但海上网箱和池塘网箱生态育苗法有各自的局限性,前者对海区环境要求较高,必须选择风浪小的内湾设置网箱,以免遭受风浪和赤潮的侵袭;而后者在育苗前必须彻底清塘,这又会导致池塘无法进行轮捕轮放。为此,本文中研究了刺参养殖池塘设置围隔的环境特征和围隔生态育苗效果,旨在为扩展和推进刺参养殖池塘生态育苗提供依据。
1 材料与方法
1.1 材料
试验在大连金砣水产食品有限公司进行,刺参养殖池塘面积为8.67 hm2,水深为1.30 m,水温为-2.5~28.8℃,盐度为22~33。池塘每年实施轮捕轮放,体质量为100~150 g的刺参约5 000 kg,体质量为50~70 g的刺参约2 000 kg,体质量为1~5 g的刺参约1 000 kg,年产量大于1 000 kg/hm2。
1.2 方法
1.2.1 养殖池塘围隔的设置 在大连金砣水产食品有限公司的10#刺参养殖池塘中设置4个围隔,每个围隔的面积均为9 m2(3 m×3 m),围幔上部超出水面0.5 m,下部埋入池底0.5 m。设置围隔前,用二氧化氯泼洒池塘,架设围隔的同时进水并搅底,随后按 5 mg/L接种光合细菌和芽孢杆菌[13-14],一周后投放石头、贝壳、聚乙烯网片和波纹板等附着基,石头和贝壳均匀布置于吊笼(8层)中,聚乙烯网片为10片/吊,波纹板沉于围隔底部,为20片/吊,每个围隔放石头2吊、贝壳1吊、网片20吊、波纹板4吊。
1.2.2 试验池塘围隔内外的环境特征 于2010年10月—2011年10月和2010年12月—2011年11月调查了池塘围隔内外的生物因子(浮游植物和浮游动物)和非生物因子(水温、盐度、透明度和常规理化指标)。每月纳潮前采样,从池塘与围隔的上、中、下水层分别采水,混合后取水样1 L用鲁哥氏液固定,在实验室内静置24 h以上,浓缩至30 mL,用常规法镜检计数浮游植物。小型浮游动物,从浓缩至20 mL的浮游植物水样中,吸取0.1 mL全片计数(2片平均)原生动物,再吸取1 mL全片计数轮虫;大型浮游动物,分别从上、中、下水层采水,混合后取水样15 L,用25#浮游生物网(75 μm/目)过滤,将浓缩液用体积分数为5%的福尔马林固定,全部计数。按体积法计算生物量(湿质量)[15-20]。通过测量20~50只个体的大小以确定浮游生物优势种类的体积。
取表层和底层水混匀后测定水温、盐度, 现场测定透明度, 用碘量法测定溶解氧(DO),用以抗坏血酸为还原剂的磷钼蓝法测定正磷酸盐用过硫酸钾消解法测定总磷(TP),用次溴酸钠氧化法测定氨氮,用锌-镉还原法测定硝酸盐,用磺胺-盐酸奈乙二胺法测定亚硝酸盐 ,用过硫酸钾氧化法和紫外可见分光光度计测定总氮(TN),用碱性高锰酸钾法测定COD,经体积分数为95%的丙酮萃取(经研磨)后用紫外可见分光光度计测定叶绿素a含量。1.2.3 刺参幼虫、稚参在池塘围隔中的培育 于2011年6月、8—11月分别在刺参养殖池塘的4个围隔中进行幼虫和稚参培育试验。试验期间不施肥、不投饵,与池塘日常管理保持一致,并通过开阖拉链(内部有80目和200目的筛绢)换水。试验用刺参小耳幼体(100 ind./L)和稚参(60 000 ind./kg,3 000 ind./m3)均取自大连金砣水产食品有限公司育苗场,两次试验分别在相同的围隔中先后进行。
2 结果
2.1 刺参养殖池塘非生物因子的特征
从表1可见:刺参养殖池塘年平均水温为13.6℃,最高水温为28.8℃,最低水温出现在1月,为-2.5℃,在冬季有近90 d的冰封期;盐度年平均为29.0±2.9,最大盐度为33,出现在4月,最低盐度为22,出现在9月,池塘盐度多为29~31。回归分析显示,水温与盐度呈负相关,回归方程为S=-2.358T+82.05(R=0.649,n=12,P<0.01),说明北方刺参养殖池塘受纬度的影响,夏季雨水频繁。池塘的透明度全年为70~150 cm,围隔外的透明度较围隔内高,变化幅度也大,围隔内外的塘透明度多在90~130 cm;池塘的pH全年变动于 7.92~8.16;COD含量为 5.06~9.90 mg/L;DO含量年平均值为(7.96±2.18)mg/L; PO3-4-P含量为0.005~0.017 mg/L,3、4月较高, 1月最低;NH+4-N含量为0.002~0.013 mg/L,1月最高,4月最低;NO-2-N含量为0.001~0.008 mg/L,NO-3-N含量为0.002~0.014 mg/L,二者均在12月和翌年1月最低,7、8月较高。

表1 刺参养殖池塘围隔内外的理化特征Tab.1 Physical and hydrochemical properties in enclosures and sea cucumber Apostichopus japonicus culture ponds mg/L
2.2 刺参养殖池塘浮游生物的种类组成和生物量
试验池塘共检出浮游植物31种(属),其中硅藻门最多,20种(属),占浮游藻类总种数的64.5%;甲藻门次之,3种(属),占9.7%;再次是蓝藻门、绿藻门和隐藻门,各2种(属),分别占6.5%;最后是金藻门和裸藻门,各1种(属),分别占3.2%。以出现率和平均丰度看,优势种为硅藻门的新月拟菱形藻、菱形藻和舟形藻,隐藻门的尖尾蓝隐藻,绿藻门的小球藻(表2)。

表2 刺参养殖池塘浮游植物的种类组成Tab.2 The species composition of phytoplankton in sea cucumber Apostichopus japonicus culture ponds
本研究结果表明,刺参养殖池塘浮游植物的年平均生物量为(6.71±3.48)mg/L,秋季最高,为(13.09±1.37)mg/L;春季次之,为(9.21± 0.50)mg/L;夏冬季较低,平均小于4 mg/L(图1)。
试验池塘共检出浮游动物24种(属),其中浮游幼虫最多,8种(属),占浮游动物总种数的33.3%;原生动物和桡足类次之,各7种,分别占29.2%;轮虫最少,2种,占8.3%。浮游动物优势种为旋回侠盗虫、疣足幼虫、小拟哲水蚤和桡足类无节幼体等(表3)。
试验期间,围隔内外浮游植物、浮游动物的密度和生物量变化趋势相同。从图1可见:浮游植物主要为硅藻门,浮游动物主要为桡足类及其幼体;围隔内的浮游植物、浮游动物生物量明显高于围隔外池塘。
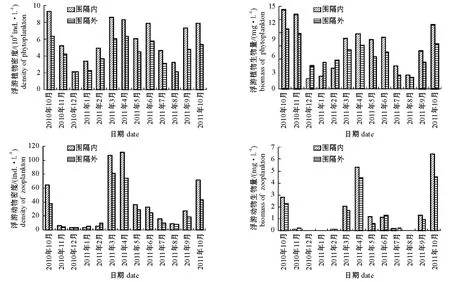
图1 养殖池塘围隔内外浮游植物、浮游动物密度与生物量的变化Fig.1 Changes in population density and biomass of phytoplankton and zooplankton in and outside of the enclosures in the culture ponds

表3 刺参养殖池塘浮游动物的种类组成Tab.3 The species composition of zooplankton in sea cucumber Apostichopus japonicus culture ponds
2.3 刺参幼虫的池塘培育
于2011年6月8日—16日进行了刺参幼虫培育试验。培育期间,水温为21.4~26.5℃ (图2),盐度为30~33,pH为8.0~8.1;叶绿素a含量围隔内高于围隔外,峰值为14.7 μg/L,呈先降低后升高再降低最后趋于稳定的变化趋势,与试验前5 d刺参幼虫的密度变化相反(图2)。经统计分析显示,幼虫的密度与叶绿素a含量呈显著负相关。围隔内外的DO和COD含量变化较为平缓, DO含量一般在5 mg/L以上,COD含量为3~4 mg/L;围隔内外氮、磷的变化趋势相同,但围隔内较围隔外变化平稳;围隔内的NH+4-N含量比围隔外略高,最高为0.022 mg/L;TN和TP在试验期间基本恒定,围隔内的TN平均维持在5 mg/L左右,略小于围隔外(平均约6 mg/L),围隔内的TP略高于围隔外(表4)。试验进行到第4天时,幼虫由小耳期发育到中耳期,密度约60 ind./L,成活率为50%;第8天时,幼虫发育到大耳期,密度约30 ind./L,成活率为25%;第9天时,发现有樽形幼虫,并开始下沉(图2)。

图2 池塘培育期刺参耳状幼虫的密度及围隔内外叶绿素a含量的变化Fig.2 Changes in auricularia larval density and chlorophyll a content in and outside enclosures in the culture ponds
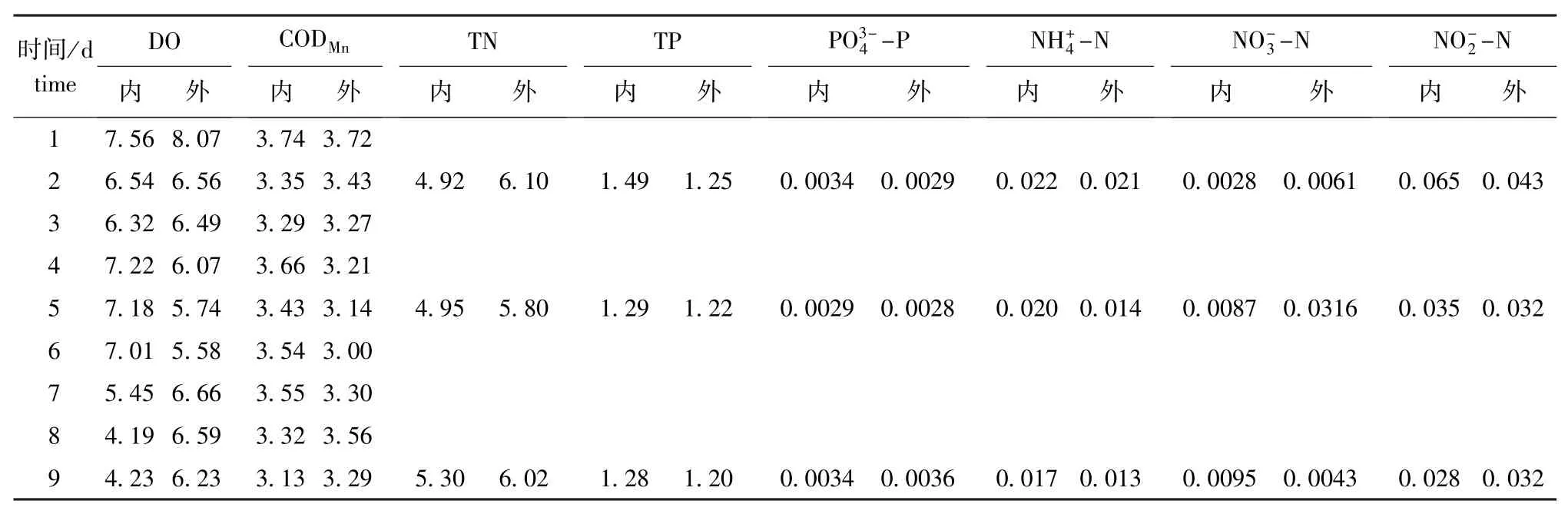
表4 幼虫培育期间池塘围隔内外水环境的变化Tab.4 Changes in water environment in/out enclosures during larva rearing mg/L
2.4 刺参稚参的池塘培育
于2011年8月14日—11月21日进行了刺参稚参培育试验。培育期间,4个围隔中稚参的平均质量、密度、成活率和附着率的变化如表5所示。在移入围隔2 d后,这些参数均出现骤降。之后,密度与成活率的下降趋势开始平缓,最终分别维持在52 ind./m3和1.8%;4个围隔中稚参的平均质量与附着率均逐渐回升,最终分别达37.9 g/m3和74.8%。
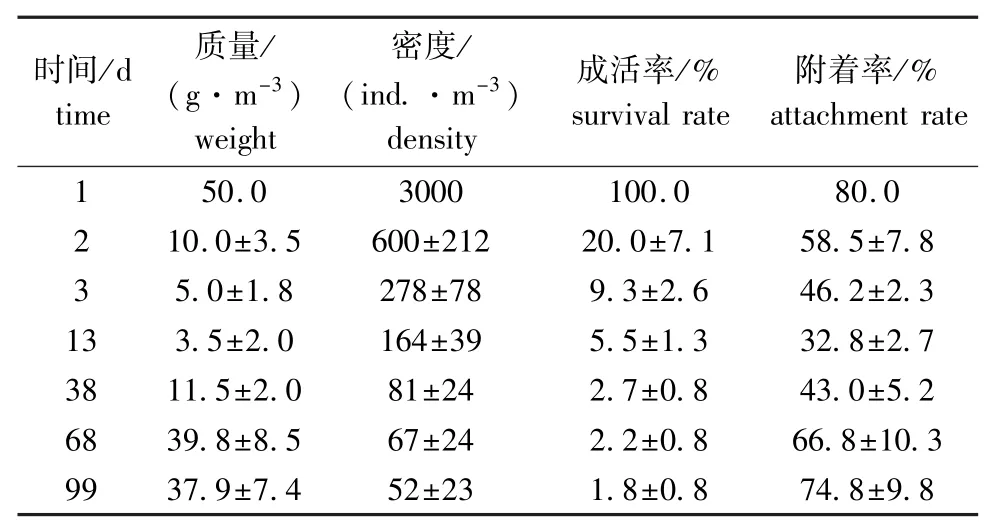
表5 池塘围隔内刺参稚参的成活和生长情况Tab.5 Growth and survival in enclosures in the culture ponds during juvenile rearing
3 讨论
3.1 刺参养殖池塘的非生物环境特点
水温和盐度是影响刺参生长与代谢的重要生态因子[21-28]。刺参养殖池塘多由近岸海水对虾池改建,毗邻陆地,平均水深为1.5 m,不存在温跃层,温度和盐度因季节更替和日常管理而多变,如池塘换水,降雨和蒸发,冬季池水结冰和春季冰融。研究表明,刺参最适生长水温为15~18℃,最适盐度为28~32[2]。本研究中,刺参养殖池塘位于大连市庄河,月平均盐度在9月最低(22), 4月最高(33);月平均水温在1月最低(-2.5℃),8月最高(28.8℃)。由此可见,刺参养殖池塘水温和盐度的变幅大于其自然分布的海水。经回归分析表明,水温与盐度呈负相关,即夏季高温降水多,则盐度较低;冬季结冰不换水,盐度则较高;秋季在生产上为刺参的收获期,池水浅,不换水,盐度较春、夏季高。
刺参养殖池塘不投饵、不施肥,靠换水和池底沉积物再悬浮提供营养盐,主要是它们可被池塘生态系内的生产者——藻类直接吸收利用,转化为刺参的饵料基础。试验期间,总氮与总磷的比值为3.73,远远低于平衡值[29-30],也低于盐碱池塘[31]和对虾养殖围隔[32]中二者的比值。这是因刺参养殖池塘春夏秋三季投药杀菌、改良底质和控制大型海藻所致。因此,在养殖过程中适量施肥、投饵,可以补充氮源,提高产量。
3.2 刺参养殖池塘浮游生物种类组成和生物量的特点
刺参养殖池塘的周年环境变化很大,又受到不同程度的人为干扰,因此,浮游植物与浮游动物的季节演替剧烈,但也有其规律可循[33]。根据浮游生物的密度和生物量,一般都有秋季的主高峰和春季的次高峰,对应于刺参生产上的秋季收获后期和春秋两季的放养早期。硅藻在种数和密度上占优势,这与大连大窑湾海区浮游植物的情况相似[34],在试验刺参养殖池塘中,硅藻与绿藻常年存在,金藻和隐藻有春、秋季两个高发期,蓝藻只发生于夏季高温期,裸藻在夏、秋季较多,甲藻、硅藻和绿藻在冬季常见。桡足类及其幼体常年存在,轮虫在冬、春季较多,原生动物和浮游幼虫在冬季较少,春、秋季常见,夏季较多。
3.3 刺参幼虫池塘围隔育苗的初步研究
在刺参养殖池塘中设置围隔生态系统,因为围幔高出水面可以遮阳避风,颗粒悬浮物少,浮游植物在短期内能够占优势。刺参幼虫主要以浮游植物为食,与浮游动物同属于次级消费者,彼此间因生态位的部分重叠而产生竞争。试验期间,海月水母爆发,对刺参幼虫产生捕食性竞争,故将之捕捞;另发现红色中缢虫大量发生,密度约为 100 ind./L,与刺参幼虫进行资源性竞争。这两点可能是试验前期幼虫成活率降低的主要原因。之后几天是大潮,天气随之突变,终日雨雾,水温与盐度骤降,对幼虫成活率也有一定的影响。试验期间,叶绿素a含量变化呈正态波形,反映了浮游植物是先增加后降低。分析原因:一方面是试验刚开始时投苗量相对较大,浮游植物被迅速摄食,扰动了围隔原有生态系统的平衡,然而随着适应力较差幼虫的死亡,浮游植物的密度也随之上升,生态平衡重新建立,直至叶绿素a含量最高,达14.7 μg/L;另一方面,天气的突变也使得叶绿素a含量骤降。试验表明,在围隔中培养天然饵料可以满足刺参幼虫(100 ind./L)的需求,且氨氮、溶解氧等均处于刺参幼虫变态发育的适宜范围内,相信幼虫的成活率在进一步研究后还能有所提高。同时期室内人工育苗的小耳幼体至大耳幼体的成活率为70%,是围隔育苗(25%)的2倍多,可见自然选择的力量发挥了重要作用,这也说明刺参幼虫池塘围隔生态育苗技术尚需完善。
3.4 刺参稚参池塘围隔育苗的初步研究
稚参在进入围隔生态系统后,两天内死亡率高达90%,这是育苗室内与室外池塘环境差异较大造成的。试验结束后,稚参的成活率为1.8%,附着率为74.8%,说明稚参在经历了最初的高死亡率后,逐渐适应了围隔生态环境,开始附着生长。若从8月16日起进行统计(除开始两天),2个月后平均每个围隔稚参的质量由5 g/m3增加到37.9 g/m3,增重近8倍,成活率为19%。同时期室内参苗的成活率为25%,每立方水体增重10倍。二者相比,围隔育苗的成活率略低于室内人工育苗,但经检验的增重效果(产量)差异并不显著(P>0.05)。试验开始前搅动底泥培养底栖硅藻,期间撑开拉链,保持水流与池塘相通,不用药,进行生态育苗,培育出的稚参经自然选择后体质健壮,个体伸展力好,对环境的适应能力强。
3.5 刺参养殖池塘围隔育苗的可行性分析
刺参养殖池塘生态育苗及其相关技术的研究,为生产刺参生态绿色苗种开辟了新途径。刺参养殖池塘围隔育苗是池塘生态育苗的新形式,目前尚处于试验摸索阶段。与室内人工育苗相比,一方面经受池塘生境(如水温、盐度、风浪、浮游生物等)的自然选择后会使参苗体更结实,对环境的适应力更强;另一方面人为干扰因素少,围隔内不施肥投饵、不滥用药,养殖环境污染小,参苗体内无药物残留。与刺参土池网箱育苗及海上网箱生态育苗相比,由于人工设置围隔,不用清塘也不需担心台风的侵袭,降低了生产成本,且操作简单,易于推广。然而生物与生物、生物与环境之间的相互作用是复杂多变的。本研究中,在调查刺参养殖池塘与围隔环境特征的基础上,研究了围隔生态育苗刺参幼虫、稚参的成活率和增重效果,并与同时期室内育苗进行了对比,分析了刺参养殖池塘围隔生态育苗的可行性,初步证实了在池塘中设置围隔进行刺参幼虫、稚参的生态育苗是可行的,至于养殖池塘围隔内刺参的投苗密度、规格与附着基间的关系还有待进一步研究。
[1]Sloan N A.Echinoderm fisheries of the world:a review[C]// Balkema A A.Proceedings of the Fifth International Echinoderm Conference.Rotterdam:Balkema AA Publishers,1984:109-124.
[2]廖玉麟.中国动物志:棘皮动物门海参纲[M].北京:科学出版社,1997:334.
[3]Liao Y L.The aspidochirote holothurians of China with erection of a new genus in echinoderms:present and past[C]//Proceedings of the European Colloquium on Echinoderm.Rotterdam:Balkema AA Publishers,1980:115-120.
[4]Chen J X.Present status and prospects of sea cucumber industry in China[C]//FAO.Advances in Sea Cucumber Aquaculture and Management.Rome:FAO,2004:25-38.
[5]Department of Fisheries.China fisheries statistic yearbook[R]. Beijing:Ministry of Agriculture,2005.
[6]Department of Fisheries.China fisheries statistic yearbook[R]. Beijing:Ministry of Agriculture,2008.
[7]何振平,王秀云,任建功,等.刺参苗种池塘小网箱培育试验[J].水产科学,2006,25(11):581-582.
[8]马跃华.刺参海上网箱生态育苗生产研究[J].河北渔业,2006(6):32-33.
[9]王吉桥,李飞,卢梦华,等.海参土池生态育苗技术[J].水产科学,2005,24(11):38-39.
[10]王吉桥,蒋湘辉,卢梦华,等.海参育苗新技术——土池生态育苗[J].现代渔业信息,2005,20(12):1-3.
[11]王吉桥,王鹏,李飞.土池网箱培育仿刺参Apostichopus japonicus(Selenka)幼参的试验[J].现代渔业信息,2007,22(4):3-5.
[12]王吉桥,胡海洋,姜玉声,等.在土池网箱中促进仿刺参(Apostichopus japonicus)繁殖、变态和附着的研究[J].现代渔业信息,2008,23(7):3-5.
[13]卢静,李德尚,董双林.对虾池不同水质调控围隔中浮游物的研究[J].中国水产科学,2000,7(3):61-66.
[14]Grice G D,Reeve M R.Marine Mesocosms[M].New York: Springer US,1982:323-332.
[15]章宗涉,黄翔飞.淡水浮游生物研究方法[M].北京:科学出版社,1991.
[16]张觉民,何志辉.内陆水域渔业自然资源调查手册[M].北京:农业出版社,1991.
[17]Lawence S W,Malley D F,Findlay W J,et al.Method for estimating dry weight of freshwater planktonic crustaceans from measures of length and shape[J].Canadian Journal of Fisheries and Aquatic Sciences,1987,44:264-274.
[18]Bamstedt U.The Biological Chemistry of Marine Copepods[M]. Oxford:Clarendon,1986:1-58.
[19]Omori M.Weight and chemical composition of some important oceanic zooplankton in the North Pacific[J].Marine Biology, 1969,3:4-10.
[20]Reynolds C S.The ecology of freshwater phytoplankton[M].London:Cambridge University Press,1984.
[21]李宝泉,杨红生,张涛,等.温度和体重对刺参呼吸和排泄的影响[J].海洋与湖沼,2002,33(2):182-187.
[22]Yang H S,Yuan X T,Zhou Y,et al.Effects of body size and water temperature on food consumption and growth in the sea cucumber Apostichopus japonicus(Selenka)with special reference to aestivation[J].Aquaculture Research,2005,36:1085-1092.
[23]Dong Y W,Dong S L.Growth and oxygen consumption of the juvenile sea cucumber Apostichopus japonicus(Selenka)at constant and fluctuating water temperatures[J].Aquaculture Research, 2006,37:1327-1333.
[24]Dong Y W,Dong S L,Tian X L,et al.Effects of diel temperature fluctuations on growth,oxygen consumption and proximate body composition in the sea cucumber Apostichopus japonicus Selenka [J].Aquaculture,2006,255:514-521.
[25]Dong Y W,Dong S L,Ji T T.Effect of different thermal regimes on growth and physiological performance of the sea cucumber Apostichopus japonicus Selenka[J].Aquaculture,2008,275:329-334.
[26]隋锡林,廖玉麟.海参增养殖 [M].北京:农业出版社,1988: 54-55.
[27]袁秀堂,杨红生,周毅,等.盐度对刺参(Apostichopus japonicus)呼吸和排泄的影响[J].海洋与湖沼,2006,37(4):354-360.
[28]Yuan X T,Yang H S,Wang L L,et al.Effects of salinity on energy budget in pond-cultured sea cucumber Apostichopus japonicus(Selenka)(Echinodermata:Holothuroidea)[J].Aquaculture, 2010,306:348-351.
[29]Redfield A C.The biological control of chemical factors in the environment[J].American Scientist,1958,46:205-221.
[30]Rhee G H,Gotham I J.Optimum N:P ratios and coexistence of planktonic algae[J].Journal of Phycology,2008,16:486-489.
[31]赵文,董双林,李德尚,等.盐碱池塘围隔生态系统的悬浮物结构及有机碳库存量[J].生态学报,2002,22(12):2133-2140.
[32]刘国才,李德尚,卢静,等.对虾养殖围隔生态系颗粒悬浮物的研究[J].应用生态学报,1999,10(3):350-352.
[33]赵文,杨为东,魏杰,等.刺参池塘养殖生态学及健康养殖理论[M].北京:科学出版社,2009.
[34]赵文,魏洪祥,郭凯.2006—2007年大连大窑湾海区浮游植物的群落结构及其季节变化[J].大连海洋大学学报,2011,26(4):291-298.
The environmental characteristics and ecological breeding in an enclosure in a sea cucumber culture pond
XIE Xi1,2,ZHAO Wen3
(1.Institute of Oceanology,Chinese Academy of Sciences,Qingdao 266071,China;2.Graduate University of Chinese Academy of Sciences,Beijing 100049,China;3.Key Laboratory of Hydrobiology in Liaoning Province,Dalian Ocean University,Dalian 116023,China)
The characteristics of plankton community and abiotic factors were investigated in enclosures in sea cucumber Apostichopus japonicus culture ponds from December,2010 to November,2011,and the ecological breeding of larval and juvenile sea cucumber was conducted in the experimental enclosures displaced in ponds of Dalian Gold Tone Seafood Co.Ltd.,Liaoning Province,by pond stirring,addition of probiotics,benthic diatom culture and water exchange from June to November,2011.The results showed that water temperature was negative correlated with salinity,great fluctuation of both being changed gradually.The pH 7.9-8.2,high transparency(above 70 cm) measured by Secchi disk and COD level of below 10 mg/L,31 phytoplankton species(predominated by diatoms) and 24 zooplankton species(predominated by copepods)were found in the ponds,tending to be miniaturization. The early auricularia larvae were developed into mid-auricularia larvae with survival rate of 50%and the mid-auricularia larvae into late auricularia larvae with survival rate of 25%in the enclosures.The juveniles reared in the enclosures had survival rate of 20.0%in 2 days,and the survival rate of 2.2%in 70 days,the average output being increased from 5 g/m3to 37.9 g/m3.The findings indicate that it is practicable to breed larval and juvenile sea cucumber ecologically in enclosures displaced in ponds.
Apostichopus japonicus;pond;enclosure;environmental characteristics;ecological breeding
S968.9
A
2013-04-24
国家海洋公益性行业项目(200905020-5)
谢玺(1983-),男,博士研究生。E-mail:279731276@qq.com
赵文(1963-),男,教授,博士生导师。E-mail:zhaowen@dlou.edu.cn
2095-1388(2013)06-0589-08
