内镜超声引导下植入缓释吉西他滨进行胰腺组织间化疗的动物实验研究
2013-07-07李瑜斐孙思予王树朋
李瑜斐 孙思予 葛 楠 王树朋
(沈阳市红十字会医院消化内科,辽宁 沈阳 110013)
内镜超声引导下植入缓释吉西他滨进行胰腺组织间化疗的动物实验研究
李瑜斐 孙思予 葛 楠 王树朋
(沈阳市红十字会医院消化内科,辽宁 沈阳 110013)
目的探寻超声内镜引导下的缓释吉西他滨组织间化疗在猪的胰腺的安全性和可行性。方法在超声内镜引导下将19G穿刺针刺入猪的胰腺组织中,通过穿刺针将能够缓慢释放吉西他滨的化疗粒子植入至胰腺组织的特定位置。观察14d后,处死动物取出放置粒子部位的胰腺组织进行观察。结果所有化疗粒子都被成功植入,没有粒子发生移位。胰腺组织发生局限的纤维素样坏死区域。在病灶中心1cm的范围内凋亡细胞数量增多。结论超声内镜引导下植入吉西他滨用于胰腺的组织间化疗不仅安全、耐受性好,而且可使组织消融、诱导细胞凋亡。
胰腺;内镜超声;化学疗法;吉西他滨
胰腺癌是一种恶性程度非常高的肿瘤,预后较差,5年生存率仅为5%或更低[1],绝大多数的患者在就诊时已失去手术切除的机会。对大多数手术不能切除的局部晚期胰腺癌,目前主要的治疗方法有各种体内、体外放疗和以吉西他滨为主的化疗。由于胰腺的血供复杂,大多数胰腺肿瘤具有低血供的特点,胰腺癌全身化疗效果不甚理想。为了提高实体性肿瘤内的药物浓度,减少化疗药物的全身毒性,瘤内直接注射化疗药物的给药方法应运而生。20世纪90年代将这种治疗方法命名为组织间化疗[2],即把化疗药物和载体组成的混合物植入肿瘤内部,在体内缓慢释放,使化疗药物在局部形成有效的治疗浓度,减少全身用药的不良反应,且在头颈部、皮肤等恶性肿瘤的治疗中取得了很好的临床效果。由于胰腺为腹膜后器官,穿刺植入困难,内镜超声引导下穿刺技术具有定位准确、创伤小、穿刺距离短等优点,因此可借助内镜超声进行化疗粒子的胰腺肿瘤内植入治疗。孙思予曾在国内外最早进行了EUS引导下组织间化疗的预实验,即在EUS引导下将缓释5-FU粒子植入猪胰腺内,观察粒子局部胰腺组织病理学变化及生长代谢变化,证实了EUS引导下组织间化疗的准确性、安全性和组织消融的有效性。经研究在生存期和临床获益率方面,吉西他滨均明显优于5-Fu。能否EUS植入目前对胰腺癌疗效最佳的治疗药物吉西他滨做成缓释多聚粒子来进行组织间治疗?因此,我们采用动物实验作为预实验,来确定内镜超声引导下能否将吉西他滨粒子安全地植入猪的胰腺组织中,并观察粒子局部胰腺组织消融和细胞凋亡情况。
1 材料与方法
1.1 实验对象:4只健康家猪,体质量40~50kg。
1.2 实验方法:4只健康家猪,予速眠新Ⅱ肌内注射麻醉。在整个过程中,监控循环和呼吸参数。一台带有3.8mm通道的线阵超声内镜插入猪的食道中,并进入胃腔。在猪的胰腺上确定一个没有主胰管或大的动静脉的区域当作假定的肿瘤部位进行组织间化疗。在内镜超声引导下经过19G穿刺针通过最接近胰腺的胃壁插入进胰腺,之后将探针取出,将化疗粒子放入细针中,用探针推动细针内的化疗粒子,将吉西他滨定点植入胰腺。
实验选择的化疗粒子为合肥工业大学控释药物研究室所提供的,微球粒径均<100μm,含药微球的含药量为20%,药物缓释时间为30d。治疗后,观察动物14d,注意有无急性胰腺炎的临床表现(如食欲不振、易怒等)。治疗前抽血查血常规检测,白蛋白、丙氨酸转氨酶(ALT),天冬氨酸转氨酶(AST)、血清淀粉酶作为基准水平,治疗后立即抽血验以上数值,并在组织间化疗14d后再次抽血验以上数值。在化疗粒子植入14d后,将猪处死后,剖腹检查以排除腹腔出血、胰瘘、腹膜炎等并发症。取出胰腺组织,化疗区域的变化是可见的。距植入点每间隔10mm取材一次,共5次,对组织标本冰冻保存。对组织标本进行HE染色,在光镜下观察组织损伤的程度,计算变性坏死区的面积。应用免疫组化技术,用原位细胞凋亡检测(TUNEL)试剂盒,对组织标本的凋亡进行免疫组化检测和量化分析。细胞凋亡阳性的判断:光镜下观察,凋亡阳性的细胞的胞核为棕黄色或棕褐色均匀或颗粒状染色。观察阳性细胞的数量和分布,以40×10倍显微镜计数一个视野内的阳性细胞数,随机计数5个高倍视野,求出平均每个高倍视野内阳性细胞百分率,计算凋亡指数。
2 实验结果
4只猪都能耐受此实验。在14d的化疗观察期,猪并没有表现出的任何临床症状及体征:腹膜出血、感染、急性胰腺炎(没有食欲或意识,或者情绪的变化)。血液生化参数(标准偏差(SD))如下:红细胞计数(6.56±0.14)×1012/L、白细胞计数(29.4±0.21)× 109/L、血小板计数(385.25±73.88)×109/L、白蛋白(24.68±0.41)g/L,ALT(59.25±4.5)U/L,ⅡAST(47.5±3.7)U/L,缁血清淀粉酶(758.5±18.3)U/L。手术后立即检查酶的水平没有变化。在第14天,实验室调查结果:红细胞计数(6.49±0.50)×1012/L、白细胞计数(30.05±0.39)×109/L、血小板计数(391±113.44)×109/L、白蛋白(25.65±0.80)g/L,ALT(64.75 ±3.20)U/L,ⅡAST(50.5 ±3.11)U/L,缁血清淀粉酶(778.75±17.52)U/L,生化指标的变化不显著(P>0.05)。将猪安乐死后取出胰腺组织,化疗粒子周围的胰腺组织呈白色(图1),化疗粒子无移位,所有粒子均可找到。病理组织学检查证实在化疗粒子周围出现纤维素性坏死(图2)。在坏死组织与非坏死组织之间界线清晰。坏死区域的平均直径5.8mm(5.4~6.3mm)。在坏死区域周围仅有轻微炎症出现。放置化疗粒子周围20mm以外的胰腺组织以及周围器官是正常的。在病灶中心1cm范围的组织内出现了数量众多的凋亡细胞(图3),凋亡指数的平均标准差是(47.55±6.7)%。在距病灶中心5 c m 处,几乎找不到凋亡细胞,凋亡指数的平均标准差是(0.2295±0.071)%。这2处凋亡指数的差异有统计学意义(P<0.05)。

图1 植入化疗粒子周围的胰腺组织变白

图2 在治疗中心处剖开做病理,在化疗粒子周围可见纤维素性坏死
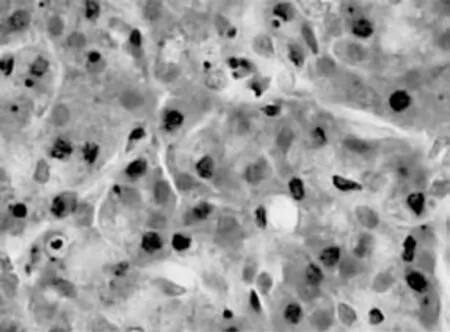
图3 在化疗中心1 cm范围的组织内见大量凋亡细胞
3 讨 论
我们用微创的方法植入化疗粒子,采用组织间化疗的方法,使化疗药物在局部形成高浓度,达到器官靶向治疗的目的,在延长化疗药物作用时间的同时,不增加化疗药物的全身毒性[3],望部分或完全取代全身化疗,可提高晚期胰腺癌生存期和控制肿瘤相关症状。目前吉西他滨已成为国内外治疗胰腺癌一线化疗药物,吉西他滨对局部进展期或转移性胰腺癌具有一定疗效[4-5]。间质化疗能够提高肿瘤局部的药物浓度,从而提高肿瘤化疗效果,而且毒副作用较小,尤其是可明显降低吉西他滨的血液学毒性,同时药物作用时间延长。
本实验中,未见显著的、立即的或后续出现的出血、感染、急性胰腺炎或胰管瘘等。无显著的生物化学参数改变。结果证明与全身化疗相比,组织间化疗全身毒性较小。超声内镜引导下的组织间化疗无有害辐射,即该治疗对患者和操作者都是无害的。病理学检查结果证明在化疗粒子周围出现纤维素样坏死,在坏死组织与非坏死组织之间界线清晰。细胞凋亡指数在化疗粒子植入的中心位置1 cm范围内显著增加。组织间化疗诱导了胰腺组织的纤维素样坏死和细胞凋亡。所有的猪多能耐受此试验,生化水平没有明显变化。表明超声内镜引导下的猪的胰腺化疗粒子植入技术是可行的,这项技术有很好的耐受性。
超声内镜引导下的组织间化疗将被应用于缓解不能手术切除的胰腺恶性肿瘤。目前的研究还很有限,有必要对组织间化疗的安全性及治疗效果进行进一步的研究。针对胰腺癌的间质化疗,一系列动物实验研究都取得了很好的结果,提示间质化疗在临床上的有效应用,会成为改善晚期胰腺癌预后的有力手段。但是间质化疗在胰腺癌的临床应用研究中还处于起步阶段,有许多问题需要解决。尽管把间质化疗有效地应用于胰腺癌的临床治疗面临许多难题,但是相信随着研究的不断深入,间质化疗必将成为胰腺癌治疗的手段之一。
4 结 论
组织间化疗是通过手术、穿刺等方式把化疗药物和载体所形成的复合物植入肿瘤内部,利用载体在体内的缓慢降解而达到对化疗药物的缓释作用,使化疗药物在局部形成高浓度,达到器官靶向治疗的目的。超声内镜引导的穿刺术是目前治疗胰腺疾病最精确、微创的方法。近年来,已有关于各种超声内镜引导下治疗胰腺疾病方法的报道发表,包括超声内镜引导下的基因治疗、射频消融、光动力学治疗、免疫学治疗、胰腺内酒精注入疗法、组织间近距治疗。这些技术为化疗粒子的植入提供了精确且安全的途径,为胰腺肿瘤的组织间化疗提供了一种新方法。超声内镜引导下植入吉西他滨用于胰腺的组织间化疗不仅安全、耐受性好,而且可使组织消融、诱导细胞凋亡。
[1] Cooperman AM.Pancreat in cancer:the bigger picture[J]. SurgClin North Am,2001,81(3):557-574.
[2] Brem H,Mahaley M S Jr,Vick N A,et al.Interstitial chemotherapy with drug polymer implants for the treatment of recurrent gliomas[J].J Neurosurg,1991,74(3):441-444.
[3] BREM H, EWEND M G, PIANTADOSI S, et al1 The safety of interstitial chemotherapy with BCNU2loaded polymer followed by radiation therapy in the treatment of newly diagnosed malignant gli2 omas: phase trial[J]. J N eurooncol,1995,26(2):111 2-1231.
[4] NCCN. Pancreatic adenocarcinoma V1 2009.available at http: //www.nccn.Org/professionals/physician-gls/f-guidelines. asp,03/26 /2009.
[5] Saif MW.Controversies in the adjuvant treatment of pancreatic adenocarcinoma [J].JOP,2007,8(5):545-552.
Endoscopic Ultrasound-guided Implantation of Sustained Release Gemcitabine Chemotherapy for Pancreatic Tissue Between Animal Studies
LI Yu-fei, SUN Si-yu, GE Nan, WANG Shu-peng
(Department of Gastroenterology, Red Cross Hospital of Shenyang, Shenyang 110013, China )
ObjectiveTo investigate the feasibility and safety of endoscopic ultrasonography(EUS)guided interstitial chemotherapy for the pancreas in pig’s mode1.MethodsA therapeutic 19-gauge needle was inserted into the pancreas with EUS guidance, and seeds with sustained release of gemcitabine were implanted into the tissue. After 14 days of clinical observation, the animals were sacrificed and the tissue response to local chemotherapy was examined.ResultsAll the seeds were implanted successfully and no migration was observed. Chemotherapy induced tissue fibrous necrosis was localized in the pancreas without significant complications.The apoptotic index of tissue within 1 am of the seeds increased.ConclusionImplanted gemcitabine into the pancreatic tissue with the guiding of ultrasound endoscopy is not only safety, but also tolerability, it can make the tissue ablate, induce the cell apoptosis.
Pancreas; Endoscopic ultrasonography; Chemotherapy; Gemcitabine
R445.1
B
1671-8194(2013)16-0069-03
