日本血吸虫热休克蛋白70在昆虫细胞Sf9中的表达鉴定
2013-07-04徐瑞敏李运燕段明明苑纯秀杨健美冯新港
徐瑞敏,李运燕,2,段明明,刘 群,2,苑纯秀,杨健美,冯新港
(1.中国农业科学院上海兽医研究所 农业部动物寄生虫学重点实验室,上海 200241; 2.上海师范大学生命与环境科学学院,上海 200234)
日本血吸虫病是一种分布广泛、危害严重的寄生虫病,至今仍然严重影响我国人、畜的健康和经济的可持续发展[1]。安全有效的疫苗的成功开发与应用是最终实现控制血吸虫病目标的技术保障[2]。目前,公认的具有较高的保护性效果的疫苗是辐照致弱的尾蚴或童虫疫苗RAV(radiation attenuated vaccine)[3],但由于材料来源和安全性等问题,RAV仍未推广应用。一般认为,通过模拟RAV的效应机制来开发血吸虫疫苗可能是一条值得探索的新途径。尽管对RAV诱导的宿主产生的高保护性免疫应答的机制有所了解,但RAV的虫源性的分子基础和机制仍然不明。据Hedstrom等[4]报道,SmHSP70为RA曼氏血吸虫疫苗的一种重要的免疫原;Yang 等[5]通过应用蛋白质组技术分析发现,与正常对照组比较紫外致弱的日本血吸虫尾蚴转化来的童虫的SjHSP70呈现高表达,他们研究小组进一步将含SjHSP70分子的DNA疫苗免疫小鼠,发现可诱导小鼠产生偏向于Th1的免疫应答,且产生了一定的抗血吸虫攻击感染的免疫保护效果[6]。我们的前期的预实验结果也显示,SjHSP70在辐照日本血吸虫尾蚴转化来的童虫(4 d和7 d)细胞表面呈高表达;另一个应急分子钙网蛋白SjCRT在RA血吸虫童虫(7 d)来源细胞中也呈高表达,且可以刺激小鼠树突细胞(DC)表型的成熟[7]。因此我们推断:在RAV模型中,血吸虫的应急分子如热休克蛋白70(SjHSP70)、钙网蛋白(SjCRT)以及高迁移蛋白1(SjHMGB1)等可能在活化宿主的抗原提呈细胞如DC、极化CD4+T细胞、以及增强RAV的免疫原性等方面发挥了重要的作用。
为实验评价SjHSP70是否具有上述免疫生物学功能,必需获得一定数量的虫源的或是重组的SjHSP70蛋白。由于虫体材料来源受到极大地限制,故一般采用原核或真核细胞表达系统来获得目的蛋白。已报道的血吸虫SjHSP70蛋白免疫学实验使用的都是原核表达的重组蛋白,或直接使用DNA疫苗剂型[5],考虑到原核表达重组蛋白可能带来内毒素的污染,从而有可能影响对SjHSP70相关的免疫学功能的评价。本研究利用昆虫杆状病毒表达系统,在真核细胞Sf9中表达了SjHSP70,为进一步研究SjHSP70免疫学特征及其在RAV模型中所发挥的作用等提供材料。
1 材料与方法
1.1 菌株、载体和细胞日本血吸虫虫卵cDNA文库、杆状病毒转移载体pFastBacHTA及其野生型毒株、Sf9 昆虫细胞、DH10Bac 感受态细胞由中国农业科学院上海兽医研究所农业部动物寄生虫学重点实验室保存;E.coliDH5α感受态细胞购自北京天根生物科技有限公司。
1.2 主要试剂ExTaq聚合酶、限制性内切酶BamHⅠ和EcoRⅠ、T4 DNA连接酶、DNA纯化试剂盒及小型质粒抽提试剂盒均购自购自大连宝生物工程有限公司;DNA分子标准物购自北京天根生物科技有限公司;蛋白分子量标准物购自麦约尔生物技术有限公司;ODYSSEY anti-Mouse IRDye 800CW购自上海仪涛生物有限公司;Ni-NTA His-Bind 树脂、Ni-NTA缓冲液试剂盒、昆虫细胞裂解液购自Novagen公司;LipofectamineTM2000 脂质体转染试剂、SF900 Ⅲ无血清培养基、FBS、Alexa Fluor@488 goat anti-mouse IgG(H+L)购自上海Invitrogen 公司;SjHSP70原核表达蛋白[8]及该蛋白免疫鼠源血清、血吸虫感染鼠的阳性血清均由中国农业科学院上海兽医研究所农业部动物寄生虫学重点实验室制备并保存。
1.3 引物设计与合成根据GenBank(登录号:AY813185)的SjHSP70基因序列设计引物,PCR扩增该基因全长序列,其中:上游引物: 5'- CGGGATCCA TGTCTCGTAACTTGTTGTTA-3'; 下 游 引 物: 5'-CCGGAATTCTTACTGCTTCTC; CTGTTTAG -3'。上下游引物的5'端分别加入BamHⅠ和EcoRⅠ限制性内切酶位点,引物由上海Invitrogen公司合成。以日本血吸虫虫卵cDNA文库为模板进行PCR 扩增,PCR 程序设定:94℃预变性5 min;94℃变性 45 s,55℃退火 45 s,72℃延伸 2 min,35个循环,最后72℃延伸10 min,4℃保存;将扩增的PCR 产物经1%琼脂糖凝胶电泳鉴定,按照DNA纯化试剂盒操作进行产物纯化回收。
1.4 pFastBacHTA-SjHSP70转移载体的构建纯化后的PCR 产物和pFastBacHTA载体用BamHⅠ和EcoRⅠ37℃双酶切后分别纯化回收,T4 DNA 连接酶、16℃恒温水浴锅过夜连接。将连接产物转化到DH5α感受态细胞,涂板,37℃恒温培养箱倒置培养过夜,挑克隆过夜培养,取菌液进行PCR鉴定,阳性者再抽质粒进行双酶切鉴定,并送至上海桑尼公司科技有限公司测序。阳性质粒命名为pFastBacHTA-SjHSP70。
1.5 重组穿梭质粒reBacmid-SjHSP70的构建和鉴定将重组的pFastBacHTA-SjHSP70质粒转化到DH10Bac细胞,涂布于X-gal培养板,37℃倒置培养24~48 h,通过蓝白斑筛选出阳性克隆,经SjHSP70特异性引物及Bac-To-Bac杆状病毒载体通用引物[7]两次PCR鉴定穿梭质粒reBacmid-SjHSP70。按照质粒抽提试剂盒操作手册提取重组杆状病毒穿梭载体reBacmid-SjHSP70。
1.6 reBacmid-SjHSP70转染 Sf9昆虫细胞将 2 μL重组质粒和 5 μL 脂质体分别加入 100 μL Grace's Insect培养基中稀释混匀,室温下孵育30 min。加入800 μL SF900 Ⅲ无血清培养基,混匀后转染处于对数生长期的Sf9昆虫细胞,27℃培养箱培养5 h后,去除转染液加入2 mL SF900 Ⅲ完全培养基(含10%FBS)。72 h后收集上清作为第1代重组病毒,经3次传代得到高效价的重组杆状病毒为种毒株。
1.7 重组SjHSP70蛋白的检测
1.7.1 间 接 免疫荧光(Indirect Immunofluorescent Assay,IFA)检测 用上述重组杆状病毒毒株于6孔细胞培养板中感染Sf9细胞48 h,-20℃甲醇固定20 min。以原核表达的SjHSP70蛋白免疫BALB/c小鼠制备的血清一抗 37℃孵育 1 h ,PBST 洗涤 5 次,Alexa Fluor@488 goat anti-mouse IgG(H+L) 二 抗 孵 育45 min,PBST洗涤5次,荧光显微镜下观察荧光反应。
1.7.2SjHSP70蛋白的纯化及纯化蛋白的Western blot分析 重组杆状病毒毒株大量转染Sf9细胞,48 h后收集细胞,263×g离心 10 min,取沉淀,加入昆虫细胞裂解液,室温裂解10 min,725×g离心10 min,取上清。按照Ni-NTA His-Bind纯化操作手册纯化目的蛋白,将纯化的SjHSP70重组蛋白SDSPAGE电泳,转膜封闭过夜。以感染日本血吸虫42 d的小鼠阳性血清作一抗,室温孵育3 h,PBST洗涤5 次,ODYSSEY anti-Mouse IRDye 800CW 作二抗,室温孵育45 min,PBST洗涤5次,双色红外激光成像仪成像。
2 结果
2.1 pFastBacHTA-SjHSP70转移载体的构建以日本血吸虫虫卵cDNA文库为模板,PCR 扩增出一条大小约为1962 bp的目的条带,与预期基因大小一致(图1);将其与pFastBacHTA载体连接转化,经菌液PCR、双酶切(图1)及测序签定pFastBacHTA-SjHSP70重组载体构建成功。
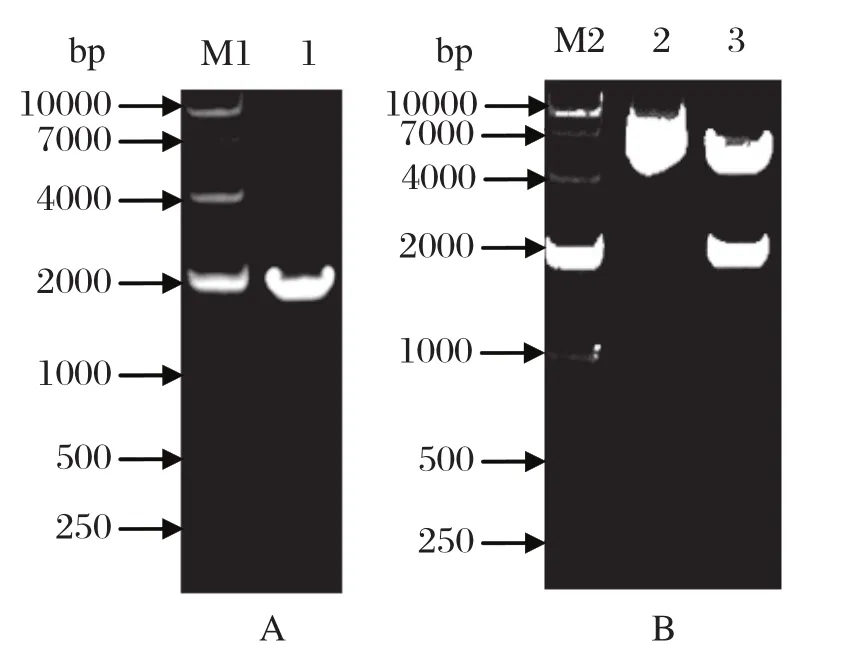
图1 SjHSP70基因的PCR扩增(A)和pFastBacHTASjHSP70转移载体的构建及双酶切鉴定Fig.1 The amplifi cation of SjHSP70 gene by PCR and the restriction enzyme analysis of recombinant transferring vector pFastBacHTA-SjHSP70
2.2 重组穿梭质粒 reBacmid-SjHSP70的构建将重组的pFastBacHTA-SjHSP70转化至DH10Bac细胞,获得重组穿梭质粒reBacmid-SjHSP70。以reBacmid-SjHSP70为模板,用SjHSP70基因特异性引物进行PCR,扩增产物大小约为1962 bp,用Bac-To-Bac杆状病毒载体通用引物,扩增产物大小约为4392 bp,其中2430 bp为杆状病毒序列(图2),表明重组穿梭质粒构建成功。
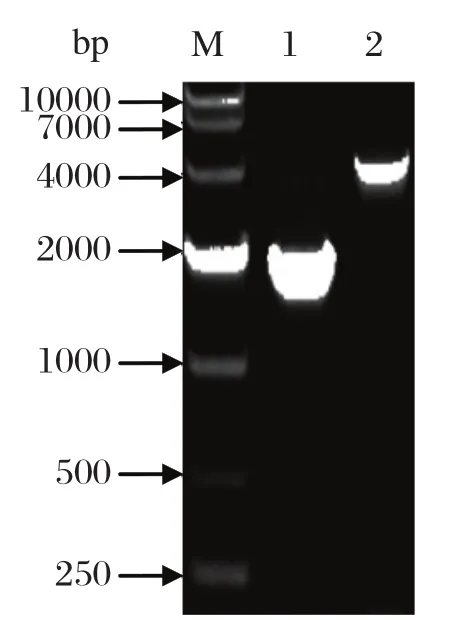
图2 重组穿梭质粒reBacmid-SjHSP70的PCR鉴定Fig.2 Identifi cation of recombinant bacubvirus reBacmid-SjHSP70 by PCR
2.3 间接免疫荧光(IFA)检测SjHSP70蛋白在Sf9细胞中的表达用原核表达的SjHSP70蛋白免疫BALB/c小鼠制备的血清做一抗,IFA检测SjHSP70蛋白在Sf9细胞中的表达情况,结果表明,reBacmid-SjHSP70重组杆状病毒感染的Sf9细胞能产生特异性的绿色荧光,而pFastBacHTA空载体感染Sf9细胞未出现荧光反应(图3),说明SjHSP70蛋白在昆虫细胞中表达。
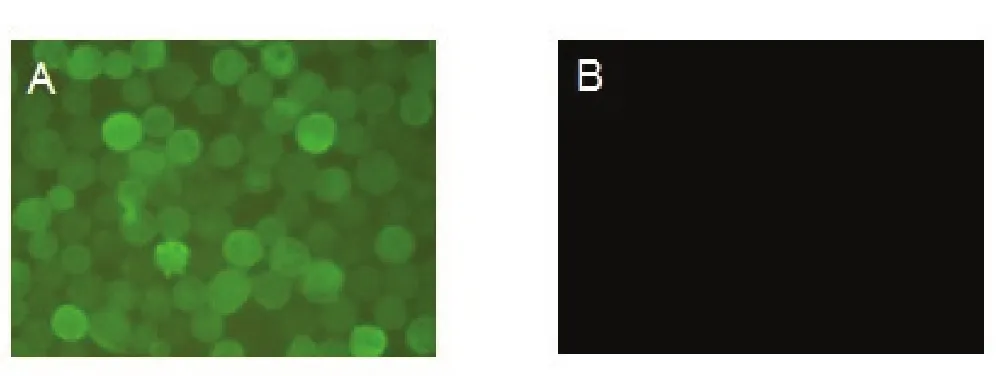
图3 IFA分析SjHSP70在Sf9细胞中表达(×200)Fig.3 The expression of SjHSP70 by IFA in Sf9 cells
2.4 SjHSP70蛋白的纯化将His柱纯化的SjHSP70重组蛋白SDS-PAGE电泳,可见一条大小约为72 kDa的单一条带(图4),分子量与预期大小相符。转染12个75 cm2细胞培养瓶Sf9细胞可得到约800μg纯度较高的蛋白。
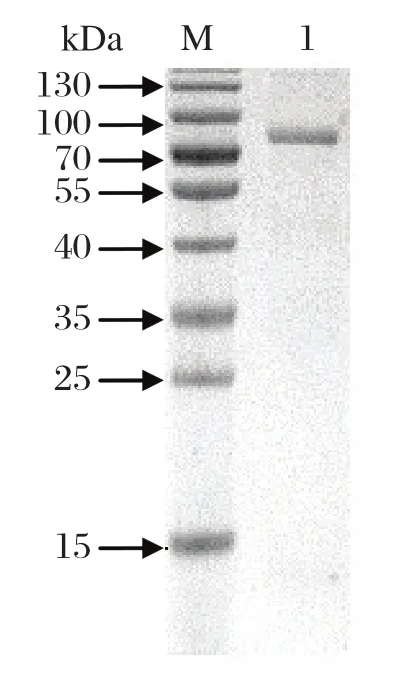
图4 SDS-PAGE电泳分析SjHSP70蛋白的纯化Fig.4 Identifi cation of Purifi ed SjHSP70 protein by SDS-PAGE analysis
2.5 纯化蛋白的Western blot分析纯化的SjHSP70蛋白SDS-PAGE电泳,转膜封闭。以感染日本血吸虫42 d的小鼠阳性血清作一抗,Western blot结果显示大小约为72 kDa的单一条带(图5),表明在Sf9细胞中表达的SjHSP70蛋白可被日本血吸虫感染的鼠的阳性血清识别,具有较好的免疫原性。

图5 Western blot分析SjHSP70蛋白的免疫原性Fig.5 Immunogenicity analysis of SjHSP70 by Western blot
3 讨论
对细菌、真菌、原虫和哺乳动物等物种的热休克蛋白进行的大量研究显示[9,10],热休克蛋白70(HSP70)是一类结构十分保守的分子,一般由3个功能上不同的结构域所构成,即N-端ATP酶结构域、肽结合结构以及C-端结构域[11]。HSP70具有多种生物学功能,除作为分子伴侣参加蛋白分子的折叠和去折叠功能外[11],还具有激活先天免疫系统(包括巨噬细胞和淋巴细胞的活化以及树突细胞的活化与成熟等)、参与抗原提呈和交叉提呈以及自身免疫和抗肿瘤免疫等功能[12]。特别是在各种应急条件(如环境的紫外辐照、病理的感染等)刺激下出现在胞外的HSP70分子,在活化先天免疫系统中起到十分重要的作用,HSP70分子既可以像“危险”信号一样直接刺激先天免疫系统的细胞,又可以通过与其结合的所谓的“伴侣肽”形成的复合物来增强伴侣肽抗原被APC(如巨噬细胞和树突状细胞)的处理和提呈能力[13]。
日本血吸虫的SjHSP70分子是否也具有活化宿主树突细胞和增强其伴侣肽被DC处理及提呈的功能,从而在RA血吸虫疫苗中发挥了重要作用,有待我们进一步验证。据文献报道,来源于细菌的脂多糖可通过TLR2或TLR4等信号受体介导的途径激活宿主的DC形成Th1应答环境[14],这与已报道的一些细菌和原虫的HSP70诱生的免疫应答的功能和机制相类似[15]。因此,为排除脂多糖的干扰,最好采用真核表达的SjHSP70为材料来开展相关的工作。在本实验中,我们采用昆虫杆状病毒表达系统构建了含SjHSP70的真核表达载体,在昆虫细胞Sf9中成功表达了SjHSP70分子。我们用分离纯化的蛋白进行了Western blot分析,确定了表达的蛋白具有较好的抗原性。另外,我们发现,用该系统表达的目的蛋白经纯化后的得率相对较高,可以满足后续实验要求,而用该系统表达的蜱来源的某些蛋白的得率很低[16],这可能与目的蛋白的理化特性有关。采用本实验得到的重组SjHSP70刺激小鼠DC成熟的研究正在进行中。
总之,本研究在真核细胞Sf9中成功表达了SjHSP70,同时纯化和鉴定了重组蛋白,为进一步研究SjHSP70活化宿主DC等免疫学功能提供了材料。
[1]Wang L D, Chen H G, Guo J G.A strategy to control transmission ofSchistosoma japonicumin China [J].The New England Journal of Medicine, 2009, 360(2): 121-128.
[2]McManus D P, Loukas A.Current status of vaccines for schistosomiasis[J].Clin Microbiol Rev, 2008, 21(1): 225-242.
[3]Wilson R A, Coulson P S.Immune effector mechanisms against schistosomiasis: looking for a chink in the parasite's armour[J].Trends Parasitol, 2009, 25(9): 423-431.
[4]Hedstrom R, Culpepper J, Harrison R A,et al.A major immunogen inSchistosoma mansoniinfections is homologous to the heat-shock protein Hsp70[J].J Exp Med, 1987, 165(5): 1430-1435.
[5]Yang L L, Lv Z Y, Hu S M,et al.Schistosoma japonicum:proteomics analysis of differentially expressed proteins from ultraviolet-attenuated cercariae compared to normal cercariae[J].Parasitol Res, 2009, 105(1): 237-248.
[6]He S J, Yang L L, Lv Z Y,et al.Molecular and functional characterization of a mortalin-like protein fromSchistosoma japonicum(SjMLP/hsp70) as a member of the HSP70 family[J].Parasitol Res, 2010, 107(4): 955-966.
[7]李莹, 李运燕, 徐瑞敏, 等.日本血吸虫钙网织蛋白在Sf9昆虫细胞中的表达及其活化树突细胞的初步分析[J].中国动物传染病学报, 2012, 20(4): 45-51.
[8]何思杰, 杨琳琳, 吕志跃, 等.日本血吸虫热休克蛋白70(HSP70)的生物信息学分析及原核表达及纯化[OL]:http://www.paper.edu.cn/releasepaper/content/200901-884/2009-01-19.
[9]Stewart G R, Young D B.Heat-shock proteins and the host-pathogen interaction during bacterial infection[J].Curr Opin Immunol, 2004, 16(4): 506-510.
[10]Fumie A, Martha S, Rodriguez P,et al.Toxoplasma gondii-derived heat shock protein 70 stimulates maturation of murine bone marrow-derived dendritic cells via toll-like receptor 4[J].Cell Stress & Chaperones,2006, 11(1): 13-22.
[11]杨洁, 吴忠道.热激蛋白70(HSP70)及血吸虫HSP70研究进展[J].国际医学寄生虫病杂志, 2011, 11(39): 360-364.
[12]Bolhassani A, Rafati S.Heat-shock proteins as powerful weapons in vaccine development[J].Expert Rev Vaccines,2008, 7(8): 1185-1199.
[13]Tobian A A, Canaday D H, Harding C V.Bacterial heat shock proteins enhance class II MHC antigen process and presentation of chaperoned peptides to CD4+T cells[J].Immunol, 2004, 173(8): 5130-5137.
[14]刘中原, 李延平.细菌脂多糖的生物活性及作用机制[J].医学综述, 2010, 16(2): 166-169.
[15]Uto T, Tsujimura K, Uchijima M,et al.A novel vaccine strategy to induce mycobacterial antigen-specific Th1 responses by utilizing the C-terminal domain of heat shock protein 70[J].FEMS Immunol Med Microbiol,2011, 61(2): 189-196.
[16]杨斯琦,周勇志, 张厚双, 等.抗菌肽M50基因在Bac-To-Bac杆状病毒系统中的表达[J].中国动物传染病学报, 2010, 18( 5): 49- 53.
