应用TaqMan荧光定量RT-PCR方法检测PRRSV变异株在莱芜黑猪体内动态分布
2013-07-04李井新谢之景姜运良成子强周恩民姜世金
王 辉,李井新,孙 振,谢之景,姜运良,成子强,周恩民,姜世金
(山东农业大学动物医学院,泰安271018;2.山东省动物生物工程与疾病防治重点实验室,泰安271018;3.西北农林科技大学动物医学院,杨凌 712100)
猪繁殖与呼吸综合征病毒(Procine reproductive and respiratory syndrome virus,PRRSV)属于套式病毒目、动脉炎病毒科、动脉炎病毒属成员,为单股正链RNA 病毒,主要引起母猪的繁殖障碍,如流产、早产、死胎、木乃伊胎和呼吸道症状等,称为猪繁殖与呼吸综合征(procine reproductive and respiratory syndrome,PRRS)[1]。PRRSV主要分为欧洲型和美洲型,1996年在国内首次分离到PRRSV,目前在我国流行的PRRSV 主要为美洲型[2]。2006年,无名高热病在我国南方流行,最终确定为PRRSV高致病性nsp2变异株[3]。目前, 常用的诊断方法有RTPCR、间接免疫荧光试验、血清中和试验、酶联免疫吸附试验、荧光定量RT-PCR等[4-15]。
莱芜猪是我国华北型地方猪种黄淮海黑猪的一个类群,具有繁殖率高、哺育力强、耐粗料、抗病性强、杂交优势明显、肉质细嫩香醇等特性,近年来作为优良地方品种猪得到了大规模养殖。本试验是将PRRSV接种到莱芜黑猪健康仔猪体内,利用TaqMan探针荧光定量RT-PCR方法以检测PRRSV在体内的分布及增殖规律变化,为进一步研究该病毒的致病机理,科学防控该病在莱芜黑猪中的感染提供理论依据。
1 材料和方法
1.1 病毒株及实验动物高致病性PRRSV JXl43变异株由山东省动物生物工程与疾病防治重点实验室保存;40日龄健康仔猪购自莱芜黑猪保种基地猪场。
1.2 主要试剂High Pure RNA Tissue Kit、Transcriptor First Strand cDNA Synthesis Kit 和 FastStart TaqMan Probe Master购自Roche公司;质粒提取试剂盒购自TaKaRa公司。
1.3 引物和探针的合成按GeneBank中发表的参考序列,在保守区分别设计引物和探针,由上海金斯瑞生物科技有限公司合成。PRRSV-F:5'-CGGCAAAT ATAACCACGC-3',PRRSV-R:5'-TTCTGCCACCCAACACGAG-3';另外,针对ORF7基因序列设计一对制备标准品的引物:PF:5'-CCTTCGGGTACATGACATTCGT-3';PR:5'-TTGCTGCTTGCCGTTGTTATT-3';探针PRRSV-P序列为:5'-FAM-TGCCGTTGACC GTAGTGGAGCC-TAMRA-3'。
1.4 阳性标准品的制备用常规PCR反应扩增PRRSVORF7基因,用DNA回收试剂盒回收目的片段,然后连接到pMD18-T载体中,转化DHl0α感受态细胞。阳性重组质粒经EcoRⅠ酶切鉴定后,由上海生工生物工程有限公司测序。提取质粒的大约浓度为7×1010copies/μL。
1.5 荧光定量PCR反应条件的优化用矩阵法对荧光定量PCR 的循环参数、引物和探针浓度以及所选引物与探针的组合等进行筛选优化,以得到最佳的荧光定量PCR反应条件。
1.6 标准曲线的绘制以10倍稀释已知拷贝数的质粒为模板,经荧光定量PCR仪检测,得到动力学曲线,并计算出相应的标准曲线。
1.7 灵敏性试验将已计算出拷贝数的含目的基因的质粒做10倍梯度稀释,稀释至用荧光定量PCR仪不能检出,以此计算出荧光定量PCR所能检出的最低模板拷贝数。
1.8 特异性试验以猪瘟病毒(Classical swine fever virus,CSFV)、日本乙型脑炎(Japanese encephalitis virus,JEV)、圆环病毒 2 型(Porcine circovirus ,PCV2)和PRRSV JXl43株的核酸为模板,应用优化的荧光定量PCR条件进行特异性试验。
1.9 重复性试验以 RNA 标准品(103~107拷贝 /μL)为模板,进行重复性试验。
1.10 实验动物分组及感染试验40日龄健康莱芜黑猪仔猪15头,经RT-PCR和ELISA检测为PRRSV阴性。随机分为2组,攻毒组10头,对照组5头,分别人工鼻腔接种5 mL/头PRRSV液和PBS。于攻毒后第3、7、14、21、28 d各剖杀攻毒组猪2头,对照组猪1头,分离心脏、肝脏、脾脏、肺脏、肾脏、扁桃体、颌下淋巴结、腹股沟淋巴结和肠系膜淋巴结等组织备用。
1.11 临床症状观察及剖检变化实验过程中,每日观察实验猪的临床症状,并作好记录。每日定时测定实验组与对照组的直肠体温、观察精神状况、食欲等。剖杀时,对比观察肺脏、肝脏、肾脏和主要免疫器官,如扁桃体、下颌淋巴结、肺门淋巴结、腹股沟淋巴结、肠系膜淋巴结和脾脏等。
1.12 病毒RNA的提取及反转录取感染后不同时间采集的各器官,按照 High Pure RNA Tissue Kit说明书提取总RNA。利用随机引物进行反转录,程序为:25℃ 10 min,55℃ 1 h,85℃ 5 min。
1.13 各组织中病毒载量的检测以各组织反转录产物为模板进行荧光定量RT-PCR检测。
2 结果与讨论
2.1 荧光定量PCR反应条件荧光定量PCR反应液用Roche 公司生产的 FastStart TaqMan Probe Master试剂盒。筛选出的最佳反应体系:RNA模板2 μL,PRRSV-F/PRRSV-R(10 pmol/μL) 各 1 μL,TaqMan 探针(10 pmol/μL)0.4 μL。循环参数:95℃ 1 min;95℃ 10 s,60℃ 30 s,40 个循环;每个循环后检测荧光。
2.2 标准曲线的建立取浓度为 104~108拷贝 /μL 的标准品模板进行荧光定量PCR扩增并建立标准曲线。得到的标准曲线方程为y=-3.1843x+39.241867,相关系数为R2=0.99,见图1。
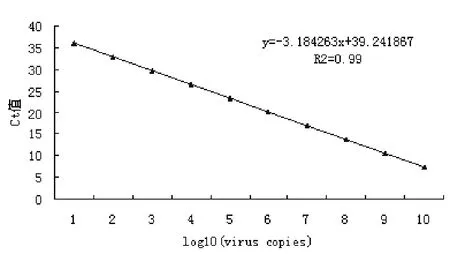
图1 绘制的标准曲线Fig.1 The standard curve established from the abovemention result
2.3 灵敏性试验将系列稀释的RNA标准品,用建立的荧光定量PCR方法进行检测,结果显示本方法比普通PCR方法高10~100倍,具有较好的灵敏度。
2.4 特 异 性 试 验CSFV、JEV、PCV2和 PRRSV JXl43核酸作为模板,利用荧光定量PCR方法进行检测,其中,PRRSV的检测结果为阳性,而其他病毒核酸的结果均为阴性,表明该方法具有较好的特异性。
2.5 重复性试验用荧光定量PCR对标准品进行了重复性检测,并对检测结果进行了统计学分析。结果,见表1。

表1 PRRSV标准品的重复性测定Table 1 Ct value of PRRSV standard preparation
2.6 临床症状及剖检变化攻毒后3 d,实验组猪出现不同程度的精神沉郁、食欲下降、饮水减少,部分仔猪下痢,日渐消失。攻毒后7 d,猪出现咳嗽、眼角分泌物增多。攻毒后14 d,实验组猪体温明显升高。但整个实验过程中并未出现瘫痪、耳部和皮肤发绀等蓝耳病的典型症状。实验组猪出现典型的肺出血、淤血病变、弥漫性间质性肺炎;皮下、扁桃体、肝脏均出现出血点和出血斑;全身淋巴结都有不同程度的淤血、出血、肿胀,有点呈现暗红色(见图2)。
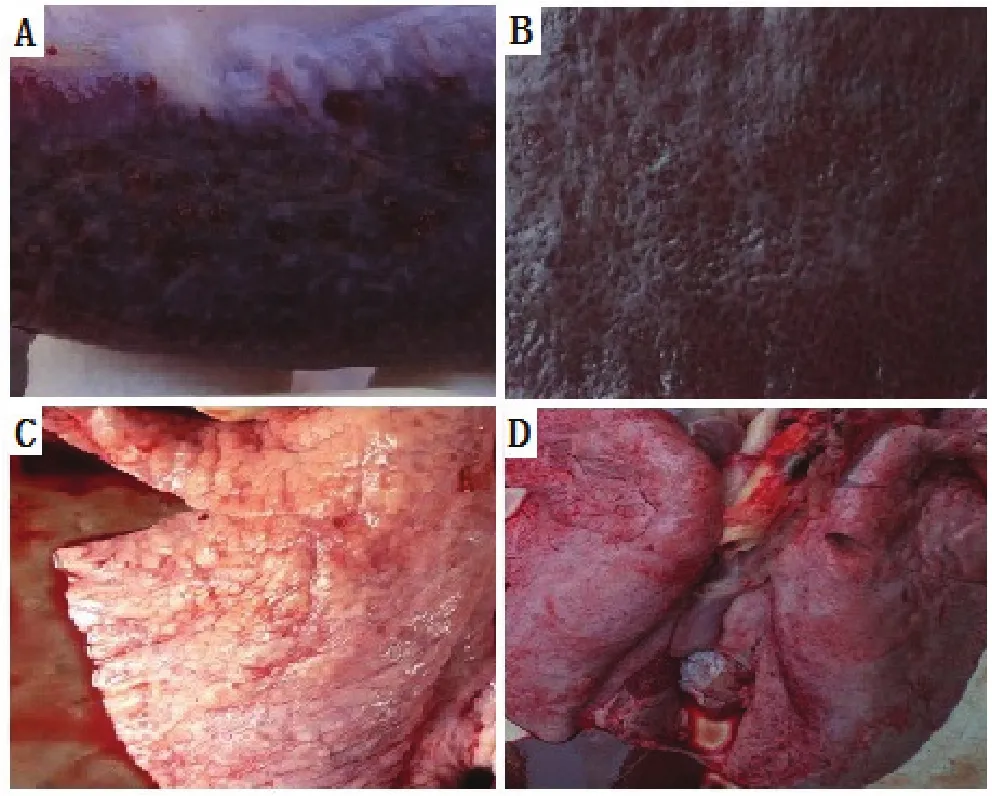
图2 莱芜黑猪剖检病理变化Fig.2 Anatomic pathological changes of Laiwu black pigs
2.7 各脏器和淋巴结中病毒载量莱芜黑猪攻毒PRRSV后,不同时间各种组织中的病毒核酸拷贝数,见表2。由表2可知,攻毒后d 3各组织中均检测到病毒核酸存在。攻毒后d 7,在各组织中病毒载量明显增高,扁桃体、下颌淋巴结、腹股沟淋巴结和肠系膜淋巴结等淋巴组织中的病毒载量均达到107拷贝/g以上,心脏、肝脏、肾脏、脾脏、下颌淋巴结和肠系膜淋巴结在攻毒后d 7达到该组织病毒载量最高值,而肺脏和扁桃体在攻毒后d 14达到病毒载量最高,另外腹股沟淋巴结的病毒载量在攻毒后d 21 达到最高值。
整体来看,攻毒后d 7~21,各种组织中的病毒载量维持在较高水平,而攻毒后d 28时,多数组织中的PRRSV病毒含量明显下降。扁桃体、下颌淋巴结、腹股沟淋巴结和肠系膜淋巴结等淋巴组织中的病毒载量要明显高于其他脏器,显示PRRSV在感染莱芜黑猪后具有淋巴组织组织嗜性。
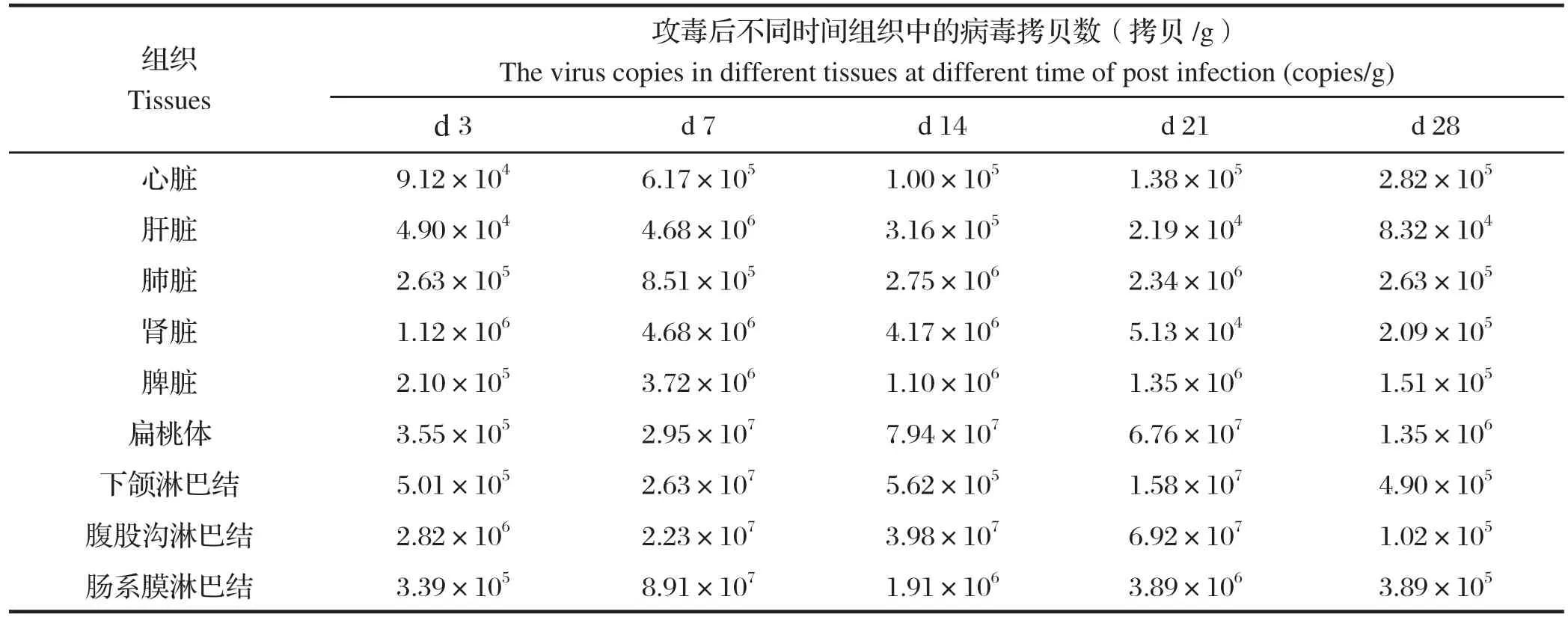
表2 攻毒后各组织中病毒拷贝数Table 2 Virus copies in different tissues after infection
2.8 PRRS是一种困扰我国养猪业健康发展的重要免疫抑制病,PRRSV单独感染能引起免疫器官以淋巴细胞及巨噬细胞变性坏死为特征的急性炎症变化,造成免疫损伤,进而引起免疫抑制[16]。感染PRRSV后猪体在接种其他疫苗时不能产生正常的细胞和体液免疫反应,容易继发其他病原的感染[6]。
实时荧光定量PCR技术相对于常规PCR等病原检测方法,不仅有着更高的特异性和灵敏度,而且大大缩短了检测时间,还可应用于病毒隐性感染和早期感染的诊断[17]。基于SYBR Green法的荧光定量PCR分析融解曲线显示,两种不同型PRRSV分别得到不同的融解温度,可用于PRRSV的流行病学调查[18]。本研究建立的Taqman探针实时荧光定量RT-PCR检测PRRSV的方法相对于SYBR Green法具有更高的特异性,在进行PRRSV定量检测时更加可靠。
莱芜猪是我国华北地区优良地方品种猪,抗病性强是其主要优点之一。本研究以PRRSV攻毒健康莱芜黑猪仔猪,检测攻毒后不同时间段莱芜黑猪各种组织中的病毒核酸载量。结果显示,攻毒后d 3各组织器官中均检测出低拷贝的病毒;攻毒后d 7,各组织中病毒载量明显增高;攻毒后d 7~21,各种组织中的病毒载量维持在较高水平,而在攻毒后d 28时,多数组织中的PRRSV病毒含量明显下降。扁桃体、下颌淋巴结、腹股沟淋巴结和肠系膜淋巴结等淋巴组织中的病毒载量在攻毒d 7后均达到107拷贝/g以上,明显高于其他的组织,表明PRRSV感染莱芜黑猪后各种免疫组织是其侵害的主要部位,并可能因此影响免疫组织发挥免疫调节功能,导致机体的免疫抑制。
危艳武等[15]用高致病性PRRSV变异株攻毒健康仔猪后检测出扁桃体、淋巴结、心脏和肾脏中病毒核酸载量较高,并且扁桃体和淋巴结中病毒核酸载量明显低于肾脏。本研究发现莱芜黑猪心脏中的PRRSV病毒核酸载量在各种组织中较低,且扁桃体和淋巴结中病毒核酸载量在检测周期中多数情况下显著高于肾脏,推测二者差异的主要原因可能是使用的攻毒毒株以及试验动物不同所致。本研究由于试验动物数量所限,某些试验数据波动较大,个体之间差异较为明显,这与危艳武等[15]的试验结果类似。今后的研究中增加试验动物数量是减少个体差异、获得更为客观动物试验结果的有效措施。
[1]Conzelmann K K, Visser N, Van Woensel P,et al.Molecular characterization of porcine reproductive and respiratory syndrome virus, a member of the arterivirus group[J].Virology, 1993, 193(1): 329-339.
[2]姜平, 陈溥言, 蔡宝祥, 等.我国猪繁殖和呼吸综合征病毒基因型鉴定[J].中国兽医学报, 1999, 19(2): 121-123.
[3]李志杰, 丁壮, 孟轲音, 等.PRRSV缺失变异毒株JL/07/SW株的分离鉴定及序列分析[J].中国兽医学报, 2009,29(7): 830-835.
[4]肖跃强, 管宇, 唐娜, 等.PRRSV 经典与高致病性毒株RT-PCR鉴别检测方法的建立[J].中国兽医学报, 2010,30(7): 873-877.
[5]林华, 郭万柱, 韩国全, 等.对PRRSV快速分型的多重RT-PCR方法的建立与应用[J].中国兽医学报, 2011,31(1): 6-10.
[6]牛伟, 丁壮, 王晓莉, 等.实时荧光定量PCR方法检测猪繁殖与呼吸综合征病毒和猪瘟病毒[J].中国兽医学报,2011, 31(2): 174-177.
[7]Chen Y, Tian H, He H J,et al.Indirect ELISA with Recombinant GP5 for Detecting Antibodies to Porcine Reproductive and Respiratory Syndrome Virus[J].Virol Sin, 2011, 26(1): 61-66.
[8]Li X S, Fu F, Lang Y K,et al.Development and preliminary application of an immunochromatographic strip for rapid detection of infection with porcine reproductive and respiratory syndrome virus in swine[J].J Virol Methods, 2011, 176: 46-52.
[9]娄高明, 杜伟贤, 谢明权, 等.猪繁殖与呼吸道综合征RT-PCR 诊断方法的建立[J].中国兽医学报, 2000,20(2): 144-147.
[10]任慧英, 李文立, 杨汉春, 等.猪繁殖与呼吸综合征病毒cDNA 探针的制备及初步应用[J].中国兽医学报, 2000,20(5): 438-440.
[11]王守山, 李玉保, 孟喜龙, 等.猪繁殖与呼吸综合征病毒SYBR GreenⅠ荧光定量RT-PCR方法的建立[J].江西农业大学学报, 2009, 31(6): 1074-1078.
[12]刘长龙, 张建武, 韦祖樟, 等.猪繁殖与呼吸综合征病毒TaqMan荧光定量RT-PCR方法的建立与应用[J].中国预防兽医学报, 2010, 32(11): 858-861.
[13]宋志军, 宋长绪, 杨增岐, 等.猪生殖与呼吸综合征病毒TaqMan 荧光定量RT-PCR检测方法的建立[J].中国兽医科学, 2006, 36(02): 98-102.
[14]荣福龙, 刘永刚, 孙广力, 等.应用荧光定量RT-PCR方法检测PRRSV变异株在仔猪体内动态分布[J].中国预防兽医学报, 2010, 32(9): 681-686.
[15]危艳武, 刘长明, 张朝霞, 等.荧光定量RT-PCR法对高致病性PRRSV变异株感染猪体内分布规律的研究[J].中国兽医学报, 2010, 30(4): 444-448.
[16]熊丁杰, 徐志文, 梅淼, 等.PRRSV 感染致断奶仔猪肺脏和外周免疫器官的病理损伤[J].中国兽医学报, 2011,31(5): 725-729.
[17]Martinez E, Riera P, Sitja M,et al.Simultaneous detection and genotyping of porcine reproductive and respiratory syndrome virus (PRRSV) by real-time RT-PCR and amplicon melting curve analysis using SYBR Green[J].Res Vet sci, 2008, 85: 184-193.
[18]Jothikumar N, Cromeans T L, Robertson B H,et al.A broadly reactive one-step real-time RT-PCR assay for rapid and sensitive detection of hepatitis E virus[J].J Virol Methods, 2006, 131(1): 65-71.
