布鲁氏菌脂多糖及其突变株的研究进展
2013-07-04刘宗平于圣青
张 敏,刘宗平,于圣青
(1.扬州大学兽医学院,扬州 225009;2.中国农业科学院上海兽医研究所,上海 200241)
布鲁氏菌是一种革兰氏染色阴性,胞内寄生的短小杆菌,无鞭毛,不形成芽胞。布鲁氏菌属可分为6个种,即羊种,牛种,猪种,绵羊型副睾种,沙林鼠种和犬种。最近在海洋生物中又分离到海洋型布鲁氏菌。其中,羊种布鲁氏菌和牛种布鲁氏菌的危害较大[1]。布鲁氏菌可感染包括人在内的多种哺乳动物引起布鲁氏菌病。公畜多表现为睾丸炎和附睾炎;母畜多发生流产、早产和死胎;人感染后多引发关节炎、心内膜炎、脑膜炎和神经损伤,且久治不愈[2]。故布鲁氏菌病不仅在畜牧生产上造成巨大的经济损失,而且严重威胁到公共卫生安全[3]。控制并最终消灭布鲁氏菌病的最有效策略是接种疫苗。常用来预防羊种布鲁氏菌病的疫苗株有Rev1[4],预防牛种布鲁氏菌病的疫苗株有S19和RB51[5],但都存在一定的缺点。Rev1是Elbrg等[6]在1957年从链霉素培养基上选育出的光滑型减毒株,对牛种、羊种布鲁氏菌均具有免疫力和保护力,但此菌株作为疫苗仍具有相当的毒力,并且在适当的条件下毒力可以完全恢复,且免疫动物后会干扰临床诊断。S19是1923年在牛奶中发现的有毒菌株,在实验室培养过程中弱化为减毒株,其完整的LPS结构可持续刺激机体产生抗体,对牛有一定的保护力[7]。S19作为疫苗在防治布氏杆菌感染中应用广泛,但其缺点是可引起怀孕母畜流产,且免疫后引起高水平抗体效价,在筛查时难以区分人为免疫和自然感染。RB51是野生毒株S2308在利福平和青霉素抗性选择培养基上多重传代后自发形成的粗糙型菌株,该疫苗可以产生细胞免疫和攻毒保护作用,且不会扰乱常规的诊断方法,但其有抗生素抗性,为临床治疗用药带来困扰。因此,研制更为安全有效、易于临床诊断的布鲁氏菌减毒活疫苗受到广泛关注。布鲁氏菌不存在Ⅰ、Ⅱ型分泌系统,没有毒力岛、菌毛、纤毛、粘附素及毒素等典型的毒力基因,其致病机理主要和胞内存活有关[8]。脂多糖(LPS)是布鲁氏菌外膜的主要成分,在逃逸宿主先天免疫捕获和靶定细菌到复制小环境中起作用[9],是一种重要的毒力因子。LPS的表型分为光滑型和粗糙型两种,对LPS合成所需酶的编码基因进行突变可导致产生结构不完整的LPS,可导致布鲁氏菌的表型由光滑型转变为粗糙型。大部分粗糙型布鲁氏菌菌株的毒力较弱,经常被用作减毒活菌苗候选株进行研究。本文针对布鲁氏菌脂多糖及其突变株的研究进展进行简要综述。
1 布鲁氏菌LPS的结构
LPS对于革兰氏阴性菌外膜的结构和功能完整至关重要[10],由3个保守的结构域,即类脂A(内毒素性质)、核心寡聚糖和O抗原侧链[11]组成。布鲁氏菌LPS的类脂A骨架是由2,3-二氨基-2,3-双脱氧 -D- 葡萄糖构成的,并在 C16:0到 C18:0范围内由饱和脂肪酸修饰,3-OH-C12:0到 29-OH-C30:0范围内由羟化脂肪酸修饰。与经典的革兰氏阴性菌LPS不同,其葡萄糖胺长链与酰基长链是通过单一酰胺键与核心相连,而不是通过酯和酰胺相连[12]。布鲁氏菌LPS核心寡聚糖与类脂A相连,包括甘露糖、葡萄糖、葡糖胺、奎诺糠胺、3-脱氧-D-甘露-2-辛酮糖酸(KDO)和其他未研究清楚的糖残基[10]。光滑型布鲁氏菌LPS的O抗原连在核心寡聚糖上,是1,2-链-4,6-双脱氧-4-甲酰氨基-α-D-甘露吡喃糖亚单位的线性同聚物[13],平均链长96~100个糖基单位(图1)。粗糙型LPS缺少O抗原组分,毒力比光滑型弱。
经典的革兰氏阴性菌LPS是病原相关分子模式,可以被先天免疫系统的病原识别受体感知,触发炎症反应,导致内毒素性质的休克。布鲁氏菌不具备经典的LPS结构,这种结构上的差异是其逃避先天性免疫防线,在宿主细胞内生存、复制并造成慢性感染的原因之一。
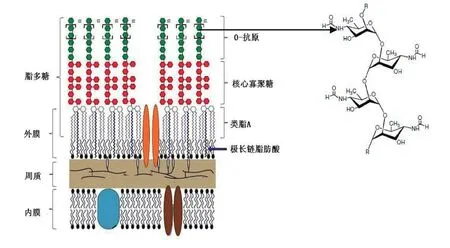
图 1 布鲁氏菌 LPS 结构模式图(引自 Andreas F.Haag “Importance of lipopolysaccharide and cyclic β-1, 2-glucans in Brucella-mammalian infections)Fig.1 The LPS structure of Brucella (From Andreas F.Haag “Importance of lipopolysaccharide and cyclic β-1, 2-glucans in Brucella-mammalian infections)
2 布鲁氏菌LPS的生物合成及所需酶的编码基因
布鲁氏菌LPS的生物合成过程并没有彻底研究清楚,但是现有的研究结果表明其合成过程与经典的革兰氏阴性菌相似,由相关酶类催化在细胞膜内侧合成类脂A,随后在各种糖基转移酶的连续作用下,将糖基合成到类脂A骨架上,最后是将2个KDO残基合成到类脂A骨架上,然后转运到细胞膜周质侧。O抗原在细胞膜内侧以独立的方式合成后连接到类脂A的受体糖上,通过ABC转运系统蛋白转移酶转运到膜的周质侧,在周质侧由蛋白连接酶催化绑定到完整的类脂A/核上[4](图2)。
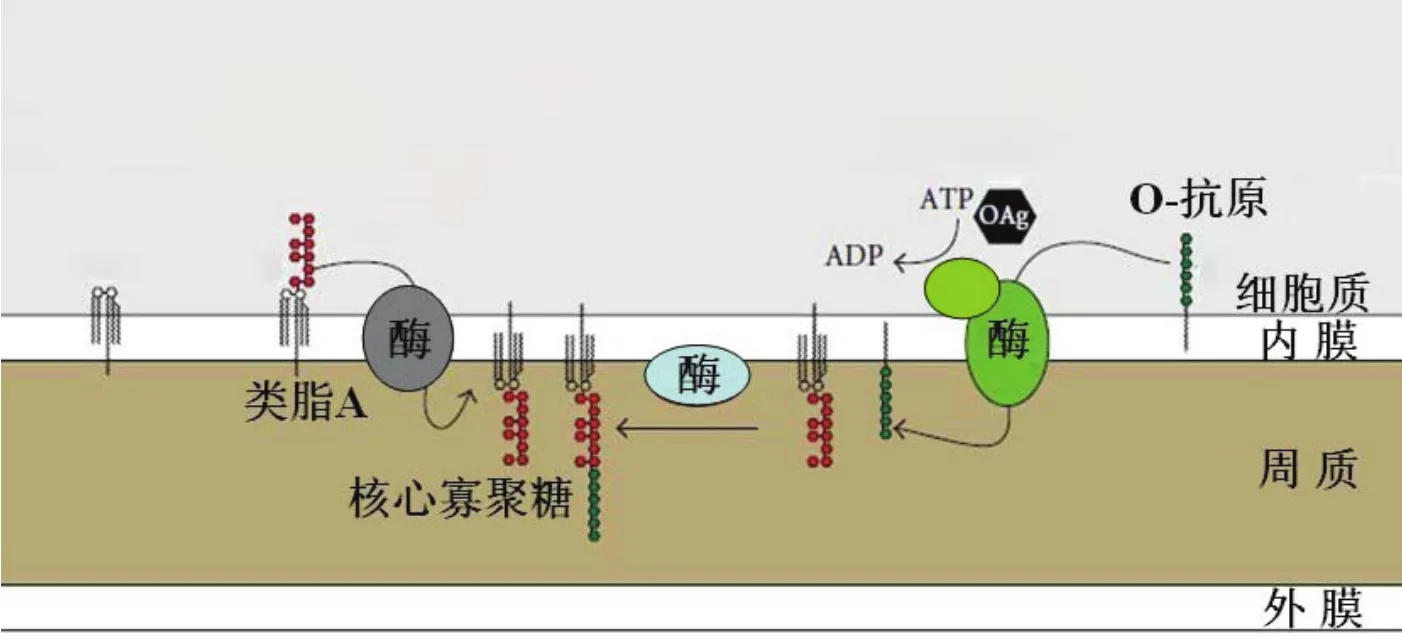
图 2 布鲁氏菌 LPS 合成模式图(引自 Andreas F.Haag “Importance of lipopolysaccharide and cyclic β-1, 2-glucans in Brucella-mammalian infections”)Fig.2 The LPS synthesis mode of Brucella (From Andreas F.Haag “Importance of lipopolysaccharide and cyclic β-1, 2-glucans in Brucella-mammalian infections”)
布鲁氏菌仅以葡萄糖作为碳源,其将葡萄糖转变为其他糖分子从而合成LPS。布鲁氏菌LPS的合成涉及多种酶类,已报道的有磷酸葡萄糖变位酶(pgm)、甘露糖基转移酶(wa**)、磷酸甘露糖异构酶(manAOAg)、磷酸甘露糖变位酶(manBOAg/pmm/ manBcore)、甘露糖-1-磷酸鸟嘌呤转移酶(manCOAg/manCcore)、GDP甘露糖脱水酶(gmd)、过骨胺合成酶(per)、甲酰基转移酶(wbkC)、糖基转移酶(wbkA/wbkE/wboA/wboB)、异构酶/脱水酶(wbkD)和ABC转运系统蛋白转移酶(wzm/wzt)等[5,9,14]。这些酶的编码基因广泛分布于布鲁氏菌的两条染色体上[15],类脂A/核合成所涉及酶的编码基因分别位于染色体Ⅰ和染色体Ⅱ上,而O抗原合成所涉及酶的编码基因大部分在染色体Ⅰ的wbk区域,还有两个糖基转移酶编码基因位于染色体Ⅰ的wbo区域。布鲁氏菌LPS合成过程中涉及酶的编码基因命名规则为(1),编码类脂A合成早期所需酶的基因一般命名为lpx*;(2),编码类脂A合成晚期所需酶的基因,或参与O抗原连接到类脂A/核上的基因命名为wa**;(3),编码O抗原合成过程中所涉及酶的基因命名为wb**;(4),编码O抗原处理过程中所涉及酶的基因命名为wz*[16]。此外,编码前期途径所需酶的基因符合常规命名法,例如man*参与甘露糖(mannitose)合成,per为过骨胺(perosamine)合成酶编码基因。
在初步了解布氏杆菌LPS生物合成过程的基础上,对其合成所涉及酶的编码基因进行分类,对参与LPS同一结构域合成酶的编码基因分别突变,得到不同的突变株,对其功能进行比较,有助于了解LPS三个结构域在逃避先天性免疫防线、在宿主细胞内生存起的作用,是分析布鲁氏菌致病机理的手段之一。
3 布鲁氏菌LPS突变株
布鲁氏菌LPS是一种重要的毒力因子,对其合成所需酶的编码基因进行突变可导致产生毒力减弱的粗糙型突变株,因此经常被用于减毒活菌苗的研究。在了解布鲁氏菌LPS的结构和生物合成之后,研究者们对其合成所需酶的编码基因进行各种突变,产生多株相应的缺失株。这些缺失株大致可以分为三类,即:(1)LPS的类脂A/核有不同程度的缺失,伴随/不伴随O抗原在胞质侧积聚;(2)LPS的类脂A/核完整,但O抗原侧链缺失;(3)LPS的类脂A/核完整,但O抗原侧链以游离状态存在。下面逐一进行阐述。
3.1 类脂A/核合成相关基因突变株pgm编码磷酸葡萄糖变位酶,参与ADP-葡萄糖、UDP-葡萄糖和UDP-半乳糖的生成,为寡聚糖链和O抗原合成提供必需的原材料。Juan E.Ugalde等[17]通过插入庆大霉素抗性盒诱变牛种布鲁氏菌pgm基因,获得B2211突变株。该突变株O抗原不完整,为粗糙型,其在小鼠体内不能存活,但在HeLa细胞中可以复制,证明该缺失株并没有改变细菌的侵袭力和细胞内增殖情况。David González等[14]通过转座子插入的方法在羊种布鲁氏菌中诱变pgm基因,得到类脂A/核和O抗原均不完整的粗糙型突变株,该突变株在小鼠体内减毒并最终被清除,对羊种布鲁氏菌产生强于PBS对照弱于Rev1的保护力。Allen等[18]使用转座子诱导突变技术获得多株牛种布鲁氏菌粗糙型突变株,其中一株的Pmm/manB基因由于转座子插入而失活,使得磷酸甘露糖变位酶无法合成,导致6-磷酸-甘露糖、1-磷酸-甘露糖无法转化,产生一株类脂A/核不完整、O抗原不存在的粗糙型突变株,该缺失株在小鼠体内存活能力下降,并且对多粘菌素B敏感性增加。Monreal等[19]用转座子插入方法突变了牛种布鲁氏菌5个基因,其中manBcore突变株LPS缺少外核抗原表位,在小鼠体内减毒,但对牛种布鲁氏菌没有有效的保护力。Raquel Conde-lvarez等[11]运用结合转导的方法得到牛种布鲁氏菌糖基转移酶编码基因wadC的缺失株,该缺失株类脂A/核突变但不引起O抗原改变,在BALB/c小鼠和DC细胞上毒力减弱,且诱导强烈的促炎反应,证明了布鲁氏菌LPS的核起到抵抗先天免疫识别的屏障作用。上述研究结果表明完整的类脂A/核对产生高效免疫保护作用十分重要。
3.2 O抗原合成相关基因突变株wbkA、wbkC、wbkD、wbkE、wbkF、manAO-Ag、manBO-Ag、manCO-Ag、wboA和per等基因参与O抗原的生物合成。wbkA基因编码N甲酰基-过骨胺酰转移酶,Monreal[19]等以带有卡那霉素抗性的Tn5转座子插入牛种布鲁氏菌的wbkA基因,得到O抗原缺失的BA2.17减毒疫苗株,对牛种布鲁氏菌产生强于PBS对照弱于S19、RB51的保护力。Godfroid等[13]获得了羊种布鲁氏菌的wbkB基因缺失株,但其LPS结构并未发生变化。wbkC编码转甲酰酶,在LPS的O抗原链合成时GDP-4-氨基-4,6-双脱氧甘露糖转化为GDP-4-甲酰氨基-4,6-双脱氧甘露糖过程中起催化作用,Thaís Lourdes等[5]采用同源重组的方法获得牛种布鲁氏菌的wbkC基因突变株。该突变株为不具有利福平抗性的粗糙型菌株,可在小鼠体内产生与RB51相似但弱于S19的保护性,并且不会干扰血清学诊断,是较为理想的疫苗候选株。González等[14]通过Tn5转座子随机突变构建缺失库,在wbk区域又鉴定到wbkD、wbkE、wbkF以及manAO-Ag、manBO-Ag、manCO-Ag等基因。其中wbkD与奎诺糠胺合成有关;wbkF参与催化乙酰化氨基糖转移,从而启动O抗原侧链聚合;manAO-Ag、manBO-Ag、manCO-Ag参与葡萄糖转化为O抗原合成原料甘露糖。Vemulapalli等[20]鉴定牛种布鲁氏菌RB51是wboA基因缺失株,而McQuiston等[21]在牛种布鲁氏菌S2308 得到的wboA缺失株并不像RB51一样减毒,但产生的保护性高于RB51。这表明布鲁氏菌RB51株还有一个附加基因发生遗传变异,该基因可能参与O抗原转移,也可能参与抗原与类脂A/核偶联。Winter等[22]在羊种布鲁氏菌和猪种布鲁氏菌上缺失wboA分别产生粗糙型缺失株VTRM1和VTRS1,但未检测到类脂A /核和O抗原缺失。per编码过骨胺合成酶,作为甲酰基作用的底物,进一步聚合形成O抗原。Godfroid等[23]完全裂解per使16M马耳他布鲁氏菌丧失了O链生物合成的能力,并证明了该基因突变只影响O抗原早期的生物合成,不影响O链转移到外膜。
3.3 O抗原转运相关基因突变株由于布鲁氏菌特殊的O抗原结构,其合成后连接到类脂A/核上是所谓的ABC转运系统依赖型机制。rfbD(wzm)和rfbE(wzt)分别合成ABC型转运系统运载体和ABC型转运系统ATP酶,参与LPS的O抗原从细胞膜内侧转运到周质侧,并为之提供能量。Godfroid等[13]对羊种布鲁氏菌16M菌株进行wzm和wzt基因突变,获得了粗糙表型的缺失株,该缺失株与光滑型LPS的O抗原单克隆抗体无反应性,表明在细菌表面缺失O抗原。Zhang等[24]应用同源重组的方法以SacB反向筛选基因构建了牛种布鲁氏菌S2308株的rfbD(wzm)和rfbE(wzt)的无痕缺失株,并证明了其为粗糙型减毒株,免疫小鼠可获得100%的攻毒保护。
通过缺失LPS合成所需酶的编码基因得到不同类型的突变株,对其功能进行比较。结果证明不仅布鲁氏菌LPS的O-抗原,其类脂A及核心寡聚糖均与布鲁氏菌的毒力相关。因此,在设计减毒活疫苗候选株时,要充分考虑布鲁氏菌LPS的结构、生物合成和所涉及酶编码基因,以便得到效果最佳的粗糙型疫苗候选株。
4 布鲁氏菌脂多糖突变株的应用展望
布鲁氏菌病为人畜共患病,该病严重威胁着畜牧业的健康发展,同时影响着人类的公共卫生安全。在该病的多发疫区,使用疫苗是有效的防控方法。传统的减毒活菌疫苗有很好的免疫保护能力,但存在残余毒力强、干扰血清学诊断、引起动物流产等诸多缺陷。由于布鲁氏菌为胞内寄生菌,机体清除该菌主要依靠细胞免疫,故对布鲁氏菌病疫苗的研究主要集中在构建、筛选和鉴定减毒疫苗候选株[25]。
布鲁氏菌脂多糖的内毒素性质要比其他革兰氏阴性菌的弱几百倍,而且其能够抑制补体和抗菌肽对菌体的攻击,通过抑制细胞因子之类的免疫介质合成来抑制宿主的先天免疫,从而帮助细菌存活。因此,布鲁氏菌LPS是一种重要的毒力因子。脂多糖由三个结构域组成,大量结果已经证明不仅O抗原,布鲁氏菌LPS的类脂A/核也与其毒力息息相关。所以,针对目前了解的布鲁氏菌脂多糖的结构、生物发生和合成所需酶编码基因去设计构建最大程度减毒、安全性和保护性最佳的突变疫苗株意义重大。布鲁氏菌脂多糖粗糙型突变株作为疫苗候选株的优势在于:(1)能激发宿主对细菌的天然免疫,在宿主体内持续存活并最终被清除,刺激机体产生全面而持久的免疫力;(2)可产生高效的保护效果,但不干扰临床诊断;(3)反向遗传技术的应用避免了偶尔毒力回复的问题。但同时布鲁氏菌脂多糖突变株作为疫苗也存在潜在的缺陷。(1)如果粗糙型减毒株对人畜具有感染性,标准血清无法监测到;(2)虽然普遍观点认为体液免疫在布鲁氏菌感染中不起作用,但现在的研究并不能完全否定针对O抗原产生抗体的作用;(3)粗糙型减毒株在体内清除过快,可能会导致抗原刺激不足。此外,粗糙型减毒株对光滑型强毒株感染的不同动物产生的保护力存在差别。目前,可以通过运用选择性培养基分型、有针对性的PCR扩增以及应用LPS其他结构的抗体进行血清学诊断等方法监测具有感染性的粗糙型减毒缺失株;同时不同缺失株保护力存在差别说明不只O抗原,类脂A、核心寡聚糖结构也与毒力相关;但是针对O抗原产生的抗体在布鲁氏菌感染中的作用还需要进一步探究。
LPS是布鲁氏菌主要致病因子,通过突变相关基因产生粗糙型减毒缺失株,可以为研制布鲁氏菌病减毒活疫苗提供物质基础,但是若要在临床上广泛应用还需要更深入的研究。
[1]赵忠鹏, 王希良.布鲁菌毒力因子研究进展[J].微生物学免疫学进展, 2007, 35(1): 50-53.
[2]Corbel MJ.Brucellosis: an overview[J].Emerg Infect Dis,1997, 3(2): 213.
[3]胡森, 步志高.布氏杆菌病概况及其研究进展[J].畜牧兽医科技信息, 2003, 12(9): 63-65.
[4]Moriyón I, Grilló M J, Monreal D,et al.Rough vaccines in animal brucellosis: structural and genetic basis and present status[J].Vet Res, 2004,35(1): 1-38.
[5]Lacerda TLS, Cardoso P G, Augusto de Almeida L,et al.Inactivation of formyltransferase (wbkC) gene generates a Brucella abortus rough strain that is attenuated in macrophages and in mice[J].Vaccine, 2010, 28(34):5627-5634.
[6]邓文星, 李芳, 苏益琼, 等.浅谈布鲁氏菌疫苗的研究进展[J].中国畜禽种业, 2012,(4): 42-43.
[7]罗德炎, 韩玉霞, 王希良.布氏杆菌病新型疫苗的研究进展[J].免疫学杂志, 2004, 20(3): 43-45.
[8]钟志军, 陈泽良, 黄克和, 等.布氏杆菌病致病因子及防治研究进展[J].畜牧与兽医, 2009, 40(12): 96-101.
[9]Haag A F, Myka K K, Arnold M F F,et al.Importance of lipopolysaccharide and cyclic β-1, 2-glucans in Brucella-mammalian infections[J].Int J Med Microbiol,2010, 10:1-12.
[10]Cardoso P G, Macedo G C, Azevedo V,et al.Brucella spp noncanonical LPS: structure, biosynthesis, and interaction with host immune system[J].Microb Cell Fact, 2006,5(1): 13.
[11]Conde-Alvarez R, Arce-Gorvel V, Iriarte M,et al.The lipopolysaccharide core of Brucella abortus acts as a shield against innate immunity recognition[J].PLoS Pathogens, 2012, 8(5): 1-14.
[12]Keleti G, Feingold D S, Youngner J S.Interferon induction in mice by lipopolysaccharide from Brucella abortus[J].Infect Immun, 1974, 10(1): 282-283.
[13]Godfroid F, Cloeckaert A, Taminiau B,et al.Genetic organisation of the lipopolysaccharide O-antigen biosynthesis region of Brucella melitensis 16M (wbk)[J].Res Microbiol, 2000, 151(8): 655-668.
[14]González D, Grilló M J, De Miguel M J,et al.Brucellosis vaccines: assessment of Brucella melitensis lipopolysaccharide rough mutants defective in core and O-polysaccharide synthesis and export[J].PLoS One,2008, 3(7): e2760.
[15]Zygmunt M S, Blasco J M, Letesson J J,et al.DNA polymorphism analysis of Brucella lipopolysaccharide genes reveals marked differences in O-polysaccharide biosynthetic genes between smooth and rough Brucella species and novel species-specific markers[J].BMC Microbiol, 2009, 9(1): 92.
[16]Reeves P R, Hobbs M, Valvano M A,et al.Bacterial polysaccharide synthesis and gene nomenclature[J].Trends Microbiol, 1996, 4(12): 495-503.
[17]Ugalde J E, Czibener C, Feldman M F,et al.Identification and characterization of the Brucella abortus phosphoglucomutase gene: role of lipopolysaccharide in virulence and intracellular multiplication[J].Infect Immun, 2000, 68(10): 5716-5723.
[18]Allen C A, Adams L G, Ficht T A.Transposon-Derived Brucella abortusRough Mutants Are Attenuated and Exhibit Reduced Intracellular Survival[J].Infect Immun,1998, 66(3): 1008-1016.
[19]Monreal D, Grillo M, Gonzalez D,et al.Characterization of Brucella abortus O-polysaccharide and core lipopolysaccharide mutants and demonstration that a complete core is required for rough vaccines to be efficient against Brucella abortus and Brucella ovis in the mouse model[J].Infect Immun, 2003, 71(6): 3261-3271.
[20]Vemulapalli R, McQuiston J R, Schurig G G,et al.Identification of an IS711 Element Interrupting the wboA Gene of Brucella abortusVaccine Strain RB51 and a PCR Assay To Distinguish Strain RB51 from Other Brucella Species and Strains[J].CDLI, 1999, 6(5): 760-764.
[21]McQuiston J, Vemulapalli R, Inzana T,et al.Genetic characterization of a Tn5-disrupted glycosyltransferase gene homolog in Brucella abortus and its effect on lipopolysaccharide composition and virulence[J].Infect Immun, 1999, 67(8): 3830-3835.
[22]Winter A, Schurig G, Boyle S,et al.Protection of BALB/c mice against homologous and heterologous species of Brucella by rough strain vaccines derived from Brucella melitensis and Brucella suis biovar 4[J].Am J Vet Res,1996, 57(5): 677.
[23]Godfroid F, Taminiau B, Danese I,et al.Identification of the Perosamine Synthetase Gene ofBrucella melitensis 16M and Involvement of Lipopolysaccharide O Side Chain in BrucellaSurvival in Mice and in Macrophages[J].Infect Immun, 1998, 66(11): 5485-5493.
[24]Zhang M, Han X, Liu H,et al.Inactivation of the ABC transporter ATPase gene in Brucella abortus strain 2308 attenuated the virulence of the bacteria[J].Vet Mic, 2013.
[25]丁家波, 毛开荣, 程君生, 等.布氏杆菌病疫苗的应用和研究现状[J].微生物学报, 2006, 46(5): 856-859.
