上海市闵行区猪场中大肠杆菌O157:H7的分离鉴定及生物学特性研究
2013-07-04赵秋华王少辉刘萍萍姚建楠李颖利李蓓蓓邵东华史子学魏建超马志永
赵秋华,王少辉,刘萍萍,姚建楠,李颖利,李蓓蓓,邵东华,史子学,魏建超,马志永
(1.上海市闵行区动物疫病预防控制中心,上海 201109;2.中国农业科学院上海兽医研究所,上海 200241)
肠出血性大肠杆菌(Enterohemorrhagic Escherichia coli,EHEC)感染可引起出血性肠炎(hemorrhagic colitis,HC)、溶血性尿毒综合征(hemolytic uremic syndrome,HUS)、 血 小 板 减少 性 紫 癜(thrombotic thrombocytopenic purpura,TTP),其中,HUS和TTP的病情严重,病死率高。EHEC引起人类致病的最常见血清型为 O157:H7,该病原菌严重威胁人类健康,已成为世界性的重要的公共卫生和食品安全问题[1,2]。1982年,该病首次在美国爆发流行,随后在加拿大、英国、意大利、日本、爱尔兰、比利时、德国、澳大利亚、阿根廷、南非、以色列等国家爆发和流行[3-6]。我国1986年首次报告大肠杆菌O157:H7感染的病例,主要在江苏省、山东省、河南省、安徽省、广西省、福建省等十几个省市发生大肠杆菌O157:H7感染的散发病例[7]。
大肠杆菌O157:H7作为一种人兽共患病原菌,可以在畜禽中流行和传播,并通过动物源性食品传染给人。调查和监测结果表明,牛、羊、猪等家畜是大肠杆菌O157:H7的天然宿主,且牛和猪是大肠杆菌O157:H7的主要宿主,阳性率高于其他动物[8]。虽然猪是大肠杆菌O157:H7的宿主,但该菌引起猪发病并不多见,多为阴性感染,但可向环境中排毒,具有潜在的食品安全隐患[9]。对上海地区猪场中大肠杆菌O157:H7进行流行病学调查,了解其毒力因子和耐药情况,有助于控制大肠杆菌O157:H7在猪场中的流行和传播,防止其经动物源性食品在人间传播。因此,本研究对采集上海地区某3个猪场猪280份样品进行大肠杆菌O157:H7分离鉴定和生物学特性研究,将对预防和控制大肠杆菌O157:H7在猪场中的流行和传播具有重要的兽医公共卫生意义。
1 材料和方法
1.1 材料
1.1.1 试剂与仪器 营养肉汤(NB)为上海科技公司产品;大肠杆菌O157显色培养基为青岛海博生物技术有限公司产品;大肠杆菌O157和H7诊断血清为宁波天润生物药业有限公司产品;细菌微量发酵管、药敏试纸均购自杭州天和微生物试剂有限公司;2×TaqPCR Master Mix 购自天根生化科技有限公司;Veriti 96 Well Thermal Cycler PCR 扩增仪购自Applied Biosystem公司;DYY-GC型电泳仪购自北京市六一仪器厂;凝胶成像仪购自Bio-Rad公司。
1.1.2 病料 2012年4~12月份分别采集上海市某三个猪场的猪粪便样品和肛拭子样品共280份。
1.2 方法
1.2.1 细菌的分离培养 将粪便样品和肛拭子样品混于 500 μL NB 培养基中,37℃培养增菌 6~8 h,划线接种于O157显色培养基上,37℃培养16~20 h,挑取疑似单菌落划线在平板上划线纯化,挑取疑似单菌落接种于LB培养基中,37℃培养6~8 h,进行下一步鉴定。
1.2.2 血清学鉴定 分别应用O157和H7单因子诊断血清与待检细菌在玻片上进行凝集反应,测定细菌的血清型。凝集试验以生理盐水作为阴性对照,以大肠杆菌O157:H7标准菌株ATCC35150作为阳性对照。
1.2.3 PCR鉴定 根据O157抗原和H7抗原编码基因(rfbE和fliC)进行双重PCR鉴定大肠杆菌O157:H7[10,11]。移取 1 mL 增菌液至灭菌 EP 管中,10 000×g离心 5 min,弃上清,然后加入 100 μL灭菌去离子水重悬沉淀,于沸水中加热10~15 min,再次10 000×g离心5 min,收集上清液,作为PCR反应模板。PCR 反应体系如下:2×PCR Master Mix 12.5 μL,引物O157-F、O157-R、H7-F、H7-R(表1)各取0.8 μL,模板(粗提DNA)2.0 μL,最后加灭菌ddH20至25 μL。同时设立阳性对照,阴性对照。PCR反应条件如下:95℃预变性5 min;95℃变性 30 s,55℃ 退火 30 s,72℃ 延伸 40 s,35 个循环;72℃ 延伸10 min。1.0%琼脂糖凝胶上电泳各样品5 μL,紫外灯下拍照,记录PCR结果。
1.2.4 生化试验 将细菌分别接种于肠杆菌微量生化管中,37℃倒置培养24 h,观察并记录结果,确定菌株的各项生化特性。
1.2.5 药敏试验 采用纸片扩散法进行药敏试验。将所保存的纯化菌株分别在37℃营养肉汤中培养18~24 h,致密划线于琼脂平板表面,用无菌镊子将药敏片贴于培养基表面,37℃培养24 h后测抑菌圈直径,根据美国临床检验标准委员(CLSI)标准判定大肠杆菌O157:H7对药敏纸片的敏感性(表2)。
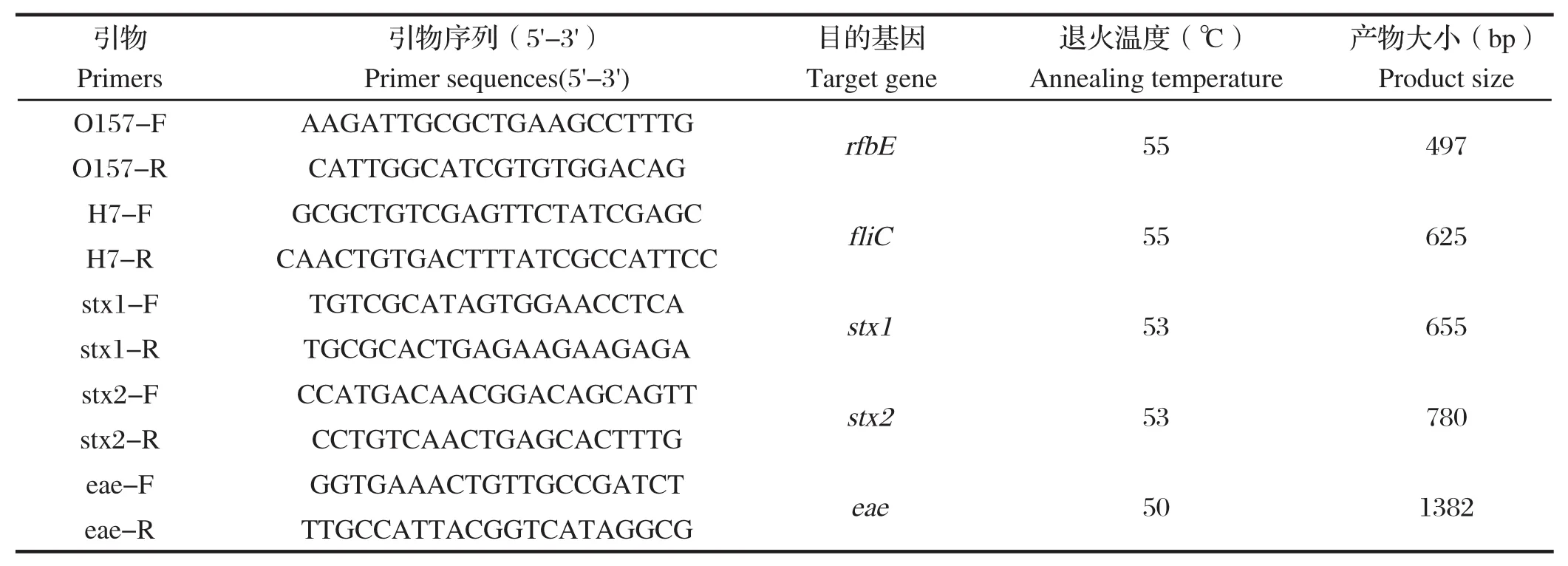
表1 大肠杆菌O157: H7特异性基因检测引物Table 1 Primers for detection of E.coli O157:H7
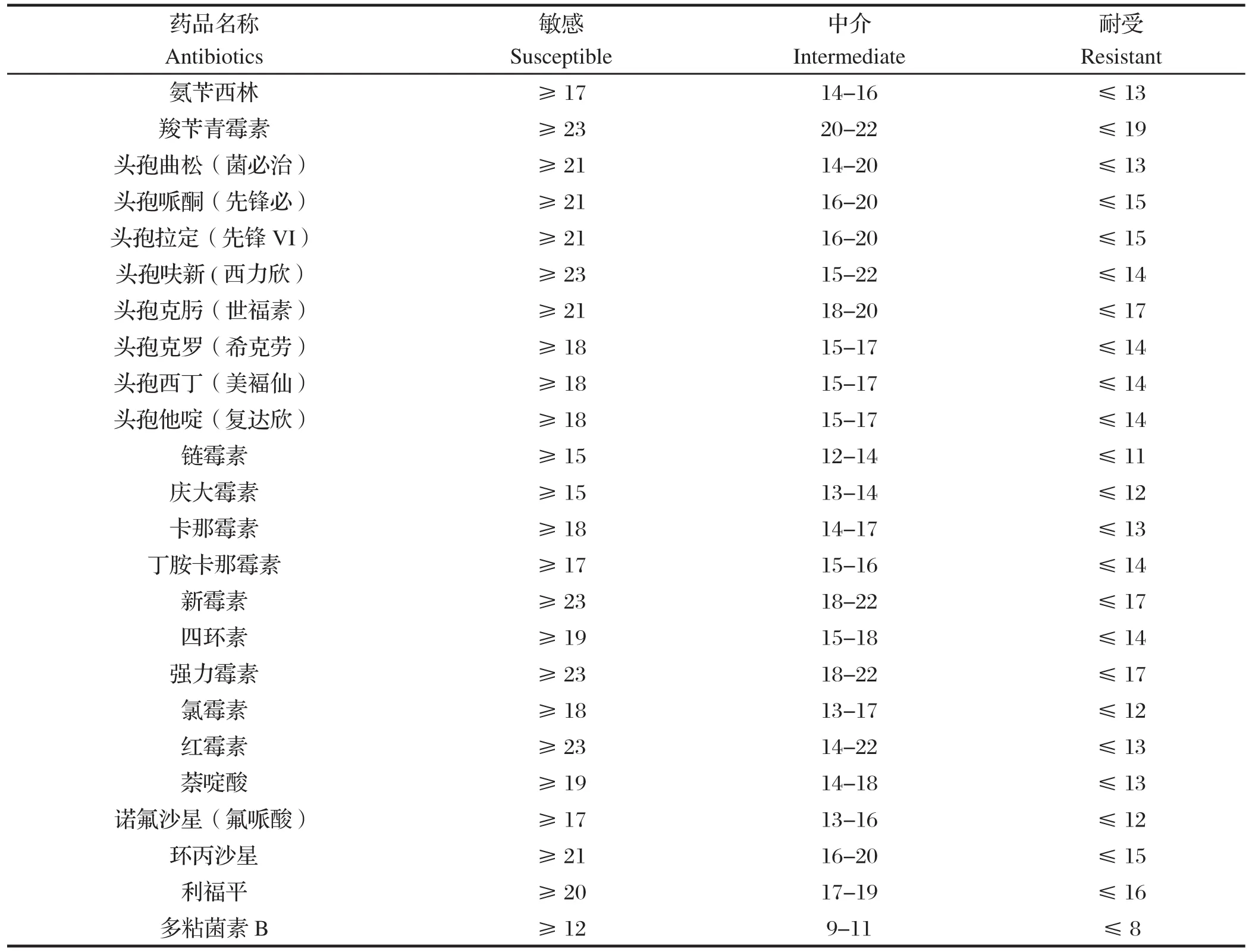
表2 药物敏感性判断标准Table 2 Primers for detection of E.coli O157:H7
1.2.6 毒力基因检测 根据大肠杆菌O157毒力基因序列分别设计并合成引物(表 1),采用PCR检测这些毒力基因在大肠杆菌中的分布。PCR反应体系:2×PCR Master Mix 12.5 μL,Primer F、R 各取1.0 μL,模板(粗提 DNA)2.0 μL,最后加灭菌ddH2O至25 μL。PCR反应参数:95℃5 min;95℃ 30 s,56℃ 30s,72℃ 30~50s,30 个循环;72℃10 min。1.0% 琼脂糖凝胶上电泳各样品 5 μL,紫外灯下拍照,记录PCR结果。
2 结果
2.1 细菌的分离培养大肠杆菌 O157:H7 在 O157 选择性培养基上呈红色、淡红色或红色菌落,菌落周围没有蓝色晕圈,其他大肠杆菌显暗蓝色、蓝色或紫色,菌落周围有蓝色晕圈;而其他细菌显蓝色、黄色或无色。280个样品经过O157选择性培养基筛选,挑取17个疑似单菌落。
2.2 大肠杆菌O157:H7的PCR鉴定采用PCR方法检测17株疑似菌株是否为大肠杆菌O157:H7,以ATCC35150菌株为阳性对照。结果表明来自于15和17号疑似菌株出现特异性条带(图1),表明该菌株为大肠杆菌O157:H7,分别命名为EHEC01和EHEC02。在检测的280个样品中,有2份细菌经PCR鉴定为大肠杆菌O157:H7,样本细菌分离率为0.71%。
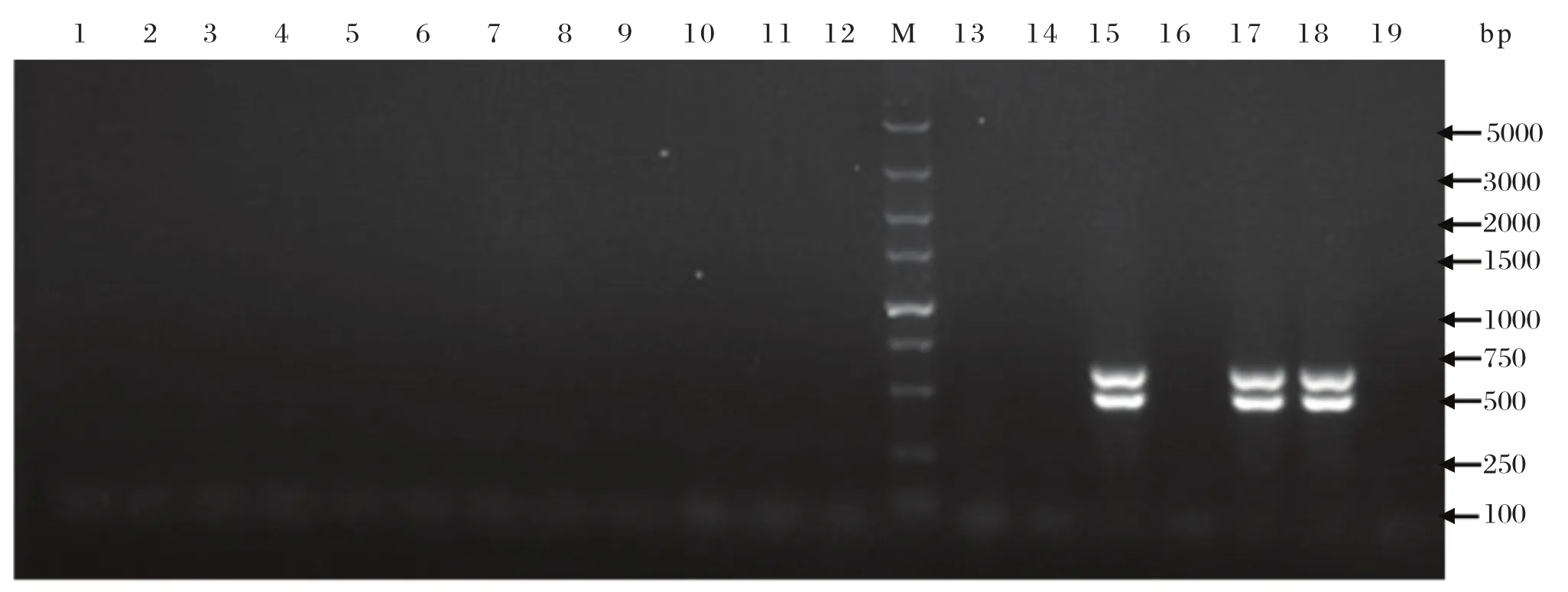
图1 大肠杆菌O157:H7 PCR检测结果Fig.1 The PCR detection of E.coli O157:H7
2.2 血清学鉴定结果对PCR呈阳性的菌株进行血清学鉴定,分别将其与O157和H7诊断血清做玻片凝集试验,结果表明该菌株与O157和H7诊断血清均出现凝集现象,而与阴性对照血清和生理盐水则均无凝集现象。凝集试验结果表明分离所得的2株细菌为大肠杆菌O157:H7,与PCR结果一致。
2.3 生化试验结果将大肠杆菌O157:H7菌株分别接种于微量生化管,培养后观察。结果表明,该细菌能够发酵葡萄糖、乳糖、麦芽糖和甘露醇;发酵蔗糖,产酸不产气;M-R试验、吲哚试验阳性;VP试验、柠檬酸盐利用试验阴性;不产生硫化氢(H2S)。以上生化结果与大肠杆菌O157:H7的生化特性相符合。
2.4 药敏试验结果选用β-内酰胺类抗生素、氨基糖苷类抗生素、四环素类抗生素、氯霉素类抗生素、大环内酯类抗生素、多肽类抗生素、氟喹诺酮类药物和利福霉素类抗菌药共24种抗菌药物对分离得到的大肠杆菌O157:H7进行药敏试验,药敏结果见表3。药敏结果表明大肠杆菌O157:H7的耐药性程度都较高,两者对24种药物的耐药性均为62.5%。而敏感药物仅有头孢西丁(美褔仙)、头孢他啶(复达欣)和丁胺卡那霉素3种。
2.5 毒力因子分布采用PCR方法对大肠杆菌O157:H7分离株的主要毒力基因(stx1、stx2和eae)进行检测,结果显示两株大肠杆菌O157:H7均含有eae基因。EHEC01分离株含有stx1基因,提示其只携带1型志贺毒素;而EHEC02分离株不携带志贺毒素基因(图2)。
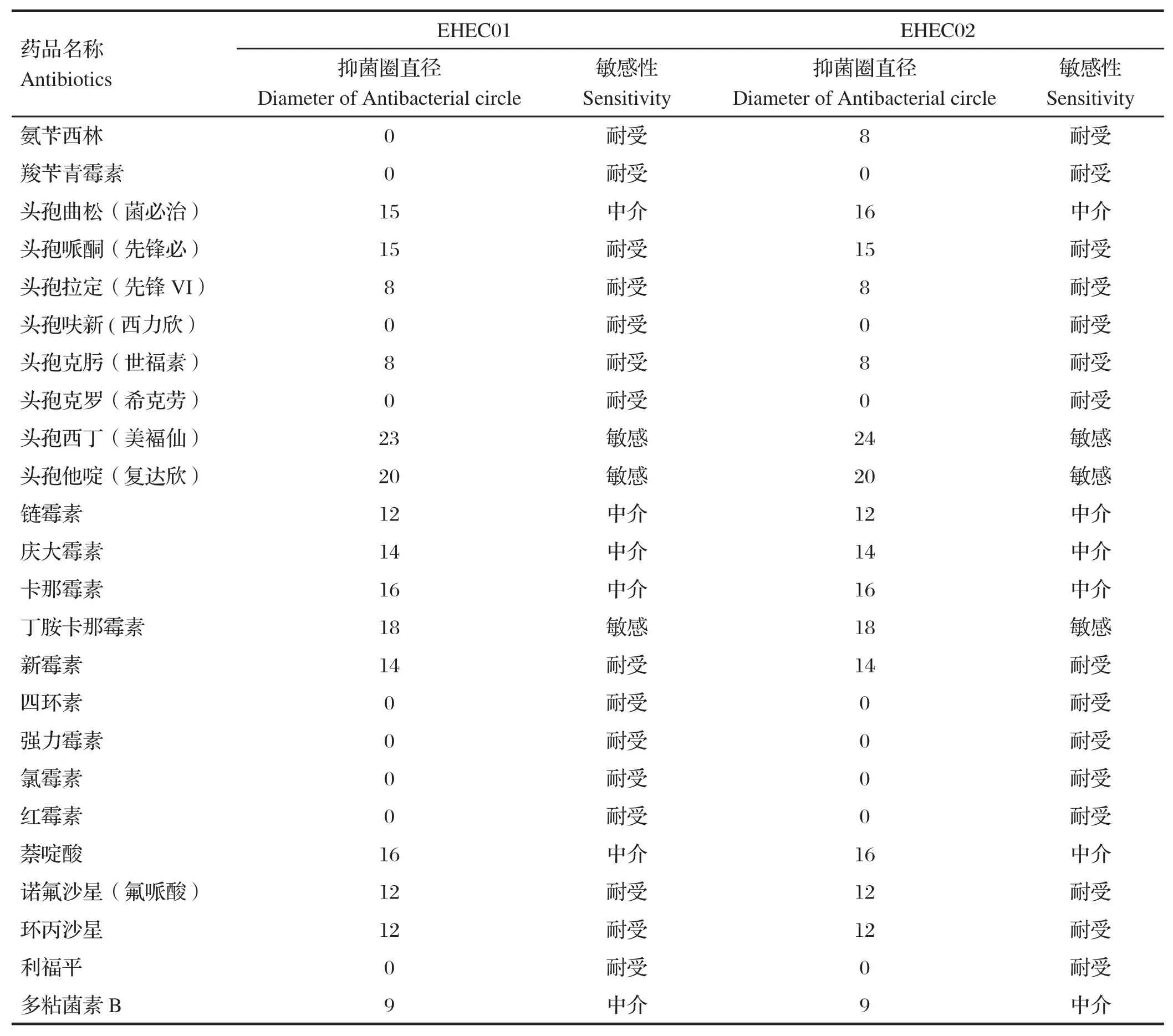
表3 大肠杆菌O157:H7的药敏试验结果Table 3 Results of antibiotic sensitivity test of E.coli O157:H7
3 讨论
近年来,由EHEC引起的食源性疾病在世界范围内许多国家都时有报道,如最近发生在德国由豆苗污染引起的EHECO104:H4暴发事件,导致2000多人感染,约数十人死亡,这次疫情对整个欧洲都造成了一定的影响[12]。EHEC主要包括O157:H7、O26:H11和 O111等血清型,其中 O157:H7是最重要的一种血清型。研究表明,家畜家禽是大肠杆菌O157:H7的主要动物宿主和传染源,其中最主要的宿主为牛,其次为羊、猪、禽类[8]。因此,本文对上海地区猪场中大肠杆菌O157:H7的分布及生物学特性进行研究,有助于控制大肠杆菌O157:H7在畜禽中的流行和传播,防止其经动物源性食品传染给人。
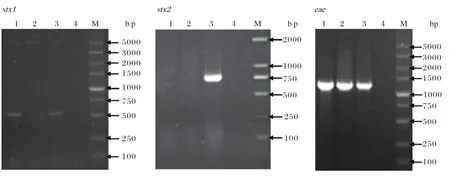
图2 毒力基因检测结果Fig.2 The results of PCR for detection of virulence genes
本文采用增菌、选择性培养基筛选、PCR鉴定的方法分析大肠杆菌O157:H7在280份猪场样品中的分布。结果从不同猪场的2份断奶腹泻仔猪的粪便样本中分离鉴定出大肠杆菌O157:H7,分离率为 0.71%(2/280)。Yan等[13]对 2005-2006年 上海奉贤区不同猪场的粪便样品中大肠杆菌O157进行流行病学调查,结果表明1.1%的样品含有大肠杆菌O157,其于分离率高的原因在于仅检测大肠杆菌 O157(包括 O157:H7 和 O157:NM)。王建等[14]检测2003-2004年上海地区动物及其产品中大肠杆菌O157:H7带菌情况,结果表明5.71%的猪粪便样品携带大肠杆菌O157:H7。顾宝柯等[15]的检测结果表明,2000-2001年上海地区猪粪便中大肠杆菌O157:H7的检出率为3.4%,其中2000年和2001年的检出率分别为1.4%和5.67%。杨丽华等[16]检测了上海市闵行区家禽畜大肠杆菌O157:H7带菌状况,猪粪中大肠杆菌O157:H7的阳性率高达9.76%。造成大肠杆菌O157:H7不同的检出率的原因可能为不同时间、不同猪场、不同采样方法。
志贺毒素(Stx1、Stx2)和紧密素(Intimin)是EHECO157的主要致病因子,其分别由stx1、stx2和eae基因编码,是判断EHEC O157菌株致病力强弱的重要因素[17]。自然界中存在的大肠杆菌O157有的产毒,而有的不产毒,它们对人的致病性有很大差异,但是表型几乎相同,用传统的血清学方法也难以分辨,本文采用简便、快速、特异的PCR方法检测分离菌株所携带的主要毒力基因进行检测,更加清楚的了解了每个菌株的毒力特性。志贺毒素是EHEC重要的毒力因子之一,具有细胞毒性、肠毒性和神经毒性,是导致感染者死亡或出现重型病症的主要原因。目前认为EHECO157:H7之所以能对人类引起如此大的危害,其主要都是志贺毒素的作用[17]。本次分离鉴定的EHECO157:H7菌株均不携带Stx2,而仅EHEC01含有Stx1,这与相关报道中的结果相比稍低[18],其原因可能由于不同来源的菌株具有不同的特性。LEE毒力岛上的重要毒力基因eae编码的紧密素是导致肠道出现典型粘附与消除损伤的主要致病因子,本次分离的两个菌株都含有eae基因,这一结果与“eae基因在EHEC菌株中广泛存在”的说法[18]是一致的。
本研究对分离的EHECO157:H7进行体外药敏试验,结果表明2株EHECO157:H7均具有很强的多重耐药性,仅对头孢西丁(美褔仙)、头孢他啶(复达欣)和丁胺卡那霉素3种药物敏感。滥用抗生素可导致细菌产生耐药性,给养猪业的疾病控制带来了极大的危害,并有可能通过食物链将耐药性基因传递给人类。由于EHEC致病机理的特殊性,滥用抗生素不仅难以控制病情,还会促进志贺毒素的释放,使其在体内发挥作用,增加了疾病的控制难度。因此,使用抗生素控制病情时,要在科学分析的基础上,选用合适的防控方法。
[1]Locking M, Cowden, J.Escherichia coli O157[J].BMJ,2009, 339: 4076.
[2]Gyles C L.Shiga toxin-producing Escherichia coli: an overview[J].J Anim Sci, 2007, 85(13 Suppl): 45-62.
[3]Day N P , Scotland S M, Cheasty T,et al.Escherichia coli O157:H7 associated with human infections in the United Kingdom[J].Lancet, 1983, 1(8328): 825.
[4]Watanabe H, Wada A, Inagaki Y,et al.Outbreaks of enterohaemorrhagic Escherichia coli O157:H7 infection by two different genotype strains in Japan, 1996[J].Lancet, 1996, 348(9030): 831-832.
[5]Albert M J, Bettelheim K A.Enterohaemorrhagic E.coli O157:H7 in central Australia[J].J Diarrhoeal Dis Res,1989, 7(3-4): 96-97.
[6]Hancock D D, Besser T E, Rice D H,et al.Multiple sources of Escherichia coli O157 in feedlots and dairy farms in the northwestern USA[J].Prev Vet Med, 1998,35(1): 11-19.
[7]王燕, 谢贵林, 杜琳.大肠杆菌O157:H7感染流行概况[J].微生物学免疫学进展, 2008, 36(1): 51-58.
[8]Ferens W A, Hovde C J.Escherichia coli O157:H7:animal reservoir and sources of human infection[J].Foodborne Pathog Dis, 2011, 8(4): 465-487.
[9]焦凤超, 李迎晓, 易本驰, 等.猪源大肠杆菌O157的分离鉴定及药敏试验[J].畜牧与兽医, 2010, 42(10): 72-73.
[10]Sanchez S, Martinez R, Garcia A,et al.Shiga toxinproducing Escherichia coli O157:H7 from extensive cattle of the fighting bulls breed[J].Res Vet Sci, 2010, 88(2):208-210.
[11]Garcia-Sanchez A, Sanchez S, Rubio R,et al.Presence of Shiga toxin-producing E.coli O157:H7 in a survey of wild artiodactyls[J].Vet Microbiol, 2007, 121(3-4): 373-377.
[12]Rohde H, Qin J, Cui Y,et al.Open-source genomic analysis of Shiga-toxin-producing E.coli O104:H4[J].N Engl J Med, 2011, 365(8): 718-724.
[13]Yan Y, Shi Y, Cao D,et al.Prevalence of Stx phages in environments of a pig farm and lysogenic infection of the field E.coli O157 isolates with a recombinant converting Phage[J].Curr Microbiol, 2011, 62(2): 458-464.
[14]王建, 沈莉萍, 刘佩红, 等.上海市动物及其产品中大肠埃希菌O157:H7带菌情况的调查[J].动物医学进展,2005, 26(4): 87-90.
[15]顾宝柯, 许学斌, 金汇明, 等.上海地区家畜、家禽及肉制品大肠杆菌O157:H7监测[J].疾病监测, 2003, 18(1):5-7.
[16]杨丽华, 许学斌, 刘继倩, 等.上海市闵行区家禽畜大肠杆菌O157:H7带菌状况监测.上海预防医学杂志[J].2004, 16(7): 309-310.
[17]Law D.Virulence factors of Escherichia coli O157 and other Shiga toxin-producing E.coli[J].J Appl Microbiol,2000, 88(5): 729-745.
[18]Seker E, Kuyucuoglu Y, Sareyyupoglu B,et al.PCR detection of Shiga toxins, enterohaemolysin and intimin virulence genes of Escherichia coli O157:H7 strains isolated from faeces of Anatolian water buffaloes in Turkey[J].Zoonoses Public Health, 2010, 57(7-8): 33-37.
