运动性肥大心脏心肌超微结构改变的实验研究
2013-06-28孙强
孙 强
运动性肥大心脏心肌超微结构改变的实验研究
孙 强
通`过大鼠8周递增负荷游泳训练模型的建立,研究运动性心脏肥大大鼠心肌超微结构的变化规律及运动对心肌细胞的影响,为运动性心脏猝死提供科学依据。结果表明:有氧训练组大鼠线粒体数量明显增多,体积增大,有轻度肿胀,基质尚均匀,嵴排列规则密集,结构清晰完整,线粒体膜完整。细胞核增大,核周间隙略增宽,核质均匀,核膜完整清晰,染色质均匀。肌丝排列整齐,数量增加,肌小节明暗带相间,结构清晰,肌膜完整,闰盘整齐,呈台阶状;而过度训练组大鼠线粒体明显肿胀,基质溶解呈现空泡变形,嵴排列紊乱,融合甚至消失,线粒体膜被损。细胞核不规则,核膜明显内陷或皱缩,核质不均匀,染色质凝聚,异染色质在核边缘聚集。肌丝粗细不均,部分肌丝呈节段性变形,闰盘出现明显扩张,部分闰盘不成形。结果提示:适宜的运动负荷使心脏发生适应性改变,心肌发生生理性肥大,而长期的过度负荷会导致心肌细胞发生与衰老相似的病理性改变,甚至导致心肌细胞死亡,引起运动性心脏猝死。
运动性心脏肥大;超微结构;实验研究
运动训练对心肌超微结构影响的报道颇多:运动后出现心脏扩大,心肌肥厚,心肌细胞线粒体数目增多,肌原纤维变粗,肌浆网扩张等改变,心力贮备增加,被认为是心脏的适应性的代偿变化[1];研究中同时也发现运动后心肌细胞线粒体肿胀,细胞核染色质异常,闰盘失去台阶状结构,呈蛇形卷曲或毛发状卷曲等病理变化[2],但是心肌超微结构的改变与运动量和运动强度间关系性的研究报道较少。近年竞技体育训练和比赛如长跑、足球等大强度耐力项目中,心源性猝死和晕厥现象引起了运动医学界的广泛关注,但目前对其发生的机制尚不清楚。本文重点研究超大强度运动后心脏的病理变化,探索心肌细胞超微结构的变化规律,以期为心脏的医疗保健提供形态学依据。
1 材料和方法
1.1 实验动物
纯种健康雄性SD大鼠36只,由中科院上海运动研究中心提供,体重179.6±15.7g,国家标准啮齿类动物饲料喂养,自由饮水进食,并记录每天的饮食情况。
1.2 实验方法
1.2.1 运动条件 实验室内温度21-24○C,湿度44-55%,分笼饲养,每笼6只。游泳池120cm×80cm×70cm,内壁光滑,水深超过大鼠身长的2倍,水温31-32○C。
1.2.2 运动方案 大鼠购进后先适应性喂养1周,按体重随机分组:对照组(12只):平时不运动,饲养条件与运动训练组相同。有氧运动组(12只):每周训练5天,每天1次。第1次游20分钟,以后逐日增加游泳时间。第1周末时游0.5小时,第2周末时游1小时,第3周末时游2小时。从第4周开始强度不再增加,保持到实验结束。训练时间共8周。过度负荷组(12只):前3周和有氧运动组的训练完全相同,第4周起开始高强度训练。第4周开始时在过度负荷组大鼠尾部负0.5%体重的重物,每天游2小时。第4周末时负重增加至体重的1%,第5周末时增加至体重的
1.5%,第6周末时增加至体重的2%,从第7周开始增加训练次数,每天上午训练1次,负2-3%体重游2小时,下午训练1次,负3-6%体重游至力竭(力竭标准为没入水中10秒不能浮出水面),直至训练结束。训练时间共8周。
1.3 取材、标本采集及处理
大鼠末次游泳训练后24小时,称重,断头处死,迅速解剖大鼠,取左心室,在冰生理盐水中浸泡,洗取残血,滤纸吸干水分,称心脏重量及左心室重量。
取左室1mm3小块,用2.5%戊二醛前固定24h,在0.1M磷酸缓冲液中漂洗3次,1%锇酸后固定、梯度酒精脱水、包埋、切片、染色,在日立-H600透射电子显微镜下观察拍片。
1.4 结果处理
数理统计采用国际通用统计软件SPSS11.0 for Windows的t检验,全部数据均以均数±标准差()表示。
2 实验结果
2.1 大鼠体重变化
对照组和有氧训练组大鼠体重一直呈上升趋势,且增加幅度比较大,尤其是对照组体重增长最明显。过度训练组大鼠体重也呈上升趋势,但第四周后体重增长幅度明显减小。具体见图1。
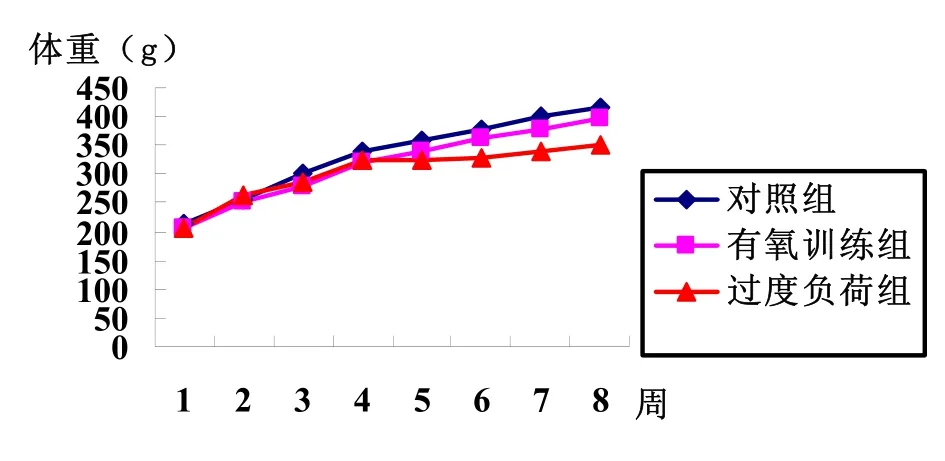
图1 大鼠体重变化情况
2.2 大鼠一般情况变化
8周游泳训练后,对照组和适宜负荷组大鼠神态安静,皮毛光洁整齐,眼睛有神。适宜负荷组在训练后期能顺利完成训练任务。过度负荷组大鼠神态倦怠,眼神黯淡无光,毛发稀疏,易受惊吓,进食量明显减少,反应能力和运动能力降低,有的已经明显无法承受运动负荷。运动训练后期,过度负荷组大鼠死亡率较高。
2.3 大鼠八周末体重、心脏重量、左心室重量及心系数
8周游泳训练后,有氧训练组和过度负荷组体重比对照组有显著性降低(P<0.01),且过度负荷组体重比有氧训练组有显著性降低(P<0.01)。有氧训练组和过度负荷组心脏重量比对照组有显著性增加(P<0.01),且有氧组心脏重量显著高于过度负荷组(P<0.01)。有氧训练组和过度负荷组心系数明显高于对照组(P<0.01),且有氧训练组心系数明显低于过度负荷组(P<0.01)。具体见表1。
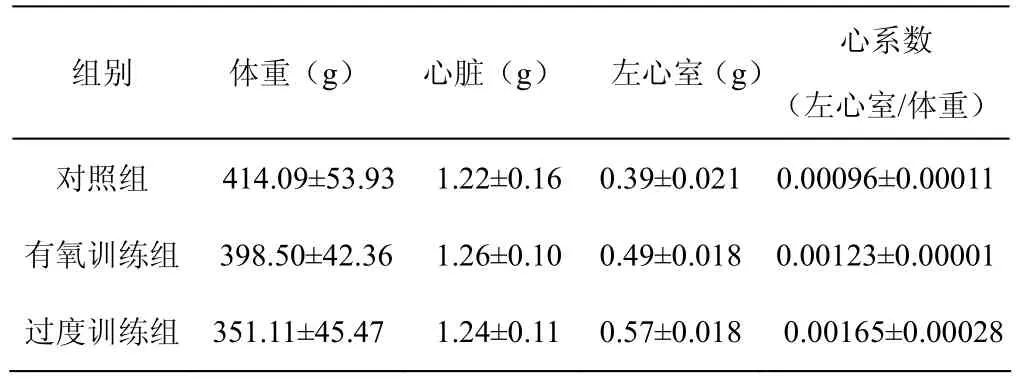
表1 大鼠体重、心脏重量、左心室重量及心系数
2.4 大鼠心肌超微结构
2.4.1 对照组大鼠心肌超微结构 心肌组织结构正常,线粒体数量较多,呈椭圆形,嵴清晰,线粒体膜完整。细胞核呈椭圆形,核膜双层结构清晰完整,核质均匀,核仁明显,染色质疏松,密度均匀。肌丝排列整齐,肌小节各节清晰可见,肌膜完整,无肌丝断裂扭曲,闰盘清晰,偶有扩张。
2.4.2 有氧训练组大鼠心肌超微结构 线粒体数量明显增多,体积增大,有轻度肿胀,基质尚均匀,嵴排列规则密集,结构清晰完整,线粒体膜完整。细胞核增大,核周间隙略增宽,核质均匀,核膜完整清晰,染色质均匀。肌丝排列整齐,数量增加,肌小节明暗带相间,结构清晰,肌膜完整,闰盘整齐,呈台阶状。
2.4.3 过度训练组大鼠心肌超微结构 心肌组织结构不完整,线粒体明显肿胀,基质溶解呈现空泡变形,嵴排列紊乱,融合甚至消失,线粒体膜被损。细胞核不规则,核膜明显内陷或皱缩,核质不均匀,染色质凝聚,异染色质在核边缘聚集。肌丝粗细不均,部分肌丝呈节段性变形,闰盘出现明显扩张,部分闰盘不成形。
3 分析与讨论
3.1 心脏重量及心系数
心脏重量是反映心脏肥大的主要指标,由于心脏绝对重量受体重影响,所以一般用心脏的相对重量即心系数作为判断心脏肥大的指标[2]。本实验的结果显示,有氧训练组和过度训练组的心系数比对照组都有显著性增加,说明两训练组大鼠心脏均产生肥大,尤以左室肥大更明显,提示本实验的造模大鼠达到运动性心肌肥大的要求。
3.2 大鼠心肌超微结构
心脏搏动消耗的能量主要由有氧氧化供给,其中约80 %的能量需求由线粒体产生[3]。有资料显示[4],线粒体对生理和病理性应激都很敏感,是最容易出现变化的亚细胞器之一。本实验的结果显示,有氧训练组大鼠线粒体数量明显增多,体积增大,有轻度肿胀,基质尚均匀,嵴排列规则密集,结构清晰完整,线粒体膜完整。有氧运动过程中,机体代谢率升高,心肌细胞的能量消耗增加,作为“能量工厂”的线粒体出现适应性代偿性改变:数目增多,体积增大,轻度肿胀。运动量增大,使ATP合成受影响,ATP依赖的钠泵活动改变,线粒体内钠离子增多,而使细胞内外的水盐平衡失调,大量水进入细胞,引起线粒体肿胀,但线粒体的基质尚均匀,线粒体膜完整,说明线粒体的损伤是可逆性的。能源物质的氧化过程中,呼吸链和氧化磷酸化过程大多在线粒体嵴上完成。有氧训练组大鼠线粒体体积增大,嵴排列整齐规则,显示了线粒体代偿功能的增加。细胞核增大,说明核酸类物质合成增多,核与细胞质的物质交换增加,同时作为细胞核与细胞质之间物质交换的通道并富含代谢酶类物质的核周隙增宽。有氧训练组大鼠线粒体、细胞核等的这些变化都说明心肌细胞代谢旺盛,适应运动时的能量供应和机体代谢的需求。
过度负荷组大鼠的心肌超微结构出现病理性变化:线粒体明显肿胀,基质溶解呈现空泡变形,嵴排列紊乱,融合甚至消失,线粒体膜被损。线粒体嵴异常,意味着心肌细胞损伤的开始,说明线粒体功能明显减退,退变呈膜性残余物或巨大空泡。线粒体结构的改变与细胞凋亡的早期超微结构改变相似,说明过度负荷训练引起的线粒体损伤是不可逆的,使心肌细胞的能量供应不足,造成心肌细胞的病理性损害。线粒体膜受损,是由于长期大负荷的过度训练,自由基大量产生,损伤心肌细胞膜使其通透性发生改变,细胞内钙离子浓度增加,激活了存在于线粒体膜上的内源性磷脂酶,而激活的磷脂酶可以破坏线粒体膜上的结构和功能分子磷脂,造成线粒体膜被损。有氧训练组细胞核增大,核周间隙略增宽,核质均匀,核膜完整清晰,染色质均匀,而过度负荷组细胞核不规则,核膜明显内陷或皱缩,核质不均匀,染色质凝聚,异染色质在核边缘聚集。过度负荷组的这些变化是细胞核坏死的表现。过度负荷组肌丝明显受损,粗细不均,肌节呈节段性变形,闰盘明显扩张,部分闰盘不成形,这主要是由于长期大负荷的过度训练过程中,肌丝收缩蛋白长时间活动,ATP缺乏或钙离子和镁离子变化而聚集,能量供应不足,心肌纤维极度疲劳收缩而得不到及时恢复造成的。闰盘扩张,失掉正常闰盘的台阶状结构,提示心肌闰盘结构和功能受损,影响心肌兴奋的传导,并引起细胞间连续的机械力丧失,甚至可使兴奋传导障碍而出现心律不齐。
有资料提示[5],线粒体损伤及功能障碍与某些心肌病有关。过度负荷组大鼠线粒体、细胞核、肌丝等的变化表明,持续的大负荷运动,将使心肌细胞出现不可逆的病理改变。因此,长期过度负荷运动时,即使运动员的心理状态和骨骼肌还保持兴奋状态,使机体运动处于较高水平,但潜在的心肌病理性变化则可能潜匿性导致运动性心脏猝死的发生。
过度负荷组大鼠心肌超微结构的病理性变化可能与心肌缺血、缺氧及自由基大量产生有关。Gollnick[6]和Bowers[7]报道,力竭性运动后骨骼肌线粒体肿胀,伴随内膜嵴变性。黄利长等[8]证实大强度运动时骨骼肌线粒体电子浓集,个别膨大成絮状,超大强度运动引起线粒体体积显著增大,嵴断裂,基质密度普遍降低。前者被认为是线粒体缺氧初期,也是变性的开始,后者是组织严重缺氧的表现。张勇等[9]的研究发现,递增负荷力竭性运动后大鼠心肌组织和线粒体脂质过氧化产物丙二醛(MDA)显著性增高。Shinobu等[6]用H2O2灌注大鼠主动脉实验表明,心肌线粒体肿胀,嵴破损,心肌收缩力下降,ATP水平显著降低。长期过度负荷运动后自由基大量产生,线粒体膜上的不饱和脂肪酸、膜蛋白和DNA等被自由基通过脂质过氧化反应大量破坏,最终导致线粒体损伤。有氧运动中,自由基产生量并不大,并可在短时间内被清除,细胞和亚细胞器的损伤较轻,随着运动强度增大,自由基的产生增多且消除较慢,心肌细胞的损伤更趋严重且无法修复。长期过度负荷运动过程中,心肌缺血、缺氧和自由基大量产生是造成心肌损害的重要原因,但不可忽视的是,过度训练组大鼠心肌长期在疲劳状态下进行强力收缩,尤其是后四周的训练,两次训练间的时间间隔短,大鼠心肌得不到足够的休息,无法彻底恢复,可能是导致心肌损害的更为直接的因素。
过度负荷组大鼠心肌超微结构的变化及原因与心肌细胞自然衰老的症状及原因一致。心肌细胞是高度分化的细胞,再生能力差,随着年龄增加,心肌细胞受损伤衰亡致使其数量逐渐减少,而长期大负荷运动后也出现心肌细胞凋亡使其数量减少的现象,使心脏受损而功能下降[10]。细胞核固缩,线粒体肿大等衰老现象是由生命周期中代谢产生的活性氧成分造成的损伤积累引起的[11-12]。这与长期大负荷运动过度运动后的病变原因是一致的。有资料显示[13],线粒体的形态变化程度与运动持续时间有密切关系:运动持续时间越长,对有氧氧化的依赖程度越大,线粒体的工作负担不可避免的加重,损伤加大。由此可推测,长期过度负荷的运动将促进心肌细胞的衰老,且随着运动强度的加大,心肌细胞凋亡现象更为明显。不过,这还需进一步的实验证实。
4 结 论
(1)适宜的运动负荷使心肌细胞产生增强功能的代偿性适应性改变,有利于大鼠心肌功能的提高,心肌发生生理性肥大。
(2)长期大负荷的过度训练心肌缺血、缺氧、自由基大量产生以及心肌在疲劳状态下进行强力收缩,使心肌细胞产生不可逆的病理性改变,损伤心肌超微结构,影响心肌正常功能,心肌发生病理性肥大。
(3)长期大负荷过度训练时,机体虽处于较高运动水平,但潜在的心肌病理变化可能会导致运动性心脏猝死。
(4)长期过度负荷的运动可能会加速心肌细胞的衰老,且随着运动强度的加大,心肌细胞凋亡现象更为明显。
[1] 张 平. 运动与心脏的重塑[J]. 中国运动医学杂志,2000,19(1):76~79.
[2] 佟长青. 运动性和高血压性肥大心脏心肌细胞超微结构的对比研究[J]. 中国运动医学杂志,2001,20(2):158-159,166.
[3] 刘井波,彭双清. 脂质过氧化作用与线粒体损伤[J].中国预防医学杂志,2005(6):167~170.
[4] 张 勇,李静先. 运动性线粒体超微结构退行性改变[J]. 天津体育学院学报,1994,9(2):50~52
[5] Douglas C,Wallace. Mitochondria disease in man and mouse. Science. 1999,283:1 482~1 488.
[6] Gollnick PD. Effect of exercise and training on mitochondria of rat skeletal muscle. Am. J. Physiol.1963,216:1502.
[7] Bowers WP. Effect of exercise on the ultrastructure of skeletal muscle. Am.J.Physiol. 1985,118:333.
[8] 黄利长,等. 耐力训练对骨骼肌纤维类型和超微结构的影响[J].中国运动医学杂志,1989,(8):147.
[9] 张 勇,李静先. 运动性线粒体超微结构退行性改变[J]. 天津体育学院学报,1994,9(2):50~52.
[10] 陈丹英. 衰老的分子生物学进展[J]. 中华老年医学杂志,2001,20:157~160.
[11] Horky M, Horsky P, Kolar F. Different onset of nuclcolar activation in endiocardial endothelial cells and cardiomyocytes following pressure overload in rat heart. J Mol Cell Cardiol,1997,29:2 475~2 481.
[12] Zimber A, Nguyen QD, Gespach C. Nuclear bodies and compartments functional roles and cellular signaling in health and disease. Cell Signal,2004,16:1 085~1 104.
[13] 胡亚哲,程邦昌,等. 运动性心脏肥大心肌超微结构改变及意义[J]. 中国运动医学杂志,2005,33(10):936~939.
[14] 宋丹云,张文光. 运动对心肌超微结构影响的实验研究[J].福建中医学院学报,2003,13(6):38~40.
[15] Oakley D. General cardiology. The athletes’ heart. Heart, 2001,86:722~726.
[16] Thompson PD, D.Bruce. Dill Historical lecture. Historical Concepts of the athlete’s hear. Med Sci Sports Exerc,2004,36:363~370.
[17] Lorvidhaya P, Stephen Huang SK. Sudden cardiac death in athletes. Cardiology. 2003,100:186~195.
[18] Richard O.Cannon Ⅲ. Role of nitric oxide in cardiovascular disease:focus on the endothelium. J.Clinical Chemistry,1998,44:8(B)1 809~1 819
[19] 朱 全,浦钧宗,等. 游泳方法建立大鼠模拟过度训练模型[J].中国运动医学杂志,1998,17(2):137~140
[20] 张志胜,刘建峰,等. 超负荷训练对大鼠心脏左室心肌纤维及微血管的影响[J]. 北京体育大学学报,2001,24(1):50~51.
[21] 张 勇,张 薇,等. 急性运动心肌缺氧对大鼠心肌纤维和线粒体膜结构及功能的影响[J]. 天津体育学院学报,1997,12(1):18~22.
[22] 徐玉林. 肌收缩性能对体育锻炼的适应[J] .中国运动医学杂志,1990,9(2):14.
Experimental Study on the Ultrastructure Change of Cardiomyocyte in Athletic Heart
SUN Qiang
In order to study sudden cardiac death in athletes, the article is to see the pathologic change of cardiac myocyte in athletic hearts and explore the mechanism of the pathologic change by adapting rat swimming model with increasing workload for 8 weeks. The results showed: The aerobic training group, the number and volume of mitochondria increased and the membrane of mitochondria remained entire. The nucleus envelops of expansion nucleus appear as dentations. These changes were considered as the adaptation to exercises. At the same time in overload group some pathologic changes of the cardiac myocyte similar to senescence also appeared, such as mitochondria expanse, the crista disorder or disappearance, unclear mitochondria membrane, many dense bodies in cytoplasm, nucleus disfiguration and chromatin collection at edge. Conclusions: After moderate workload swimming training, physiological changes of cardiac myocyte occur, but after overload swimming training, some pathologic changes of cardiac myocyte appear. With the raise of exercise intension, the pathologic changes became more obvious even appearance of cardiac myocyte death.
Rat; Athletic heart; Ultrastructure; Experimentel study
G804.2
A
1007―6891(2013)04―0033―04
2012-11-17
齐鲁师范学院体育学院,济南 山东,250013。P.E School. of Qilu Normal University , Shandong Jinan, 250013.
