创伤性急性呼吸窘迫综合征及其治疗方法研究进展
2013-06-17刘相德
刘相德,高 燕
1.美国内布拉斯加大学医学中心呼吸与重症病科,美国内布拉斯加州奥吗哈市68198-5910;2.沈阳军区总医院急诊科,辽宁沈阳 110016
创伤是导致急性肺损伤(acute lung injury,ALI)和急性呼吸窘迫综合征(acute respiratory distress syndrome,ARDS)的第二常见原因。据报道,大约24%ALI和7%ARDS是由创伤引起的[1]。败血症是ALI或ARDS的第一常见原因,约三分之一的ARDS是由败血症引起[1]。
ARDS的病理生理机制是肺组织内广泛的急性炎症反应,导致肺组织损伤、通气与血液灌注比例失调,以及严重的低氧血症和肺顺应性降低的临床综合征[2]。过去认为 ALI是 ARDS 的早期表现[3]。但是最近柏林ARDS新定义中取消 ALI这一名词[4]。ARDS患者常需要用机械通气治疗,其病死率较高。因此,早期及时而正确地治疗ARDS,对于改善其预后很重要。ARDS后期组织修复期的治疗是预防肺纤维化和肺功能正常恢复的主要环节。本文就近年来有关ARDS的早期治疗和后期组织修复期治疗进展进行综述和讨论。
1 ARDS诊断标准
ARDS最早是在1967年由美国科罗拉多大学医学院的 Thomas Petty和 David Ashbaugh等提出的。当时他们在《柳叶刀》杂志上发表文章,第一次描述了12例年轻的患不同疾病的患者,突然表现呼吸急促伴有低氧血症,肺顺应性降低和胸部X线检查显示双侧肺部浸润性阴影等临床征象。后来于1994年,在“美欧ARDS共识会议”(American-European Consensus Conference on ARDS,AECC)上提出了ARDS的3个诊断标准:严重的急性低氧血症[即动脉血氧分压(mmHg)与吸入氧分率(%)之比,PaO2/FiO2<200];胸部 X线检查双侧浸润性阴影以及肺动脉楔形压 <0.177 kPa[3]。如果 PaO2/FiO2>200但是<300,即为ALI。AECC的上述诊断标准比较粗略,缺乏特异性和重复性,尤其是对通过呼气末正压(PEEP)通气方式应用呼吸机的患者[5]。
2011年,由欧洲重症医学会与美国胸科协会和重症医学会在德国柏林共同制定了新的标准,称为“柏林诊断标准(The Berlin Definition)”[4](表1)。柏林诊断标准提出,原发病后1周内突然有新的呼吸困难或原有的呼吸道症状突然加重,并有动脉血氧分压与吸入氧分压比(PaO2/FiO2)<300即可诊断为ARDS。依据低氧血症的程度,将ARDS分为轻度(200<PaO2/FiO2<300),中度(100<PaO2/FiO2<200)和重度 (PaO2/FiO2<100)。同时取消了ALI的概念。此外,原重度ARDS标准还有如下4个辅助性指标:X线表现为浸润性阴影程度,肺顺应性≤40 mL/98 Pa,呼气末正压≥981 Pa,校正后每分钟呼出气量(corrected expired volume per minute)≥10 L/min。上述4个辅助性指标对于重症ARDS的预后没有任何影响。因此,不再列入新的ARDS柏林诊断标准中。新的柏林诊断标准是对4 188例ARDS患者的临床数据进行整合分析后得出的经验性结论。如柏林诊断标准中所述,低氧血症程度与 ARDS的预后有明显关系。轻、中、重度ARDS的病死率分别为27%(95%CI=24%~30%)、32%(95%CI=29%~34%)和 45%(95%CI=42%~48%),P<0.001;生存者机械通气中位数(d)分别为5、7和9 d,差异有统计学意义(P<0.001)。
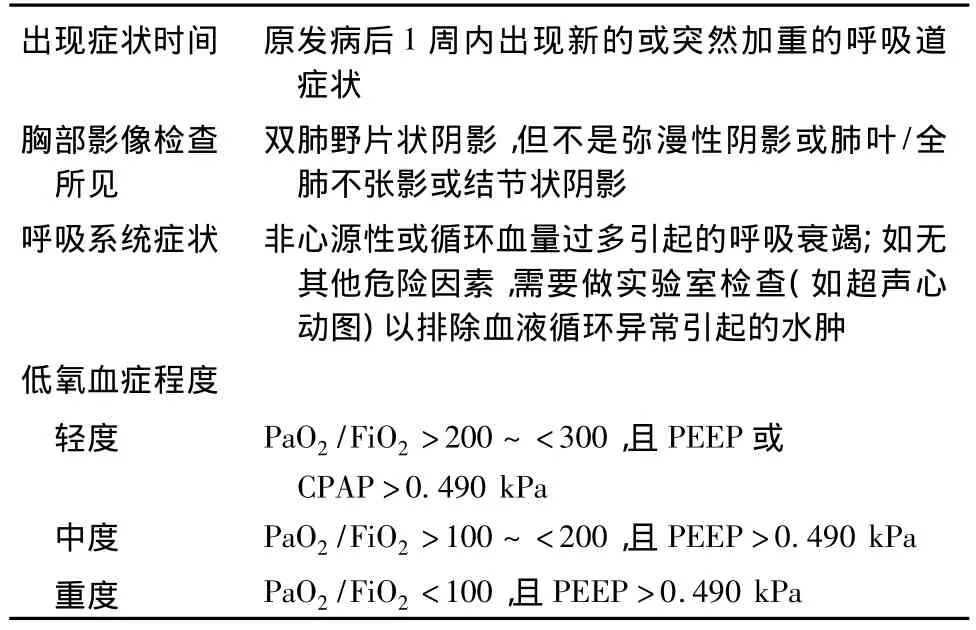
表1 ARDS柏林诊断标准
2 ARDS流行病学现状
据估计,美国2005年ARDS发病率为58/10,每年新发病例为141 500例,年死亡人数约为59 000例[1]。欧洲估计 ARDS年发病率为(4.2~13.5)/10万[6]。我国ARDS近期流行病学调查报道较少。
2009年对美国国家创伤中心数据库(National Trauma Databank)资料分析结果显示,6.5%ARDS发生于创伤后48 h内需要用机械通气的患者[7]。而且,这些创伤性ARDS患者中50%并发肺炎,病死率约为19%。平均机械通气20 d,ICU平均滞留22 d,平均住院 32 d[7]。创伤性 ARDS与其他原因的ARDS稍有不同,即前者年龄偏小而且其他并发症少[8]。
3 ARDS病死率
ARDS的病死率报道差异较大。Phua等[9]系统分析有关ARDS病死率报道的文献,发现过去20年ARDS病死率几乎没有改变,为36%~44%。ARDS网络组织(ARDS Network)调查各家临床试验结果却发现,过去20年(1997-2009年)ARDS的病死率有明显下降,从35%降到20%左右[10],而且认为可能与如下因素有关:允许高碳酸血症性机械通气、早期应用抗生素、溃疡和血栓的预防、输液量的有效控制,以及营养改善和其他脏器的保护性治疗等[11]。根据导致 ARDS原发病原因的不同,ARDS的病死率稍有不同。创伤引起的ARDS预后比败血症引起的ARDS预后好,病死率低[1]。
多数ARDS患者伴有多脏器功能衰竭,而且绝大多数ARDS患者死于败血症和多器官功能衰竭而不是死于呼吸衰竭。据研究报道,只有16%的ARDS患者死于呼吸衰竭。在发病早期(3 d内)死亡者多数死于原发病,而后期死亡者多数死于败血症[1]。
4 ARDS病因与危险因素
ARDS的病因较多,肺源性或非肺源性败血症是最常见原因(表2)。分析提示酗酒史、年龄、慢性肝疾患、免疫抑制药物应用,以及肥胖等是急性肺损伤的危险因素[12,13]。不同的是,糖尿病似乎有保护急性肺损伤的作用[14]。其机制尚不清楚,可能与外源性胰岛素的抗炎症作用有关。
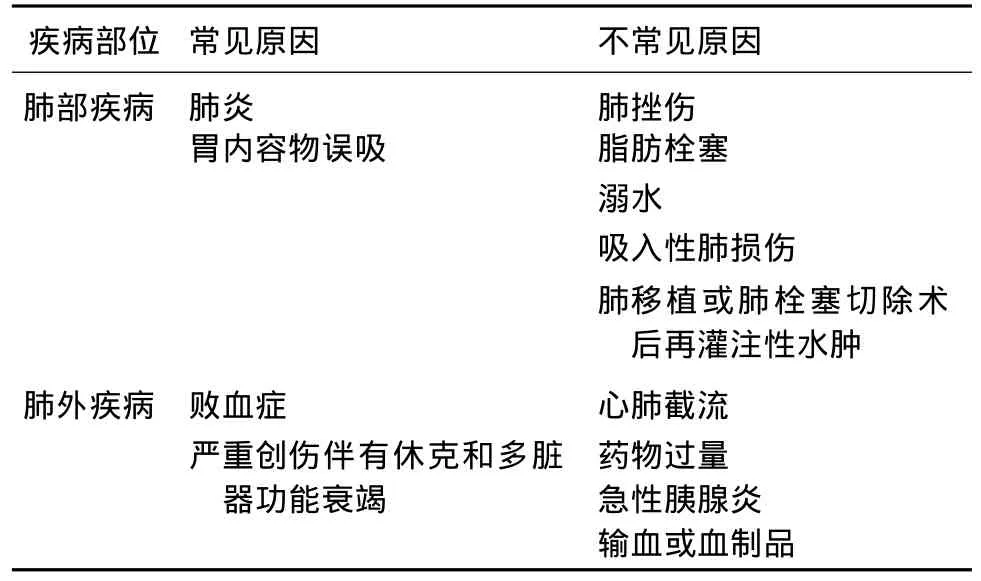
表2 ARDS的常见潜在病因
创伤后是否并发ARDS与以下因素有密切关系:创伤轻重程度计分(injury severity score,ISS)>25,是否有肺部挫伤,是否需要大量输液,入院时有无低血压,以及年龄>65岁等[15]。此外,急性生理与慢性健康评价Ⅱ(Acute Physiology and Chronic Health Evaluation,APACHEⅡ)计分和机械通气天数也是创伤后是否并发ARDS的主要因素[16]。长骨骨折和胸部创伤也是创伤后致ARDS的重要因素[17]。胸部三维CT扫描检查,如果肺挫伤的面积超过整个肺的20%,可明显增加ARDS发病率[18]。
5 ARDS生存者后遗症
所有重病患者生存后常有心理和机体上的后遗症。ARDS生存患者虽然其肺功能可能基本恢复正常,但其生活质量较差[19]。这些患者常伴有抑郁症、忧虑症或其他创伤后心理疾患(post-traumatic stress disorder,PTSD)。据对ARDS后生存8年的患者心理学研究报道,四分之一的ARDS患者生存8年后仍有 PTSD表现[20]。酗酒者、女性或年轻ARDS生存者易患抑郁症;PaO2/FiO2比值低或机械通气时间长的ARDS生存者易患忧虑症[21]。此外,ARDS生存者记忆力、注意力和工作能力等也有明显下降[22]。各种PTSD给患者和家属带来较大的经济和心理负担。因此,ARDS生存者的心理和机体的康复治疗对提高患者的生活质量很重要。
6 ARDS病理生理学机制
ARDS的特征性病理机制是由于严重的感染性或非感染性炎症反应而致肺泡上皮细胞和血管内皮细胞的损伤(表3)。如表3所示,ARDS早期由于血管内皮细胞损伤而致血管通透性增加,导致肺泡内大量蛋白性液体、炎性细胞和红细胞等渗出。肺泡腔内渗出的大量中性粒细胞和红细胞,以及中性粒细胞和巨噬细胞分泌的多种活性物质等可致肺泡透明膜的形成。渗出到肺泡组织内的中性粒细胞和巨噬细胞被激活后可释放多种炎性细胞因子,如IL-1、IL-6、IL-8和肿瘤坏死因子 -α(TNF-α)、蛋白酶、氧自由基和金属蛋白酶等对组织有害物质,后者可进一步损伤肺泡组织。I型肺泡上皮的损伤和肺泡基底膜暴露可导致菌血症和败血症;Ⅱ型肺泡上皮损伤可使肺泡表面活性物质降低而导致肺泡表面张力增高和肺泡塌陷。
肺泡内炎症反应还可引起肺间质内纤维母细胞增殖和趋化,并合成分泌I型胶原和纤维黏连素(fibronectin)等细胞外基质。肺成纤维细胞在ARDS后期肺泡组织重塑 (tissue remodeling)中起很重要的作用。ARDS后期,若小气道上皮细胞正常修复,Ⅱ型肺泡上皮细胞增殖和分化修复损伤的肺泡,渗出物被溶解或吞噬,增殖的成纤维细胞凋亡,聚集的胶原等细胞外基质被溶解,则小气道和肺泡组织修复正常,肺泡气体交换功能可能完全或大部分恢复正常。相反,如果成纤维细胞不进入凋亡期,反而继续分化为肌成纤维细胞 (myofibroblasts),肺间质内细胞外基质不断增多并被收缩,最终可致肺纤维化和肺动脉高压,从而导致右心衰,加重低氧血症等。
7 ARDS诊断方法和鉴别诊断
ARDS的诊断主要依据临床表现和原发病临床表现。新的柏林诊断标准提出,在原发病(创伤和败血症等)后1周内突发呼吸困难或原有的呼吸道症状突然加重,并有 PaO2/FiO2<300,即可诊断为ARDS。放射线检查可作为辅助诊断指标。胸部普通X光片可有助于鉴别诊断 ARDS,CT检查在ARDS的鉴别诊断上明显优于普通X线片,其缺点是不能在床边做CT检查。用18F标记的正电子放射断层扫描(FDG-PET)能检测到肺泡内炎症细胞,因而可用于判断肺部炎症程度[23]。但是这种FDGPET尚处于实验室研究阶段,还没有用于临床,而且由于其费用昂贵等原因,这一方法的临床应用前景不大[24]。
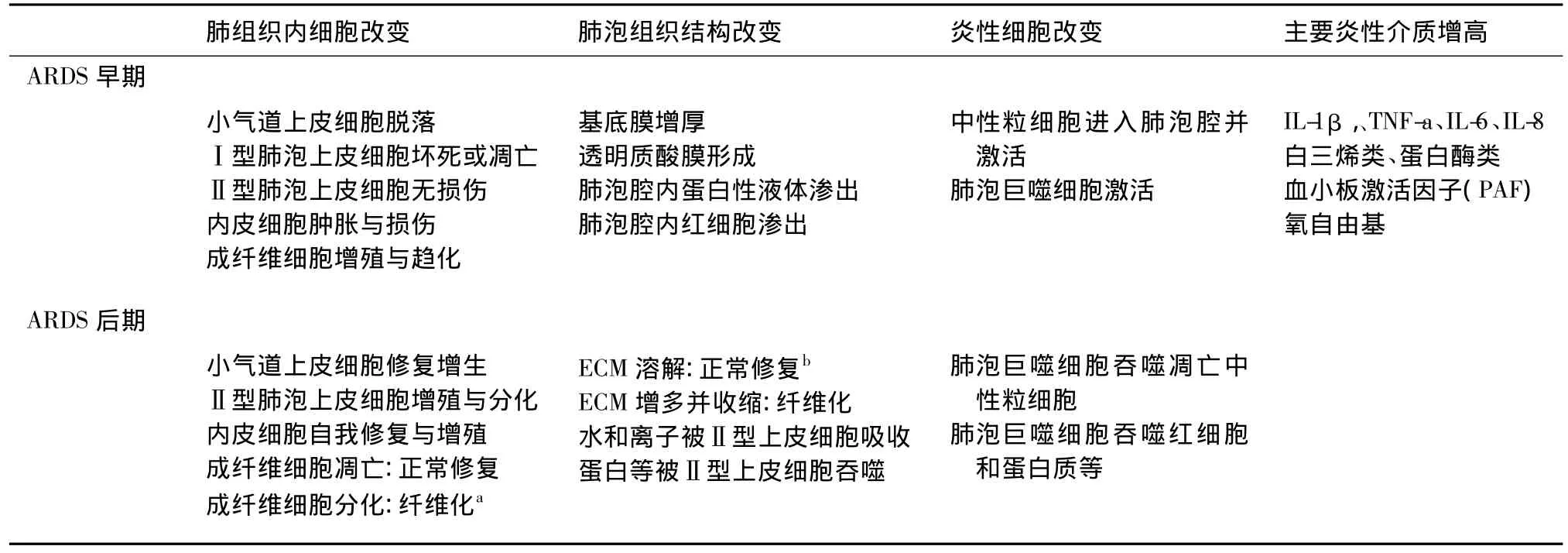
表3 ARDS早期和后期病理改变
肺泡灌洗(BAL)可用以进一步对ARDS患者肺局部渗出液进行清洗和抗菌治疗。但BAL过程可能加重低氧血症和高碳酸血症。因此,BAL不适合用于严重低氧血症患者。
1970-1980年,肺动脉插管(pulmonary artery catheters,PAC)常用于监测肺血流动态,不仅是ARDS的辅助诊断方法,而且指导ARDS补充液体治疗。近年来研究发现,PAC对ARDS的治疗和预后无任何益处,而且PAC是有创检查。因此,近年来基本不做PAC,而用其他无创性检查方法。无创性监测血流动态的检查方法包括经食管多普勒检测主动脉血流速度及动脉波分析(LiDCO)和胸部超声心动图等。LiDCO在ARDS的应用尚需随机对照的临床研究结果。超声心动图可用于ARDS的辅助诊断和指导治疗,但是有时影像质量较差(尤其是应用呼吸机的患者),因此,也不是理想的检查手段。
8 ARDS的治疗
ARDS的治疗分为早期治疗和后期治疗。早期治疗即急性期治疗,包括一般的支持治疗(如控制感染、早期营养支持、预防应急性溃疡和血栓),机械通气和原发病的治疗。后期治疗即恢复期促进肺组织修复与预防肺纤维化等。
8.1 ARDS早期治疗(表4)ARDS早期没有特殊的药物治疗。表4所示各种不同治疗方法,具有各自的优点和需要注意的缺点。
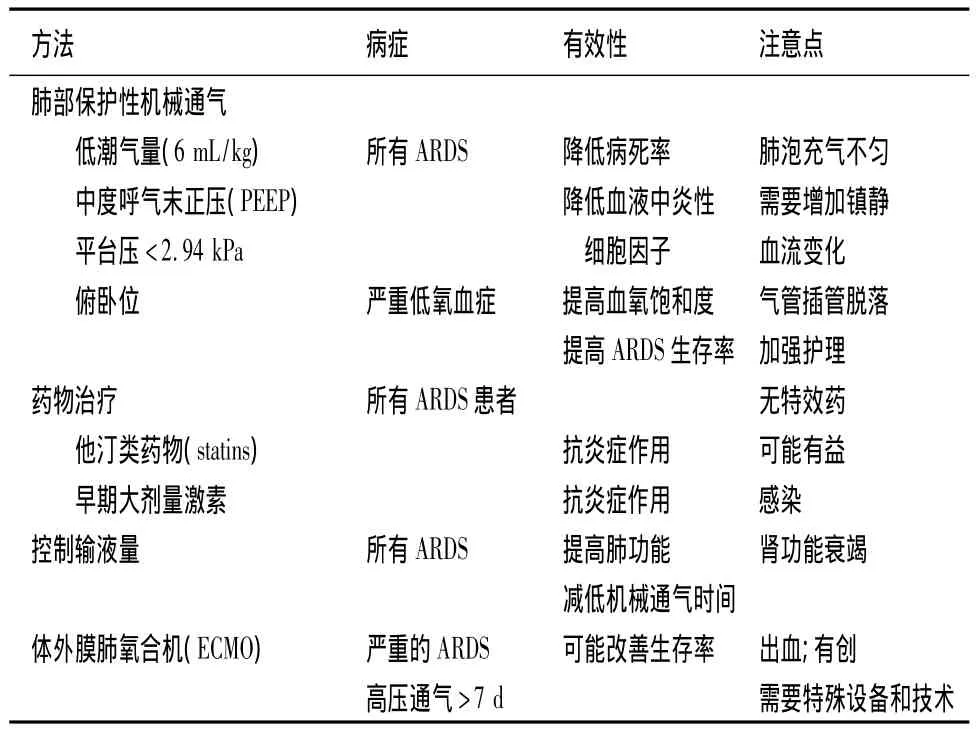
表4 ARDS早期治疗方法
8.1.1 机械通气
8.1.1.1 低潮气量、保护性机械通气 ARDS最主要的支持治疗是正压机械通气以保证正常氧饱和度。ARDS发病初期需采用容量控制性通气,保持通气容量在10~15 mL/kg体重,这种通气方式可保证正常动脉血氧饱和度。但是,机械通气可致肺泡组织损伤。20世纪90年代最具说服力的ARDS临床试验研究是由ARDS网络组织(ARDS Network)进行的关于传统潮气量(12 mL/kg)和低潮气量(6 mL/kg)机械通气的比较,以及允许高碳酸血症机械通气方法。结果发现,低潮气量机械通气组病死率较传统潮气量组低9%,同时血液内炎症性细胞因子明显下降[25]。在这个临床试验中,潮气量是根据患者标准体重(ideal body weight,IBW)计算的,同时保持平台压在<2.94 kPa,并允许高碳酸血症。该临床试验结果提供了ARDS最新经典治疗方法。之后的其他临床试验也证明高潮气量,低PEEP机械通气方式不适合于ARDS,因为这种通气方式不仅延长ARDS患者ICU滞留时间,而且增加病死率[26]。总之,许多随机对照临床试验证明,低潮气量通气是一种有效而且安全的通气方法,适用于 ARDS 的治疗[27]。
8.1.1.2 呼气末正压 (PEEP)通气 用 PEEP的目的是维持肺泡持续扩张和扩张已经塌陷的肺泡。有关ARDS患者机械通气PEEP标准,意见尚有分歧。PEEP有助于肺泡扩张,并减少肺泡渗出引起的肺不张,从而调整通气与血流比例。理想的PEEP压力是尽可能扩张肺泡,但又不造成肺泡组织损伤。近年来,3组大的临床对照试验结果发现,高PEEP(1.37 kPa)的临床症状比中等PEEP(0.785 kPa)有些改善,但两组病死率无差异[28]。也有学者经过整合分析有关PEEP水平和ARDS治疗的文献发现,对于中度ARDS(PaO2/FiO2<200)患者,使用中等PEEP(0.785 kPa)组生存率明显高于使用低PEEP(<0.490 kPa)组[29]。基于上述临床试验结果,ARDS网络组织制定的指南指出,PEEP水平应根据氧饱和度而定[30]。最新柏林ARDS新标准和美国胸科协会则主张用中等水平PEEP,即0.490~0.981 kPa 。
8.1.1.3 肺泡扩张法 低潮气量通气在保护肺不受进一步机械通气损伤的同时,有可能造成肺不张,从而加重低氧血症。许多研究曾试过各种能使塌陷的肺泡重新扩张或保持肺泡持续扩张状态的方法。其中包括持续PEEP或吸气后暂停法等能使肺内压增高的方法。对1 185例患者分析结果提示,肺泡扩张的上述各种手段能改善氧饱和度。但是,所有方法都是暂时改善氧饱和度,而且常伴有低血压和氧解离作用[31]。
8.1.1.4 高频振荡机械通气 高频振荡通气(HFOV)是一种非传统通气法。振荡频率在3~10Hz,是一种高呼吸频率与低潮气量组合的通气。这种通气法平均气道内压稍高于正常频率的常规通气法。低潮气量与气道内压增高相结合有助于肺泡扩张,因此,这种通气法似乎有益于ARDS治疗。目前常用于严重低血氧性ARDS患者的急救。但是,最近美国胸科协会年会(2013年5月17-22日,美国费城)提出 HFOV不适合于 ARDS患者(Clinical Year in Review 3)。
8.1.1.5 部分液体通气法 部分液体通气法(partial liquid ventilation,PLV)是一种特殊的通气法,即部分肺泡内灌入一种叫全氟化碳(perfluorocarbon)的惰性液体后给患者正常的机械通气。全氟化碳具有一种向血液内释放氧气的功能,因而有助于改善气体交换功能。尽管动物实验证实PLV能改善气体交换功能并降低肺损伤,但是临床随机对照实验的结果并没有降低ARDS的病死率[32]。因此,目前不提倡用PLV治疗ARDS。
8.1.1.6 俯卧位 俯卧位能持续改善呼吸衰竭患者的血氧饱和度。其机制可能与以下因素有关:底部肺泡组织扩张,血流重新分布到未受损伤的肺泡组织,降低机械通气引起的通气/血流灌注比例失调,减轻前纵隔脏器对肺组织的压力使肺泡容易扩张,以及呼吸道分泌物容易清除等[33,34]。Gattinoni等[35]报道,俯卧位机械通气能明显改善重度ARDS患者(PaO2/FiO2<100)的生存率。因此,建议严重低氧血症的ARDS患者采用俯卧位通气治疗。最近,Guerin等[36]在《新英格兰医学杂志》上报道,俯卧位使病死率从仰卧位的32.8%降到16.0%。俯卧位治疗的副作用有褥疮和气管插管的脱落。采用俯卧位治疗时,需要加强护理。
8.1.2 药物治疗 到目前为止,尽管外源性肺泡活性物质有益于婴儿呼吸窘迫综合征的治疗,但对于成人的ARDS,没有一种有效的药物治疗方法。
8.1.2.1 他汀类药物 近年来动物模型和临床实验研究发现,他汀类(statins)药物能降低败血症等引起的 ALI病死率[37,38],其作用机制可能与其抗炎症作用、免疫调节作用和抗自由基引起的组织损伤作用等有关[39]。目前,美国国家卫生部(NIH)正在进行大样本临床实验,旨在确定statins对败血症引起的ALI的临床疗效。2013年5月美国胸科协会费城年会上(Clinical Year in Review 3)指出,statins有可能是救治ARDS的有效药物。
8.1.2.2 神经肌肉松弛剂(neuromuscular agents,NMA) 用于达到同步机械通气的目的。研究报道,重度ARDS患者(即PaO2/FiO2<100)使用NMA可明显改善血氧饱和度并减少炎性细胞因子的释放[40]。但是,使用NMA的副作用是可能引起严重的神经肌肉损伤,延长ICU滞留时间,以及增加病死率等[41]。因此,目前不主张常规使用NMA。
8.1.2.3 血管扩张剂(Vasodilators) 包括一氧化氮(nitric oxide,NO)的吸入和前列腺素类物质(prostanoids)。机械通气的同时,患者吸入NO能改善通气/血流比例,因为NO可以选择性地扩张肺动脉[42]。但是,临床试验发现,NO吸入治疗ARDS的副反应是导致高铁血红蛋白血症,产生有害的二氧化氮和肾功能衰竭等[43]。据报道,2004年加拿大30%的急诊科医生用过NO吸入法治疗ARDS患者[44]。Cocharne系统分析 14个临床对照试验(1 303例 ARDS患者)结果发现,吸入 NO治疗ARDS只能短暂地改善血氧饱和度,不能降低病死率,反而延长ICU滞留时间,并增高肾功能衰竭的概率[45]。因此,目前NO吸入法已经不再用于治疗ARDS。前列环素(prostacyclins,PGI2)可引起肺血管扩张,常用于治疗肺动脉高压。此外,PGI2还有调节免疫功能的作用,能减轻中性粒细胞黏附作用和抑制中性粒细胞和肥大细胞激活等[45]。雾化吸入PGI2后改善血氧饱和,扩张肺血管和改善通气/血流比例的作用明显优于NO吸入[46]。但是,PGI2的应用没有改善ARDS的预后和临床症状。因此,目前不主张用前列腺素类药物。
8.1.2.4 其他药物 如抗炎症药物(anti-inflammatory agents)包括激素、酮康唑(ketoconazole)、己酮可可碱(pentoxifylline)、西维来司(sivelestat)等;抗氧化剂(antioxidant);增强免疫的营养素(immunonutrition)以及表面活性物质等药物,对ARDS的治疗无明显效果[45]。
8.1.3 输液治疗 严重创伤患者需要输液治疗。但是,足够的证据表明,过早地大量输入含红细胞的血制品(packed red blood cells,PRBCs)是导致ARDS的重要因素之一[47]。输入新鲜的冷冻血浆(fresh frozen plasma,FFP)也可致 ARDS,但是输入血小板及其冷冻制品则与ARDS无关[48]。输入去除白细胞的血制品与正常的输血比较,2组ARDS并发症发生率无差异[49]。另外,也有学者对比研究了输入ABO-同型(ABO-identical)血浆和ABO-相配但不同型(ABO-compatible but not identical)血浆与ARDS发生率的关系。结果发现,输入ABO-相配但不同型血浆的患者ARDS和败血症发生率高于输ABO-同型的患者,而且输入的量越多,其发生率越高[50]。
8.1.4 间充质干细胞(mesenchymal stem cell,MSC)的应用 MSC在ARDS早期治疗方面的研究比较多,但是尚处于体外或动物实验阶段[51,52]。动物实验证实,MSC可明显降低肺损伤,能降低炎性反应及其细胞因子的释放,减轻肺水肿等[53]。体外实验发现,MSC能减轻内毒素引起的人肺损伤[54];MSC能通过分泌血管生成素-1(angiopoietin-1)促进II型肺泡上皮细胞的修复,从而降低其蛋白质通透性[55];MSC能明显促进肺泡内液体清除并增高表皮细胞生长因子(keratinocyte growth factor,KGF)的表达,KGF具有刺激II型肺泡上皮细胞生长和清除肺水肿的作用[56],从而能促进肺组织的正常修复。虽然人体内应用MSC治疗ARDS的临床试验尚未开始,但是已有用KGF治疗ALI的临床试验。MSC将是很有前景的ARDS治疗方法。
8.1.5 体外膜肺氧合机(Extracorporeal membrane oxygenation,ECMO) 在欧美,ECMO治疗需要在特定的专科医疗中心进行。顾名思义,体外膜肺氧合是指在体外用膜肺氧合机将患者的血液进行气体交换后,再重输回患者体内的方法。这种方法专业性较强,而且是有创新性地治疗重度顽固性低氧血症性ARDS的方法。早期美国卫生部资料报道,由于ECMO具有一定副作用(抗凝治疗引起的大出血等)且疗效一般,ECMO在20世纪70年代临床应用不多。但是,近年来临床研究证实,ECMO能明显提高创伤性ARDS患者的生存率。因此,逐渐受到重视,尤其在战伤患者救治上。此外,随着制造技术的改进,已经有手提式ECMO机用于军队前线野战医院和伤员转移途中[57]。
8.2 ARDS后期治疗 ARDS后期治疗主要是指ARDS后肺组织修复期的治疗。近年来,ARDS后组织重塑(tissue remodeling)愈来愈受到重视。因为ARDS后期正常的组织修复及肺纤维化的预防与肺功能恢复关系密切。因此,针对后期组织修复的治疗和防止肺纤维化也是ARDS治疗的重要环节。ARDS后期治疗主要包括抑制炎症反应、改善肺泡内液体和蛋白质的清除、防止肺纤维化、以及改善肺循环系统等。目前,能促进肺损伤后组织修复和预防肺纤维化的途经主要有以下几种。
8.2.1 应用两亲性大分子物质(amphiphilic macromolecule)直接修复损伤的肺泡上皮膜 Plataki等[58]报道,既亲水又亲脂(两亲性)的大分子物质(Poloxamer 188)可以明显促进大鼠肺泡上皮细胞在体内和体外修复功能。
8.2.2 间充质干细胞 (mesenchymal stem cells,MSC)植入或吸入 MSC不仅在ARDS的早期治疗有效,而且在ARDS后期组织修复中也可能起重要的作用[59]。其作用机制可能有以下几方面:(1)MSC可能分化成肺泡上皮细胞(即间质细胞-上皮细胞转化,mesenchymal-epithelial transition,MET)取代受损伤的上皮细胞,从而修复肺泡组织。(2)ARDS的特点是急性而严重的炎症反应,过去试图抑制这种急性炎症反应的各种方法均未奏效。因此,现今新的策略是从调节免疫反应入手治疗ARDS。MSC可能是最有效的体内“免疫调节者(immunomodulator)”,MSC可能使ARDS免疫反应“重新程序化(reprogram)”,从而既保存宿主的正常免疫功能,又抑制炎症反应引起的对机体有害的免疫反应。(3)MSC可能通过自分泌(autocrine)和旁分泌(paracrine)机制,促进肺泡内渗出物的吸收和清除,以及肺泡表面活性物质的合成[2]。(4)ARDS常累及多脏器。动物实验证实,MSC不仅能减轻肾、肝和心脏等脏器的损伤,而且还能促进这些脏器的功能恢复[60,61]。(5)MSC 可能减轻败血症,其可能的机制包括增强细胞吞噬功能,从而提高清除细菌的能力[62],以及分泌抗细菌的多肽类物质等[63]。(6)静脉注入后,MSC直接向受损伤的局部组织趋化[64,65]。利用 MSC 的这一功能,可将有治疗作用的基因或质粒送达到肺组织损伤的局部,以达到促进局部组织修复的目的。(7)MSC可能不仅直接参与肺泡上皮细胞修复,还可能直接参与肺血管内皮细胞修复。因为,一方面MSC可以经气道直接送达到受损的肺泡组织以修复肺泡上皮;另一方面,体内血液都要经过肺循环。因此,MSC还可以经血液循环到达肺内以修复肺血管内皮细胞。总之,MSC细胞学治疗方法可能成为治疗ARDS的主要手段之一。
8.2.3 应用生长因子刺激体内干细胞增殖和分化
除了上述的植入或吸入自身或异体干细胞外,还可以用外源性生长因子刺激体内组织干细胞(tissue stem cell)或MSC,以达到组织修复的目的。具有这种刺激体内干细胞生长作用的因子有上皮细胞生长因子(epithelium growth factor,EGF)、表皮细胞生长因子(keratinocyte growth factor,KGF)和肝细胞生长因子(hepatocyte growth factor,HGF)等。上述3种生长因子不仅具有促II型肺泡上皮细胞分裂和生长的作用,而且还具有相互协同作用,促进II型上皮细胞成熟和分泌肺泡表面活性物质[66]。ALI动物模型研究发现,EGF有益于肺组织修复,即阻断EGF受体对肺组织的修复不利[67,68]。KGF可能刺激抗炎症细胞因子的分泌,以及调节肺上皮细胞的趋化等[69]。HGF可减轻博来霉素(bleomycin)引起的小鼠ALI和肺纤维化[70]。此外,血管内皮生长因子(vascular endothelium growth factor,VEGF)可能通过刺激血管内皮细胞的修复功能而促进肺组织修复。动物实验结果表明,VEGF的组织修复效果并不理想[71]。
8.2.4 选择性地抑制各种金属蛋白酶(MMP) 选择性地抑制各种MMP,以促进I型胶原分解的同时避免MMP对肺泡基底膜组织的损伤。选择性地刺激或抑制MMP可能有助于促进组织修复。研究发现,静脉注入β2-受体激动剂 (沙丁胺醇,salbutamol)能减轻 ARDS患者肺水肿,其机制与刺激MMP-9 的作用有关[72,73]。与 MMP-9 相反,MMP-8可能不利于肺组织修复,因为动物实验发现,抑制MMP-8功能有助于减轻肺损伤和肺纤维化[74,75]。
除上述针对组织修复期的新治疗方法外,其他最新ARDS治疗方法或药物及其作用机制见表5。这些方法或药物还需要经随机对照临床试验证实。

表5 最新ARDS治疗方法或药物及其作用机制
9 结语
本文分析了近年来国际上对ARDS定义的共识,并着重归纳了目前对ARDS的治疗方法。保护性机械通气仍是早期治疗ARDS的主要手段。间充质干细胞的肺局部应用有可能成为新的治疗ARDS的手段,但是目前仍处于动物实验阶段,亟待在临床上证实。ARDS后期,即组织修复期的治疗是预防肺纤维化和肺功能正常恢复的主要环节。创伤性ARDS生存者后遗症(包括机体和心理)的治疗值得重视。
[1]Rubenfeld GD,Caldwell E,Peabody E,et al.Incidence and outcomes of acute lung injury[J].N Engl J Med,2005,353(16):1685-1693.
[2]Ware LB,Matthay MA.The acute respiratory distress syndrome[J].N Engl J Med,2000,342(18):1334 -1349.
[3]Bernard GR,Artigas A,Brigham KL,et al.The American-European Consensus Conference on ARDS.Definitions,mechanisms,relevant outcomes,and clinical trial coordination[J].Am J Respir Crit Care Med,1994,149(3Pt 1):818 -824.
[4]Ranieri VM,Rubenfeld GD,Thompson BT,et al.Acute respiratory distress syndrome:the Berlin Definition[J].J AMA,2012,307(23):2526-2533.
[5]Esteban A,Fernandez-Segoviano P,Frutos-Vivar F,et al.Comparison of clinical criteria for the acute respiratory distress syndrome with autopsy findings[J].Ann Intern Med,2004,141(6):440-445.
[6]Luhr OR,Antonsen K,Karlsson M,et al.Incidence and mortality after acute respiratory failure and acute respiratory distress syndrome in Sweden,Denmark,and Iceland[J].Am J Respir Crit Care Med,1999,159(6):1849-1861.
[7]Recinos G,DuBose JJ,Teixeira PG,et al.ACS trauma centre designation and outcomes of post-traumatic ARDS:NTDB analysis and implications for trauma quality improvement[J].Injury,2009,40(8):856-859.
[8]Calfee CS,Eisner MD,Ware LB,et al.Trauma-associated lung injury differs clinically and biologically from acute lung injury due to other clinical disorders[J].Crit Care Med,2007,35(10):2243-2250.
[9]Phua J,Badia JR,Adhikari NK,et al.Has mortality from acute respiratory distress syndrome decreased over time?:A systematic review[J].Am J Respir Crit Care Med,2009,179(3):220-227.
[10]Spragg RG,Bernard GR,Checkley W,et al.Beyond mortality:future clinical research in acute lung injury[J].Am J Respir Crit Care Med,2010,181(10):1121 -1127.
[11]Stapleton RD,Wang BM,Hudson LD,et al.Causes and timing of death in patients with ARDS[J].Chest,2005,128(2):525 -532.
[12]Berkowitz DM,Danai PA,Eaton S,et al.Alcohol abuse enhances pulmonary edema in acute respiratory distress syndrome[J].Alcohol Clin Exp Res,2009,33(10):1690 -1696.
[13]Gajic O,Dabbagh O,Park PK,et al.Early identification of patients at risk of acute lung injury:evaluation of lung injury prediction score in a multicenter cohort study[J].Am J Respir Crit Care Med,2010,183(4):462 -470.
[14]Moss M,Guidot DM,Steinberg KP,et al.Diabetic patients have a decreased incidence of acute respiratory distress syndrome[J].Crit Care Med,2000,28(7):2187 -2192.
[15]Miller PR,Croce MA,Kilgo PD,et al.Identification of independent risk factors[J].Am Surg,2002,68(10):845 - 850;discussion 850-841.
[16]Wu J,Sheng L,Ma Y,et al.The analysis of risk factors of impacting mortality rate in severe multiple trauma patients with posttraumatic acute respiratory distress syndrome[J].Am J Emerg Med,2008,26(4):419 -424.
[17]Navarrete-Navarro P,Rivera-Fernandez R,Rincon-Ferrari MD,et al.Early markers of acute respiratory distress syndrome development in severe trauma patients[J].J Crit Care,2006,21(3):253-258.
[18]Strumwasser A,Chu E,Yeung L,et al.A novel CT volume index score correlates with outcomes in polytrauma patients with pulmonary contusion[J].J Surg Res,2011,170(2):280 - 285.
[19]Herridge MS,Cheung AM,Tansey CM,et al.One-year outcomes in survivors of the acute respiratory distress syndrome[J].N Engl J Med,2003,348(8):683 -693.
[20]Davydow DS,Desai SV,Needham DM,et al.Psychiatric morbidity in survivors of the acute respiratory distress syndrome:a systematic review[J].Psychosom Med,2008,70(4):512 -519.
[21]Hopkins RO,Key CW,Suchyta MR,et al.Risk factors for depression and anxiety in survivors of acute respiratory distress syndrome[J].Gen Hosp Psychiatry,2010,32(2):147 -155.
[22]Hopkins RO,Weaver LK,Collingridge D,et al.Two-year cognitive,emotional,and quality-of-life outcomes in acute respiratory distress syndrome[J].Am J Respir Crit Care Med,2005,171(4):340-347.
[23]Bellani G,Messa C,Guerra L,et al.Lungs of patients with acute respiratory distress syndrome show diffuse inflammation in normally aerated regions:a [18F]-fluoro-2-deoxy-D-glucose PET/CT study[J].Crit Care Med,2009,37(7):2216 -2222.
[24]Dushianthan A,Grocott MP,Postle AD,et al.Acute respiratory distress syndrome and acute lung injury[J].Postgrad Med J,2011,87(1031):612 -622.
[25]ANON:Ventilation with lower tidal volumes as compared with traditional tidal volumes for acute lung injury and the acute respiratory distress syndrome.The Acute Respiratory Distress Syndrome Network[J].N Engl J Med,2000,342(18):1301 - 1308.
[26]Villar J,Perez-Mendez L,Lopez J,et al.An early PEEP/FIO2 trial identifies different degrees of lung injury in patients with acute respiratory distress syndrome[J].Am J Respir Crit Care Med,2007,176(8):795 -804.
[27]Kahn JM,Andersson L,Karir V,et al.Low tidal volume ventilation does not increase sedation use in patients with acute lung injury[J].Crit Care Med,2005,33(4):766 -771.
[28]Mercat A,Richard JC,Vielle B,et al.Positive end-expiratory pressure setting in adults with acute lung injury and acute respiratory distress syndrome:a randomized controlled trial[J].JAMA,2008,299(6):646 -655.
[29]Briel M,Meade M,Mercat A,et al.Higher vs lower positive end-expiratory pressure in patients with acute lung injury and acute respiratory distress syndrome:systematic review and meta-analysis[J].JAMA,2010,303(9):865 -873.
[30]Brower RG,Lanken PN,MacIntyre N,et al.Higher versus lower positive end-expiratory pressures in patients with the acute respiratory distress syndrome[J].N Engl J Med,2004,351(4):327-336.
[31]Fan E,Wilcox ME,Brower RG,et al.Recruitment maneuvers for acute lung injury:a systematic review[J].Am J Respir Crit Care Med,2008,178(11):1156 -1163.
[32]Kacmarek RM,Wiedemann HP,Lavin PT,et al.Partial liquid ventilation in adult patients with acute respiratory distress syndrome[J].Am J Respir Crit Care Med,2006,173(8):882-889.
[33]Pelosi P,Bottino N,Chiumello D,et al.Sigh in supine and prone position during acute respiratory distress syndrome[J].Am J Respir Crit Care Med,2003,167(4):521 -527.
[34]Albert RK,Hubmayr RD.The prone position eliminates compression of the lungs by the heart[J].Am J Respir Crit Care Med,2000,161(5):1660 -1665.
[35]Gattinoni L,Carlesso E,Taccone P,et al.Prone positioning improves survival in severe ARDS:a pathophysiologic review and individual patient meta-analysis[J].Minerva Anestesiol,2010,76(6):448-454.
[36]Guerin C,Reignier J,Richard JC,et al.Prone positioning in severe acute respiratory distress syndrome[J].N Engl J Med,2013,368(23):2159 -2168.
[37]Shyamsundar M,McKeown ST,O'Kane CM,et al.Simvastatin decreases lipopolysaccharide-induced pulmonary inflammation in healthy volunteers[J].Am J Respir Crit Care Med,2009,179(12):1107-1114.
[38]Corrales-Medina VF,Musher DM.Immunomodulatory agents in the treatment of community-acquired pneumonia:a systematic review[J].J Infect,2011,63(3):187 -199.
[39]De Loecker I,Preiser JC.Statins in the critically ill[J].Ann Intensive Care,2012,2(1):19.
[40]Forel JM,Roch A,Marin V,et al.Neuromuscular blocking agents decrease inflammatory response in patients presenting with acute respiratory distress syndrome[J].Crit Care Med,2006,34(11):2749-2757.
[41]Arroliga A,Frutos-Vivar F,Hall J,et al.Use of sedatives and neuromuscular blockers in a cohort of patients receiving mechanical ventilation[J].Chest,2005,128(2):496 -506.
[42]Hsu CW,Lee DL,Lin SL,et al.The initial response to inhaled nitric oxide treatment for intensive care unit patients with acute respiratory distress syndrome[J].Respiration,2008,75(3):288-295.
[43]Adhikari NK,Burns KE,Friedrich JO,et al.Effect of nitric oxide on oxygenation and mortality in acute lung injury:systematic review and meta-analysis[J].BMJ,2007,334(7597):779.
[44]Meade MO,Jacka MJ,Cook DJ,et al.Survey of interventions for the prevention and treatment of acute respiratory distress syndrome[J].Crit Care Med,2004,32(4):946 -954.
[45]Afshari A,Brok J,Moller AM,et al.Aerosolized prostacyclin for acute lung injury(ALI)and acute respiratory distress syndrome(ARDS)[J].Cochrane Database Syst Rev,2010,(8):CD007733.
[46]Walmrath D,Schneider T,Schermuly R,et al.Direct comparison of inhaled nitric oxide and aerosolized prostacyclin in acute respiratory distress syndrome[J].Am J Respir Crit Care Med,1996,153(3):991 -996.
[47]Chaiwat O,Lang JD,Vavilala MS,et al.Early packed red blood cell transfusion and acute respiratory distress syndrome after trauma[J].Anesthesiology,2009,110(2):351 -360.
[48]Watson GA,Sperry JL,Rosengart MR,et al.Fresh frozen plasma is independently associated with a higher risk of multiple organ failure and acute respiratory distress syndrome[J].J Trauma,2009,67(2):221 -227;discussion 228 -230.
[49]Watkins TR,Rubenfeld GD,Martin TR,et al.Effects of leukoreduced blood on acute lung injury after trauma:a randomized controlled trial[J].Crit Care Med,2008,36(5):1493 -1499.
[50]Inaba K,Branco BC,Rhee P,et al.Impact of ABO-identical vs ABO-compatible nonidentical plasma transfusion in trauma patients[J].Arch Surg,2010,145(9):899 -906.
[51]Sutsko RP,Young KC,Ribeiro A,et al.Long-term reparative effects of mesenchymal stem cell therapy following neonatal hyperoxia-induced lung injury[J].Pediatr Res,2013,73(1):46-53.
[52]Li LF,Liu YY,Yang CT,et al.Improvement of ventilator-induced lung injury by IPS cell-derived conditioned medium via inhibition of PI3K/Akt pathway and IP-10-dependent paracrine regulation[J].Biomaterials,2013,34(1):78 -91.
[53]Matthay MA,Ware LB,Zimmerman GA.The acute respiratory distress syndrome[J].J Clin Invest,2012,122(8):2731-2740.
[54]Lee JW,Fang X,Gupta N,et al.Allogeneic human mesenchymal stem cells for treatment of E.coli endotoxin-induced acute lung injury in the ex vivo perfused human lung[J].Proc Natl Acad Sci USA,2009,106(38):16357-16362.
[55]Fang X,Neyrinck AP,Matthay MA,et al.Allogeneic human mesenchymal stem cells restore epithelial protein permeability in cultured human alveolar type II cells by secretion of angiopoietin-1[J].J Biol Chem,2010,285(34):26211 -26222.
[56]Matthay MA,Goolaerts A,Howard JP,et al.Mesenchymal stem cells for acute lung injury:preclinical evidence[J].Crit Care Med,2010,38(10 Suppl):S569 -573.
[57]Allan PF,Osborn EC,Bloom BB,et al.The introduction of extracorporeal membrane oxygenation to aeromedical evacuation[J].Mil Med,2011,176(8):932 -937.
[58]Plataki M,Lee YD,Rasmussen DL,et al.Poloxamer 188 facilitates the repair of alveolus resident cells in ventilator-injured lungs[J].Am J Respir Crit Care Med,2011,184(8):939 -947.
[59]Hayes M,Curley G,Laffey JG.Mesenchymal stem cells-a promising therapy for Acute Respiratory Distress Syndrome[J].F1000 Med Rep,2012,4:2.
[60]Gatti S,Bruno S,Deregibus MC,et al.Microvesicles derived from human adult mesenchymal stem cells protect against ischaemia-reperfusion-induced acute and chronic kidney injury[J].Nephrol Dial Transplant,2011,26(5):1474 -1483.
[61]Kanazawa H,Fujimoto Y,Teratani T,et al.Bone marrow-derived mesenchymal stem cells ameliorate hepatic ischemia reperfusion injury in a rat model[J]. PLoS One,2011, 6(4):e19195.
[62]Mei SH,Haitsma JJ,Dos Santos CC,et al.Mesenchymal stem cells reduce inflammation while enhancing bacterial clearance and improving survival in sepsis[J].Am J Respir Crit Care Med,2010,182(8):1047 -1057.
[63]Krasnodembskaya A,Song Y,Fang X,et al.Antibacterial effect of human mesenchymal stem cells is mediated in part from secretion of the antimicrobial peptide LL-37[J].Stem Cells,2010,28(12):2229-2238.
[64]Chapel A,Bertho JM,Bensidhoum M,et al.Mesenchymal stem cells home to injured tissues when co-infused with hematopoietic cells to treat a radiation-induced multi-organ failure syndrome[J].J Gene Med,2003,5(12):1028 -1038.
[65]Bensidhoum M,Chapel A,Francois S,et al.Homing of in vitro expanded Stro-1-or Stro-1+human mesenchymal stem cells into the NOD/SCID mouse and their role in supporting human CD34 cell engraftment[J].Blood,2004,103(9):3313 -3319.
[66]Lindsay CD.Novel therapeutic strategies for acute lung injury in-duced by lung damaging agents:the potential role of growth factors as treatment options[J].Hum Exp Toxicol,2011,30(7):701-724.
[67]Plopper CG,St George JA,Read LC,et al.Acceleration of alveolar type II cell differentiation in fetal rhesus monkey lung by administration of EGF[J].Am J Physiol,1992,262(3 Pt 1):L313-321.
[68]Harada C,Kawaguchi T,Ogata-Suetsugu S,et al.EGFR tyrosine kinase inhibition worsens acute lung injury in mice with repairing airway epithelium[J].Am J Respir Crit Care Med,2011,183(6):743 -751.
[69]Panoskaltsis-Mortari A,Ingbar DH,Jung P,et al.KGF pretreatment decreases B7 and granzyme B expression and hastens repair in lungs of mice after allogeneic BMT[J].Am J Physiol Lung Cell Mol Physiol,2000,278(5):L988 - 999.
[70]Dohi M,Hasegawa T,Yamamoto K,et al.Hepatocyte growth factor attenuates collagen accumulation in a murine model of pulmonary fibrosis[J].Am J Respir Crit Care Med,2000,162(6):2302-2307.
[71]Medford AR,Millar AB.Vascular endothelial growth factor(VEGF)in acute lung injury(ALI)and acute respiratory distress syndrome(ARDS):paradox or paradigm?[J].Thorax,2006,61(7):621-626.
[72]O'Kane CM,McKeown SW,Perkins GD,et al.Salbutamol upregulates matrix metalloproteinase-9 in the alveolar space in the acute respiratory distress syndrome[J].Crit Care Med,2009,37(7):2242-2249.
[73]Perkins GD,McAuley DF,Thickett DR,et al.The beta-agonist lung injury trial(BALTI):a randomized placebo-controlled clinical trial[J].Am J Respir Crit Care Med,2006,173(3):281 -287.
[74]Albaiceta GM,Gutierrez-Fernandez A,Garcia-Prieto E,et al.Absence or inhibition of matrix metalloproteinase-8 decreases ventilator-induced lung injury[J].Am J Respir Cell Mol Biol,2010,43(5):555 -563.
[75]Garcia-Prieto E,Gonzalez-Lopez A,Cabrera S,et al.Resistance to bleomycin-induced lung fibrosis in MMP-8 deficient mice is mediated by interleukin-10 [J]. PLoS One,2010,5(10):e13242.
