去甲肾上腺素与血管加压素改善脓毒症休克预后比较研究Meta分析
2013-06-17周飞虎
周飞虎,宋 青
解放军总医院重症医学科,北京100853
一直以来,去甲肾上腺素和多巴胺被作为脓毒症休克(septic shock)患者治疗的一线药物[1]。在多数情况下,二者与积极控制原发病灶、液体复苏和纠正酸中毒等联合应用能收到较好的效果。但仍有一些脓毒症休克患者常因存在顽固性低血压及儿茶酚胺类药物抵抗现象,病死发生率高[2]。对此类患者,临床应用大剂量去甲肾上腺素等血管活性药物,往往会引起一些严重的不良反应,如组织耗氧增加、肾脏和系膜血流减少、肺循环阻力增大等。研究发现,感染性休克患者血中的血管加压素(vasopressin)水平较正常人明显降低。血管加压素主要通过直接和间接作用增加外周血管阻力而使平均动脉压升高,并可减少儿茶酚胺类药物的用药剂量,但并不增加心输出量和心率以及肺动脉压[3]。Patel等[4]指出,血管加压素可显著降低儿茶酚胺类药物剂量、增加患者尿量和肌酐清除率。Gordon等[5]亦指出,与去甲肾上腺素治疗脓毒症休克相比,血管加压素可以明显降低患者的心率。2012年拯救严重脓毒症运动会议发表的严重脓毒症和感染性休克治疗指南中已将血管加压素作为二线血管活性药推荐应用[1]。但也有研究指出,与去甲肾上腺素相比,小剂量血管加压素并不能降低脓毒症休克患者病死发生率[6]。目前尚无系统的研究表明去甲肾上腺素和血管加压素对脓毒症患者血流动力学、代谢以及预后的影响。为得到更可靠的结论,本研究纳入相关随机对照研究(randomized clinical trial,RCT),并对去甲肾上腺素和血管加压素对脓毒症休克患者血流动力学及代谢相关影响进行Meta分析,以期更好地指导临床治疗。
1 材料与方法
1.1 纳入标准
1.1.1 研究设计 相关随机对照研究。
1.1.2 研究对象 诊断为脓毒症休克,收缩压(SBP)<90 mmHg和(或)平均动脉压(MAP)<60 mmHg,且给予去甲肾上腺素或血管加压素治疗,年龄≥18岁的患者。
1.1.3 干预措施 研究组采用去甲肾上腺素治疗,对照组采用血管加压素治疗。
1.1.4 结局指标 (1)28 d病死发生率或与28 d最接近的病死发生率。(2)心率(HR)、平均动脉压(MAP)、心脏指数(CI)和外周血管阻力(SVRI)。(3)血乳酸(lactic acid)、氧输送(DO2)和氧耗(oxygen consumption,VO2)。(4)APACHEⅡ评分系统是由急性生理学评分(APS)、年龄评分、慢性健康状况评分3部分组成,最后得分为三者之和。理论最高分71分,分值越高病情越重。
1.2 文献检索与筛选 检索PubMed、荷兰医学文摘(Embase)、Cochrane数据库、中国生物医学文献数据库(CBM)和中国期刊网全文数据库(CNKI)等数据库。检索年限为数据库建库至2013年3月1日。应用关键词检索,英文检索词包括“vasopressor,norepinephrine,vasopressin,sepsis,septic shock,shock”;中文检索词包括“去甲肾上腺素,加压素,脓毒症,休克,感染性休克”。入选患者年龄≥18岁,文章出版语言限定为英文和中文,并追溯已获研究的参考文献,数据不全的研究与原文献作者联系。
1.3 纳入研究的方法学质量评价 由2名研究者采用盲法对文献质量进行检索和评价,如遇分歧,通过讨论解决。文献质量的评价采用文献[7]Jadad评分,1~2分为低质量研究,3~5分为高质量研究。
1.4 统计学处理 采用 Review Manager 5.0软件(RevMan,The Cochrane Collaboration,Oxford,United Kingdom)进行统计分析,采用χ2检验进行各研究间的异质性检验(以α=0.1为检验水平)。如各文献间同质(P≥0.1)则采用固定效应模型(fixed effect model)进行合并,否则采用随机效应模型(random effects model);二分类变量用相对危险率(risk ratio,RR)和95%CI表达,而连续变量用标准化均数差(standardized mean difference,SMD)及其95%CI表达,以 P <0.05为差异有统计学意义。采用漏斗图对潜在的发表偏倚进行评价。
2 结果
2.1 文献检索结果 初检出201篇文献,通过标题、摘 要等初筛,去除169篇,通过阅读全文去除27 篇,最终纳入 5 个 RCT[6,8-11],合计1 799 例患者。纳入研究的详细信息见表1。
2.2 纳入研究的基本特征和质量评价 纳入的5项研究均为关于去甲肾上腺素与血管加压素在脓毒症休克应用的随机对照研究。文献报道的时间为2006-2010年,入选患者平均年龄 54.7~65.7岁,APACHEⅡ评分为23.2~27.1分。所有患者脓毒症休克诊断标准均符合美国胸科医师协会/危重病医学会(ACCP/SCCM)的诊断标准[12]。5项随机对照研究中,4个研究通过计算机采用随机数字表的随机方法[6,8,10,11],且所有 5 项研究均报道了患者失访原因和数量。按照Jadad评分标准,2项研究为5分,1项研究为4分,2项研究为3分,平均Jadad评分为4分。
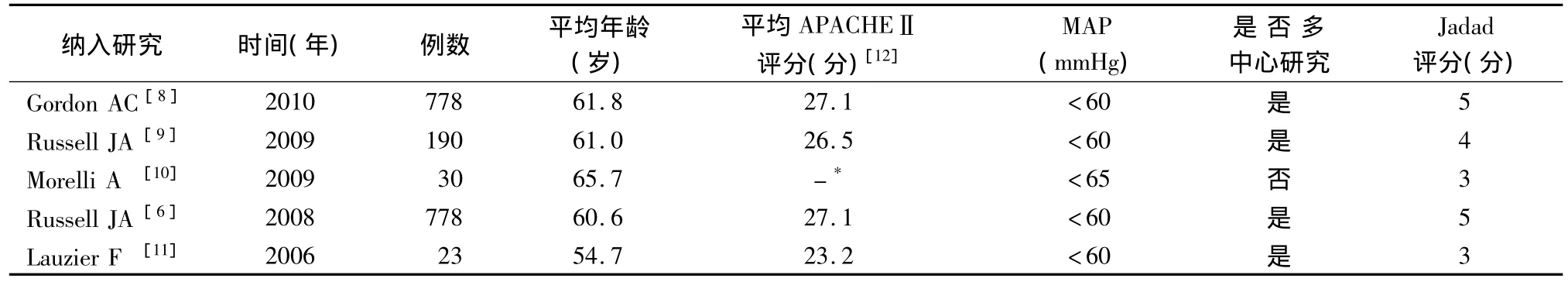
表1 去甲肾上腺素与血管加压素的RCT研究特征和质量评价[6,8-11]
2.3 Meta分析结果
2.3.1 去甲肾上腺素与血管加压素对脓毒症休克患者病死率影响 本组入选患者共1 799例,其中654例死亡,总病死发生率为36.4%;其中去甲肾上腺素组878例,329例死亡,病死发生率为37.5%;血管加压素组921例,325例死亡,病死发生率为35.3%,二者相比差异无统计学意义(RR,1.06;95%CI,0.94,1.20;P=0.36)。同时Meta结果亦显示5项研究间无异质性(P=0.28,I2=21%)。见图1。
2.3.2 去甲肾上腺素与血管加压素对脓毒症休克患者血流动力学和代谢的影响 Meta分析结果显示,与去甲肾上腺素应用于脓毒症休克患者相比,血管加压素应用时心率(SMD,0.13;95%CI=-0.41~ 0.68;P=0.63)、平均动脉压(SMD,0.11;95%CI= -0.43~ 0.66;P=0.68)、心脏指数(SMD,-0.10;95%CI= -0.64~0.44;P=0.73)和外周血管阻力(SMD,0.15;95%CI=-0.39~0.70;P=0.58)均没有明显改变。类似结果也表明,二者在氧输送(SMD,-0.06;95%CI=-0.62~0.49;P=0.82)、氧耗(SMD,0.03;95%CI= -0.52~0.59;P=0.91)与血乳酸(SMD,0.25;95%CI= -0.31~0.80;P=0.38)也无明显改变。见图2。
2.3.3 发表偏倚 倒漏斗图被用来检验发表文献的发表偏倚。结果表明,纳入的文献在图中以合并效应量RR值为中心散开分布,基本对称,呈倒置漏斗形,提示无明显发表性偏倚。见图3。
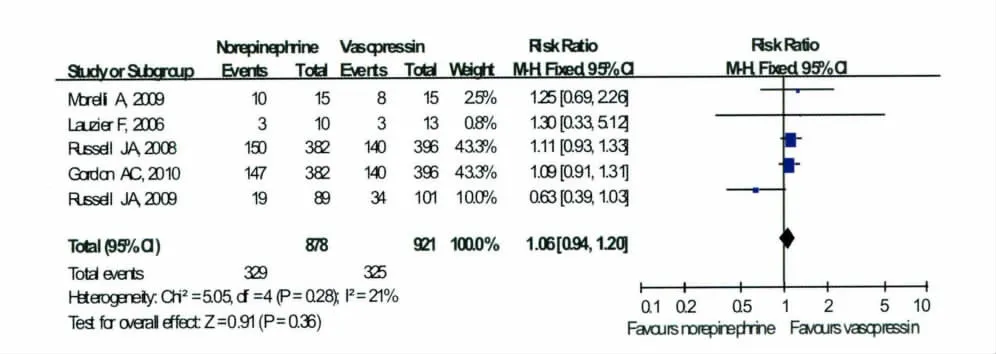
图1 去甲肾上腺素与血管加压素应用于脓毒症休克患者病死事件的Meta分析
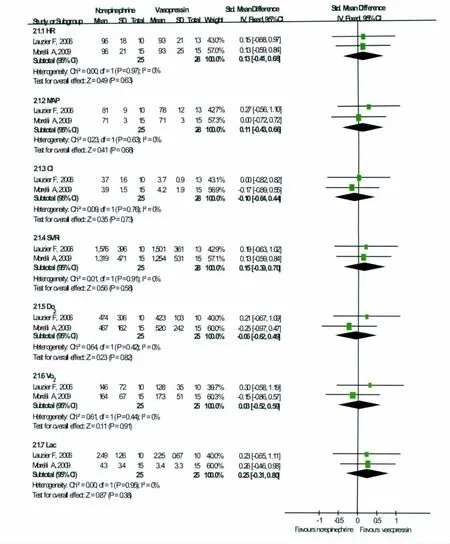
图2 去甲肾上腺素与血管加压素应用于脓毒症休克患者相关血流动力学与代谢的Meta分析
3 讨论
脓毒症休克是一种特殊类型的急性循环衰竭,其实质为血管扩张性休克,主要由于多种机制作用,如大量一氧化氮(NO)释放或大量K-ATP通道被激活等因素,血管始终处于扩张状态[13],如果单纯液体复苏不能恢复适当的血压和脏器的灌注,应尽早使用血管活性药。不同的血管活性药物由于不同的肾上腺素受体往往产生不同的生理效应[14]。尽管去甲肾上腺素被作为脓毒症休克患者治疗的一线药物,血管加压素被推荐为二线血管活性药应用[1],但本Meta研究结果表明,二者在患者的28 d病死发生率、血流动力学(HR、MAP、SVRI)等无显著区别,与 Russell等[6]的研究结果相仿。Daley等[15]通过对130例脓毒症休克患者早期应用去甲肾上腺素和血管加压素对比研究指出,二者对平均动脉压的升高也无明显影响。
对于脓毒症患者来说,迅速地增加氧的输送和改善组织细胞的氧合对于提高其生存率至关重要[16],但本文Meta分析结果表明,对脓毒症患者应用去甲肾上腺素和血管加压素时,两组患者的DO2、VO2和血乳酸没有明显区别。分析原因,考虑血乳酸水平的升高仅反映低灌注情况下无氧代谢的增加,而全身血流动力学状态并不能完全反应组织灌注情况[17];另一方面,循环中血管活性药物的浓度和其药理学作用机制复杂。有研究结果表明,重症患者血清中血管加压素与血流动力学参数无相关性[18]。
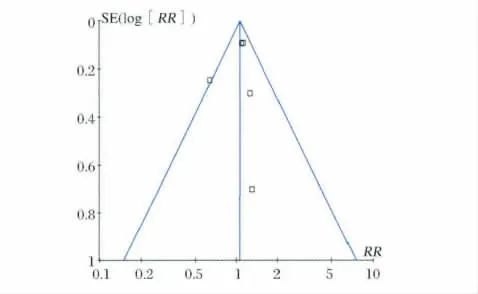
图3 纳入5项研究中患者病死发生率的漏斗图分析
综上所述,本研究结果表明,对于脓毒症休克患者来说,与去甲肾上腺素应用相比,血管加压素并没有降低患者的病死率,二者应用在血流动力学的改善,以及在DO2、VO2和血乳酸变化上无明显差别。但有文献表明,与去甲肾上腺素相比,血管加压素在脓毒症患者早期应用时可以改善患者的肾功能和降低序贯器官衰竭估计(SOFA)评分,而肾功能的早期改善是28 d 生存率的一个独立预测因素[11,19],或许二者的结合应用有助于脓毒症休克的改善。
本研究纳入的RCT平均Jadad评分4分,提示研究质量较高,但仍存在一定局限性。首先,由于本研究纳入文献限定为英文和中文,可能会有其他语种的一些RCT没有纳入,存在潜在的发表偏倚;其次,纳入的5篇文献,虽然总体上入选患者样本量较大(共计1 799例),但亚组分析样本量较小,可能对分析结果产生影响。
[1]Dellinger RP,Levy MM,Rhodes A,et al.Surviving sepsis campaign:international guidelines for management of severe sepsis and septic shock:2012[J].Crit Care Med,2013,41(2):580 -637.
[2]Leone M,Albanèse J,Delmas A,et al.Terlipressin in catecholamine-resistant septic shock patients[J].Shock,2004,22(4):314-319.
[3]韩旭东,黄晓英.血管加压素在血管舒张性休克中的应用[J].上海医药,2012,33(7):4-7.
[4]Patel BM,Chittock DR,Russell JA,et al.Beneficial effects of short-term vasopressin infusion during severe septic shock[J].Anesthesiology,2002,96(3):576-582.
[5]Gordon AC,Wang N,Walley KR,et al.The cardiopulmonary effects of vasopressin compared with norepinephrine in septic shock[J].Chest,2012,142(3):593 - 605.
[6]Russell JA,Walley KR,Singer J,et al.Vasopressin versus norepinephrine infusion in patients with septic shock[J].N Engl J Med,2008,358(9):877 -887.
[7]Jadad AR,Moore RA,Carroll D,et al.Assessing the quality of reports of randomized clinical trials:is blinding necessary?[J].Control Clin Trials,1996,17(1):1 -12.
[8]Gordon AC,Russell JA,Walley KR,et al.The effects of vasopressin on acute kidney injury in septic shock[J].Intensive Care Med,2010,36(1):83 -91.
[9]Russell JA,Walley KR,Gordon AC,et al.Interaction of vasopressin infusion,corticosteroid treatment,and mortality of septic shock[J].Crit Care Med,2009,37(3):811 -818.
[10]Morelli A,Ertmer C,Rehberg S,et al.Continuous terlipressin versus vasopressin infusion in septic shock(TERLIVAP):a randomized,controlled pilot study[J]. Crit Care,2009,13(4):R130.
[11]Lauzier F,Lévy B,Lamarre P,et al.Vasopressin or norepinephrine in early hyperdynamic septic shock:a randomized clinical trial[J].Intensive Care Med,2006,32(11):1782 -1789.
[12]Knaus WA,Draper EA,Wagner DP,et al.APACHE II:A severity of disease classification system[J].Crit Care Med,1985,13(10):818-829.
[13]Bone RC,Balk RA,Cerra FB,et al.Definitions for sepsis and organ failure and guidelines for the use of innovative therapies in sepsis.The ACCP/SCCM Consensus Conference Committee.A-merican College of Chest Physicians/Society of Critical Care Medicine[J].Chest,1992,101(6):1644 -1655.
[14]Landry DW,Oliver AJ.The pathogenesis of vasodilat ory shock[J].N Engl J Med,2001,345(8):588 -595.
[15]Hollenberg SM.Inotrope and vasopressor therapy of septic shock[J].Crit Care Clin,2009,25(4):781 -802.
[16]Daley MJ,Lat I,Mieure KD,et al.A comparison of initial monotherapy with norepinephrine versus vasopressin for resuscitation in septic shock[J].Ann Pharmacother,2013,47(3):301 -310.
[17]Rivers E,Nguyen B,Havstad S,et al.Early goal- directed therapy in the treatment of severe sepsis and septic shock[J].N Engl J Med,2001,345(19):1368-1377.
[18]冯仕彦,肖旭.去甲肾上腺素和多巴胺治疗感染性休克的疗效比较[J].现代医药卫生,2005,21(7):766-767.
[19]Jochberger S,Mayr VD,Luckner G,et al.Serum vasopressin concentrations in critically ill patients[J].Crit Care Med,2006,34(2):293-299.
[20]Levy MM,Macias WL,Vincent JL,et al.Early changes in organ function predict eventual survival in severe sepsis[J].Crit Care Med,2005,33(10):2194 -2201.
