节律基因Bmal1对胃癌细胞BGC-823增殖及凋亡的影响
2013-06-15熊枝繁陈景三
魏 柏,熊枝繁,陈景三
(华中科技大学同济医学院附属梨园医院,武汉430077)
生物节律的产生依赖于Bmal1、Clock等节律基因的调节[1,2],Bmal1 作为生物钟体系的核心基因,其突变后可引起生物节律体系的紊乱,甚至导致肿瘤的发生[3]。目前已经证实,胃肠道上皮细胞有节律基因的表达,但尚不明确Bmal1在胃癌中的作用。2012年1~7月,本研究利用RNA干扰技术靶向沉默Bmal1的表达,并观察其对胃癌细胞BGC-823增殖及凋亡的影响。现报告如下。
1 材料与方法
1.1 材料 人胃癌细胞BGC-823购自武汉大学,Dulbecco's modified Eagle medium 购自 Hyclone,胎牛血清购自杭州四季青生物工程材料有限公司,DEPC购自Sigma公司,Trizol、M-MLV逆转录酶、Tag DNA聚合酶购自Invitrogen公司,shRNA及相关引物由生工生物工程(上海)股份有限公司提供,细胞周期检测试剂盒购自南京凯基生物科技发展有限公司,流式细胞仪 FACSCalibur为 BD Biosciences,ABI7900型荧光定量 PCR仪为illumine eco,cDNA第一链合成试剂盒及SYBR Green Mix购自Fermentas,BCA蛋白浓度测定试剂盒、PMSF和RIPA裂解液购自碧云天生物技术有限公司,Bax一抗购自Epitomics,Bcl-2 一抗购自 Bioworld,Bmal1、c-Myc、CyclinD1和Wee1一抗购自Santa Curz,HRP标记二抗购自博士德生物工程有限公司,ECL底物液购自Thermo公司,X胶片购自科达公司。
1.2 方法
1.2.1 细胞培养及shRNA构建 胃癌细胞BGC-823用含10%胎牛血清DMEM培养液,在37℃、50 mL/L CO2浓度、饱和湿度下培养。shRNA目标基因为 5'-GCAGAATGTCATAGGCAAGTT-3'、5'-AACTTGCCTATGACATTCTGC-3'。细胞贴壁生长于6孔培养板上,用脂质体介导转染胃癌细胞BCG-823。实验分为转染组和对照组(空白组),G418筛选3周,挑取单克隆并扩大培养。转染率由流式细胞术检测。
1.2.2 克隆形成实验 用0.25%胰蛋白酶溶液消化并吹打成单细胞悬液,悬浮在含10%小牛血清的培养液中备用;按每皿250个细胞的密度接种于含10 mL 37℃培养液的培养皿中;37℃、5%CO2条件下,静止培养2~3周;当培养皿中出现肉眼可见的克隆时终止培养,固定染色后,流水洗去染色液,干燥后计数。
1.2.3 细胞凋亡及细胞周期检测 采用流式细胞术。收集细胞,以冷PBS冲洗2次后,取5×105/mL用500μL Bind Buffer重悬。加入5μL Annexin-VFITC及10μL PI,轻柔地摇动细胞悬液后,置于室温下避光保存15 min,上流式细胞仪检测细胞凋亡率。将转染后的细胞收集后,用70%冰乙醇固定过夜,PBS洗涤后加入PI(50μg/mL),4℃避光染色30 min后上流式细胞仪检测细胞周期。
1.2.4 Wee1、c-Myc、CyclinD1、Bcl-2、Bax 基因表达检测 采用RT-PCR法。用Trizol抽提胃癌细胞总RNA,取RNA逆转录体系中合成cDNA,以cDNA为模板加入靶基因上下游引物进行PCR扩增。同时以β-actin作为内参。各引物如下:人Bmal1(153 bp):F:5'-GTAACCTCAGCTGCCTCGTC-3',R:5'-TAGCTGTTGCCCTCTGGTCT-3';人Wee1(152 bp):F:5'-TGAAGAGGGCGATAGTCGTT-3',R:5'-TTTCATGCCATTGATCTCCA-3';人c-Myc(207 bp):F:5'-GTCAAGAGGCGAACACACAA-3',R:5'-TTTCCGCAACAAGTCCTCTT-3';人CyclinD1(204 bp):F:5'-AACTACCTGGACCGCTTCCT-3',R:5'-CCACTTGAGCTTGTTCACCA-3';人Bcl-2(176 bp):F:5'-GGAGGATTGTGGCCTTCTTT-3',R:5'-GCCGTACAGTTCCACAAAGG-3';人Bax(188 bp):F:5'-TCTGACGGCAACTTCAACTG-3',R:5'-TTGAGGAGTCTCACCCAACC-3';人 βactin(241 bp):F:5'-CACGATGGAGGGGCCGGACTCATC-3',R:5'-TAAAGACCTCTATGCCAACACAGT-3'。
1.2.5 Wee1、c-Myc、CyclinD1、Bcl-2、Bax 蛋白表达检测 采用Western blot法。细胞低温充分匀浆后,加入蛋白裂解液及PMSF,冰上放置40 min,4℃12 000 r/min离心40 min,取上清。以BSA为标准,用Bradford法对上清进行蛋白定量。取20μg蛋白样品,10%SDS-PAGE电泳,转移至硝酸纤维素薄膜,放入封闭液中37℃封闭1 h,一抗4℃过夜。同时取另一张不含抗体TBS-T液孵育作为阴性对照。反复洗膜后将膜与碱性磷酸酶AP标记的二抗抗体孵育,室温轻摇1 h,洗膜后用Western blot印迹观察,用图像分析测定各带吸光度值作定量分析。
1.2.6 统计学方法 采用SPSS11.0统计软件,计量资料以¯x±s表示,比较采用t检验;计数资料比较采用χ2检验。P≤0.05为差异有统计学意义。
2 结果
2.1 载体构建与细胞转染 重组pGCsilencerTMBmal1(+)载体经测序鉴定,与目的序列完全符合,提示载体构建成功。见图 1A。通过 Lipofectamine2000转染 pGCsilencerTM-Bmal1(+)至BGC-823细胞,通过流式细胞术测定转染率为93.57%,且可见节律基因Bmal1稳定抑制。见图1B、1C。
2.2 Bmal1沉默对细胞生长的影响 两组均观察250个细胞,空白组平均克隆数为52.70个,克隆形成率为21.08%;转染组平均克隆数为46.70个,克隆形成率为18.68%。两组克隆形成率比较 P>0.05。
2.3 节律基因Bmal1对细胞凋亡及相关基因Bax、Bcl-2和c-Myc的影响 如图2所示,转染组早期及晚期凋亡率分别为7.92%和5.56%,空白组分别为7.26%和5.25%;转染组总凋亡率为13.57%,显著高于空白组(12.51%,P<0.05)。图3可见,转染组节律基因Bmal1的沉默导致Bcl-2、Bax mRNA表达下调(2-△△t=0.120 3,P <0.01;2-△△t=0.925 2,P>0.05),c-Myc mRNA 表达上调(2-△△t=1.102 2,P<0.05)。抗凋亡基因Bcl-2和Bcl-2/Bax比值均有显著下调(P<0.05)。蛋白水平结果与mRNA类似。如图4所示。
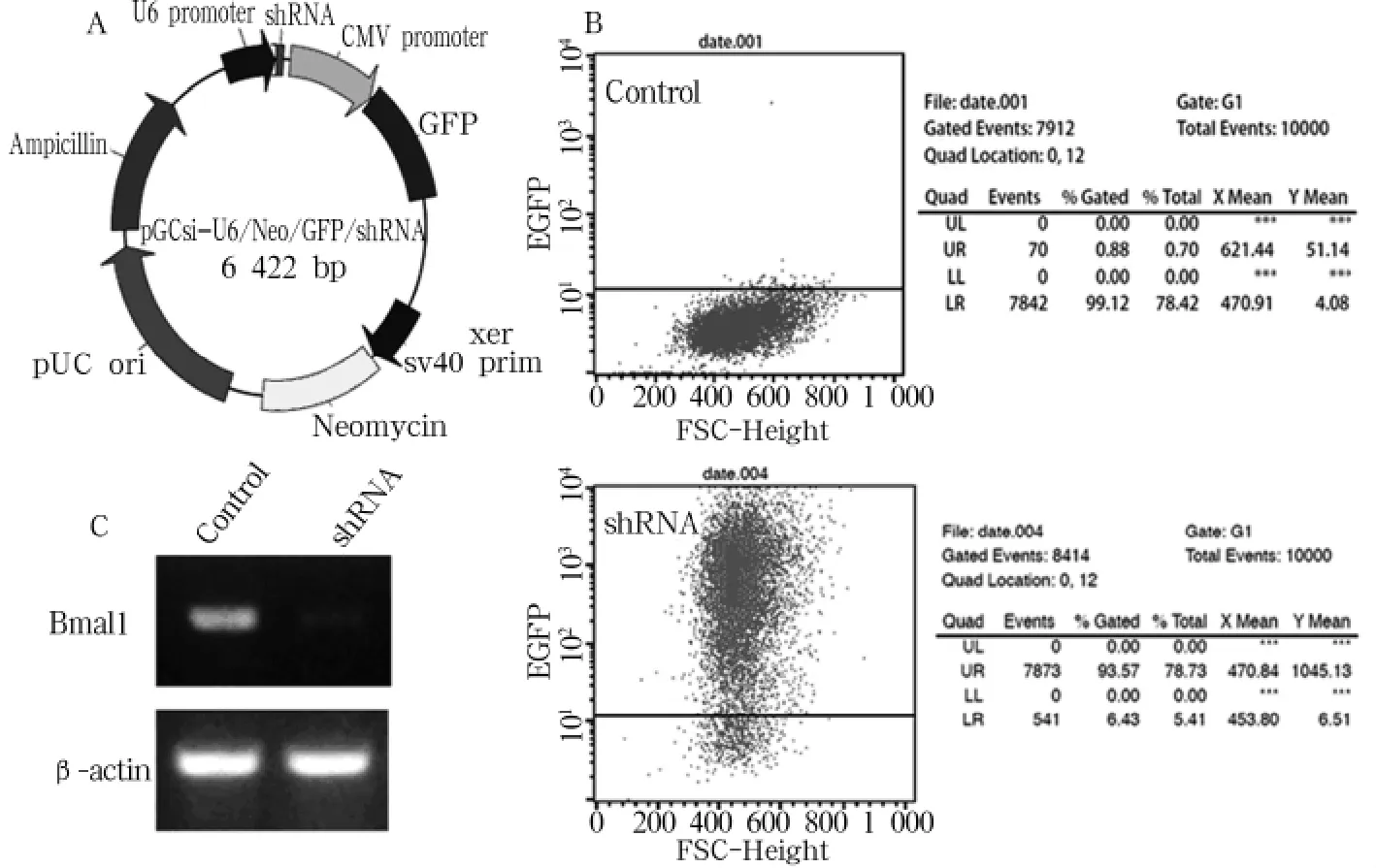
图1 shRNA稳定沉默Bmal1在胃癌细胞BGC-823中的表达

图2 流式细胞术检测细胞凋亡率
2.4 节律基因 Bmal1对细胞周期及相关基因CyclinD1、Wee1和 c-Myc的影响 与空白组(17.0%、56.0%、26.61%)比较,转染组节律基因Bmal1沉默可导致G2期延长(31.8%)、G1期缩短(41.58%)(P 均 <0.01),S 期无显著变化(P >0.05)。转染组节律基因Bmal1的沉默导致c-Myc的 mRNA 水平的增加(2-△△t=1.102 2,P <0.05),而CyclinD1及Wee1的增高未见统计学意义(2-△△t=2.169 0,P >0.05;2-△△t=1.112 0,P >0.05)。见图3。蛋白水平结果与mRNA类似。如图4所示。
3 讨论

图3 各组中相关基因mRNA的表达
Bron等[4]研究发现,节律基因对胃肠道动力、代谢、消化及黏膜增生等的调节具有重要作用。Konturek等[5]研究证实,肠道Paneth细胞和肠道神经系统有自身节律基因表达。我们既往的研究也提示,胃癌细胞BGC-823和MKN28中有Bmal1、Clock和Per1的表达,可见节律基因Bmal1表达差异可能给胃癌的发生、发展及治疗提供了一个新的切入点。为此,本研究探讨了Bmal1对胃癌细胞生长的影响及机制。
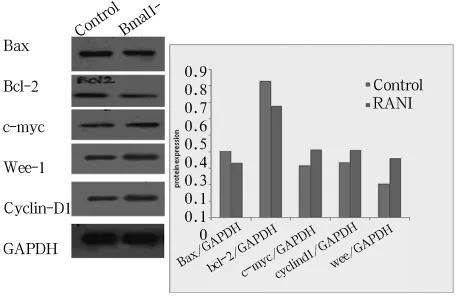
图4 各组中相关因子蛋白水平的表达
为了特异性研究节律基因Bmal1对细胞生长的影响,本研究采用了pGCsilencerTM-Bmal1(+)质粒稳定沉默Bmal1的表达。细胞克隆形成实验结果显示,节律基因Bmal1能抑制细胞克隆形成,尽管两组没有显著差异,但流式细胞术检测到节律基因Bmal1沉默导致更高的细胞凋亡;可见降低节律基因Bmal1表达可阻止细胞增殖并诱导细胞凋亡,其途径可能是多方面的。本研究既从细胞增殖、凋亡角度揭示了节律基因Bmal1参与胃癌的生长调控。
既往研究表明,肿瘤的生长和细胞过度增生及凋亡减少相关,为进一步了解释Bmal1介导的调节胃癌增殖/凋亡机制,本实验选用 Bcl-2、Bax和 c-Myc作为内源性细胞凋亡相关因子进行研究。既往实验表明,Bax是促凋亡因子、Bcl-2抗凋亡,同时c-Myc在凋亡中的调控作用在肿瘤发展中也具有显著作用,可导致细胞DNA损伤,最终引起组织增生和肿瘤的产生。本研究结果显示,转染组Bcl-2、Bax表达降低,c-Myc表达增高,和此前Bmal1介导的细胞生长受到抑制,促进了细胞凋亡的结果一致,可见Bmal1可能通过抑制Bcl-2、c-Myc脱抑制来抑制胃癌细胞生长。这与Cao等[6~8]研究结果并不完全一致,可能与节律基因不同和研究细胞不同有关。
生物节律和细胞周期是一个以互锁的以自动调控环为基础的体系[9]。节律基因控制许多细胞周期相关的基因表达,生物节律的震荡并不依赖于细胞周期。本实验检测到Bmal1沉默导致了细胞周期的显著变化,即G2期的增长及G1期缩短,S期未见显著变化。由于细胞周期主要由G1期决定,Bmal1下调加速G1期向S期转变,即细胞周期可由Bmal1控制;G2期延长说明细胞损伤严重,即Bmal1通过细胞周期影响细胞生长[10]。同时已证实,Wee1、c-Myc及 CyclinD1是 G2/M、G0/G1、G1/S转换的细胞周期关键因子[11~13],Bmal1 轻度增加 Wee1 和CyclinD1表达的同时显著增加了c-Myc的表达。因此认为,Bmal1在不同层次控制细胞增殖,包括细胞周期的调节。然而,转染组Bmal1沉默细胞后,S期无显著变化,提示可能有其他细胞周期调节因子参与细胞周期的调控。
总之,Bmal1可以抑制胃癌细胞增殖,促进细胞凋亡,有可能成为诱导胃癌细胞凋亡的新靶点。但其功能及调节机制还有待进一步研究。
[1]Pegoraro M,Tauber E.Animal clocks:a multitude of molecular mechanisms for circadian timekeeping[J].Wiley Interdiscip Rev RNA,2011,2(2):312-320.
[2]Hardin PE.Molecular genetic analysis of circadian timekeeping in Drosophila[J].Adv Genet,2011,74:141-173.
[3]Huang XL,Fu CJ,Bu RF.Role of circadian clocks in the development and therapeutics of cancer[J].J Int Med Res,2011,39(6):2061-2066.
[4]Bron R,Furness JB.Rhythm of digestion:keeping time in the gastrointestinal tract[J].Clin Exp Pharmacol Physiol,2009,36(10):1041-1048.
[5]Konturek PC,Brzozowski T,Konturek SJ.Gut clock:implication of circadian rhythms in the gastrointestinal tract[J].J Physiol Pharmacol,2011,62(2):139-150.
[6]Cao Q,Gery S,Dashiti A,et al.A role for the clock gene Per1 in prostate cancer[J].Cancer Res,2009,69(19):7619-7625.
[7]Sato F,Nagata C,Liu Y,et al.PERIOD1 isan anti-apoptotic factor in human pancreatic and hepatic cancer cells[J].J Biochem,2009,146(6):833-838.
[8]Hua H,Wang Y,Wan C,et al.Circadian gene mPer2 overexpression induces cancer cell apoptosis[J].Cancer Sci,2006,97(7):589-596.
[9]Khapre RV,Samsa WE,Kondratov RV.Circadian regulation of cell cycle:Molecular connections between aging and the circadian clock[J].Ann Med,2010,42(6):404-415.
[10]Granda TG,Liu XH,Smaaland R,et al.Circadian regulation of cell cycle and apoptosis proteins in mouse bone and tumor[J].FASEB J,2005,19(2):304-306.
[11]Ruggero D.The role of Myc-induced protein synthesis in cancer[J].Cancer Res,2009,69(23):8839-8843.
[12]Tashiro E,Tsuchiya A,Imoto M.Functions of cyclinD1 as an oncogene and regulation of cyclin D1 expression[J].Cancer Sci,2007,98(5):629-635.
[13]Leijen S,Beijnen JH,Schellens JH.Abrogation of the G2 checkpoint by inhibition of WEE1 kinase results in sensitization of p53-deficient tumor cells to DNA-damaging agents[J].Curr Clin Pharmacol,2010,5(3):186-191.
