三水白虎汤对类风湿关节炎滑膜成纤维细胞增殖的蛋白质组学影响
2013-06-15肖长虹左芳芳李凯琴
高 燕,肖长虹,潘 超,左芳芳,李凯琴
(南方医科大学中西医结合医院,广州510315)
类风湿关节炎(RA)是临床常见的一种以持续 性滑膜炎和多关节进行性软骨、骨破坏为特点的自身免疫性疾病。三水白虎汤(SSBH)是我院治疗活动期RA的经验方,前期研究结果显示,SSBH含药血清对滑膜成纤维细胞(FLS)增殖具有显著抑制作用,72 h达到高峰[1]。2012年 9~12月,我们利用双向凝胶电泳(2-DE)和质谱技术分析了SSBH含药血清体外培养RA患者的关节FLS蛋白表达图谱,旨在寻找该方抑制FLS增殖的作用靶点,为其治疗RA提供依据。
1 材料与方法
1.1 材料 SPF级SD雄性大鼠20只,体质量(200±20)g,由南方医科大学实验动物中心提供,许可证号:SCXK(粤)2011-0015。滑膜组织来自南方医院确诊的RA患者的膝关节。SSBH由南方医科大学中西医结合医院中药房提供;DMEM高糖培养液、胎牛血清、0.25%胰蛋白酶(含 EDTA)(Hy-Clone,美国),Vimentin单克隆抗体、CD68单克隆抗体(Santa Cruz Biotechnology,inc.),SP 免疫组化试剂盒(中杉金桥生物技术有限公司),固相pH梯度干胶条(pH4-7NL,24 cm)、IPG胶条缓冲液购自美国通用公司;尿素、二硫苏糖醇(DTT)、3-[(3-胆酰胺丙基)-二乙铵]-丙磺酸(CHAPS)、十二烷基磺酸钠(SDS)、三羧基氨基甲烷、丙烯酰胺、甲叉双丙烯酰胺、甘氨酸、过硫酸铵、碘代乙酰胺、矿物油、甘油均为美国Sigma公司产品;硫脲为Fluka公司品;其余均为国产分析纯。
1.2 方法
1.2.1 SSBH含药血清制备及大鼠分组 水煎SSBH 2次,混合2次煎取液进行浓缩,终浓度为含生药2 g/mL。随机将大鼠分为空白对照组(生理盐水组)、SSBH组,每组10只。SSBH组给予2 mL SSBH灌胃,生理盐水组给予等体积的生理盐水,连续给药1周。采血前夜禁食、不禁水,次晨末次给药90 min后腹主动脉采血,3 000 r/min离心10 min,取血清。56℃恒温水浴槽水浴30 min灭活,0.22μm除菌滤膜抽滤除菌后,-20℃保存备用。
1.2.2 滑膜细胞原代培养 将滑膜组织剪成1 mm3大小,均匀排列于培养瓶的培养面,将培养瓶翻转,向瓶中加入适量20%FBS完全培养液,置37℃、5%CO2培养箱培养;孵育4 h待组织块贴附后,将培养瓶缓慢翻转平放,继续静置培养;3~4 d镜下可见组织块周围FLS涡旋状成片生长后,去除组织块后继续培养,待滑膜细胞覆盖培养瓶底面>80%时,进行消化传代。取传3~6代的FLS,通过免疫细胞化学染色、倒置相差显微镜鉴定合格后备用。
1.2.3 滑膜细胞总蛋白抽提 每1.5×106个滑膜细胞加入100μL细胞裂解液,吹打使细胞与裂解液充分接触,室温放置1 h后,4℃ 40 000 g离心,吸取上清液为细胞总蛋白质,-80℃保存备用。
1.2.4 滑膜细胞总蛋白分离及染色 取蛋白样品与上样缓冲液充分混合加入到水化盘中,用镊子去除预制IPG胶条上的保护层,将胶面朝下置于水化盘样品溶液上。1 h之后加矿物油密封,于室温条件下密封放置16 h。取出胶条吸去多余的液体,将胶条胶面向下放在聚焦槽内,加覆盖矿物油进行第一向等电聚焦电泳。聚焦完毕,取出胶条进行两步平衡15 min。将胶条转移到SDS-PAGE胶上行第二向SDS电泳,低电流(12 mA/gel/17 cm),待样品在完全走出IPG胶条,浓缩成一条线后,再加大电流(或电压)(24 mA/gel/17 cm),待溴酚蓝指示剂达到底部边缘约1 cm时即可停止电泳。电泳结束后,取出凝胶采用银染方法进行显色。
1.2.5 图像采集及图谱分析 染色后的凝胶用UMAX PowerLook 1100透射扫描仪获取图像,将扫描后的凝胶放于4℃保存待用。选取在两组图谱中蛋白质表达量相差3倍的点进行分析。
1.2.6 基质辅助激光解析电离飞行时间质谱分析选取差异表达的27个蛋白点,从胶上切下置96孔培养板,经乙腈脱水后,加入适量的胰蛋白酶,37℃酶解12 h,然后加入肽提取液,室温振荡30 min,收集提取液,干燥浓缩备用。将样品和基质充分混合后点样于上样靶,室温干燥后进行图谱采集,将蛋白点的肽质量指纹图谱、分子量和等电点数据输入计算机,使用Mascot搜索引擎进行数据库检索。
2 结果
2.1 FLS的培养鉴定 在倒置显微镜下,所培养的细胞形态符合成纤维细胞的形态特征,呈纺锤状、星形或梭形,部分可呈大多角形。细胞核边界清楚,呈卵圆形,位于细胞的中间,核仁清晰。在FLS培养至第3代时,经镜下观察,具有典型形态特征的树突状细胞,内皮细胞、脂肪细胞、血管内皮细胞基本消失,未见悬浮细胞。传代至第3代及以上时,成纤维细胞样细胞所占比例均>98%。Vimentin、CD68免疫细胞化学染色结果显示,Vimentin染色阳性,胞质内见大量棕黄色颗粒,CD68染色阴性。
2.2 两组FLS蛋白2-DE图谱及质谱鉴定 SSBH组和NS组FLS蛋白2-DE图谱均出现差异蛋白质点。在差异蛋白表达量超过3倍的蛋白质点中,选取差异表达的27个蛋白点进行PMF分析,成功鉴定出25个点,将这些点经Mascot数据库共鉴定出包括表达上升的IL-1受体拮抗蛋白等共25种蛋白质。见图1。
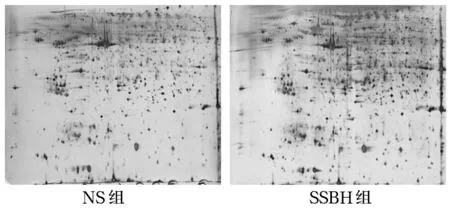
图1 两组FLS蛋白2-DE图谱
3 讨论
近年研究发现,RA滑膜组织中除了炎性介质IL-1、TNF-α、IL-6、IL-17 等外,还有抗炎型介质如IL-10、IL-1Ra、TGF-β 等,它们可下调炎症反应。因此,RA可被看作是由促炎和抗炎介质不平衡造成的一种疾病。IL-1Ra是IL-1家族中的一员,与IL-1α、IL-1β共同构成了IL-1家族,主要由激活的单核/巨噬细胞产生,包含177个氨基酸残基。IL-1Ra以4种同工蛋白的形式存在,即sIL-1Ra(可溶性IL-1Ra)和 3 种细胞内 IL-1Ra(iIL-1Ral、2、3)[2]。IL-1在RA发病过程中具有非常重要的作用,不仅参与了滑膜炎症和血管翳的形成,而且还在骨与软骨破坏、修复中起重要作用。因此,IL-1Ra通过与IL-1α、IL-1β竞争性结合靶细胞表面的Ⅰ型IL-1R,可以抑制后者的功能,同时IL-1Ra也可以阻断滑膜细胞的PGE2的合成、软骨细胞的胶原产生及软骨基质的降解等,所以IL-1Ra具有抗炎作用,也是迄今发现的惟一天然炎性细胞因子的抑制剂[3]。IL-1Ra与IL-1表达水平之间的平衡影响着RA的发生与发展状态,很可能与IL-1Ra在体液循环时弥散于组织中,影响了IL-1的比率,需要更高浓度的IL-1Ra才有可能抑制IL-1对靶细胞的的生物功能。这样,在局部组织中必须有足够的IL-1Ra才能阻止IL-1的效应。在体外,IL-IRa可封闭 IL-1的效应,降低PGE2和胶原酶的产生,改变它们对蛋白多糖和软骨合成的抑制[4]。
SSBH为临床自拟验方,以《千金药方》犀角散和《广济总录》白虎汤化裁而成,具有清热除湿、祛风通络、活血止痛的功效。本课题组前期[1]研究结果显示,在设定的10% ~50%5个浓度含药血清中,20% ~30%含药血清抑制FLS增殖效应最大。SSBH含药血清作用于FLS 48 h后即表现出对细胞增殖的显著抑制作用,72 h达到高峰。各项研究提示,SSBH可能具有抗炎镇痛、调节免疫、阻断软骨和骨质侵蚀等多种药理作用[5],其作用机制包括:抑制基质金属蛋白酶、NF-κB在关节局部的表达;抑制TNF-α的产生;抑制FLS内P38MAPK的激活[6]。
蛋白质组学技术的应用为RA的研究提供了一个新的平台。国内外学者应用2-DE和质谱技术对RA患者血浆、滑膜组织、滑膜细胞的蛋白质表达进行了研究,发现了多种在RA中特异表达的蛋白质[7~9]。因此,本实验采用20%含药血清培养72 h后达最大抑制细胞增殖效应的滑膜细胞进行细胞总蛋白的抽提,利用2-DE和质谱技术分析SSBH含药血清体外培养的RA患者FLS蛋白表达图谱,通过对生理盐水组的表达差异进行分析,寻找该方在最佳作用浓度和时间下抑制滑膜细胞增殖的作用靶点。结果显示,RA FLS中IL-1Ra蛋白的表达较正常组比较明显上升,提示SSBH可能通过上调IL-1Ra的表达,IL-1Ra竞争性抑制IL-1的效应,从而起到抑制FLS增殖的作用,这可能是SSBH治疗RA的药理机制之一,但是该蛋白的功能还需进一步进行验证,要具体阐明SSBH药理作用还有待更进一步的研究。
[1]陈德超,肖长虹,吴启富,等.四甲基偶氮唑盐法观察三水白虎汤含药血清对体外培养关节炎滑膜细胞增殖的影响[J].中国组织工程研究与临床康复,2007,11(19):3669-3672.
[2]徐晓玲,梁瑞霞,黄君健,等.细胞因子在类风湿关节炎发病机制中的作用[J].生物技术通讯,2008,19(1):111-114.
[3]Palmer G,Mezin F,Juge-Aubry CE,et al.Interferon beta stimulates interleukin 1 receptor antagonist production in human articular chondrocytes and synovial fibroblasts[J].Ann Rheum Dis,2004,63(1):43-49.
[4]Arend WP.The balance between IL-1 and IL-IRa in disease[J].Cytokine Growth Factor,2002,13:323-340.
[5]肖长虹,杨敏,吴启富,等.三水白虎汤对大鼠胶原诱导性关节炎的抑制作用[J].第四军医大学学报,2008,(24):2288-2291.
[6]Yang M,Xiao C,Wu Q,et al.Anti-inflammatory effect of Sanshuibaihu decoction may be associated with nuclear factor-kappa B and p38 MAPK alpha in collagen-induced arthritis in rat[J].JEthnopharmacol,2010,127(2):264-273.
[7]Matsuo K,Xiang Y,Nakamura H,et al.Identification of novel citrullinated autoantigens of synovium in rheumatoid arthritis using a proteomic approach[J].Arthritis Res Ther,2006,8(6):R175.
[8]柏干苹,周丽娜,贺伟峰,等.类风湿关节炎患者滑膜成纤维细胞的差异蛋白质谱分析[J].第三军医大学学报,2008,30(2):166-169.
[9]赵晓琴,李晓军,赵建宁,等.双向电泳和质谱技术在类风湿关节炎滑膜细胞差异蛋白分析中的应用及意义[J].中华检验医学杂志,2010,33(7):625-630.
