不同剂量顺铂诱导小鼠卵巢功能早衰程度的差异*
2013-06-11张小雨王钰莹范振海余丽梅
罗 娇,张小雨,王钰莹,杨 进,范振海,余丽梅
(1.遵义医学院附属医院贵州省细胞工程重点实验室,2.贵州省基础药理重点实验室,贵州遵义 563099)
卵巢早衰(premature ovarian failure,POF)是由多种病因引起的卵巢功能衰竭,在女性人群中的发病率为1%[1]。POF病人可出现明显的内分泌失调,典型变化为卵巢功能衰竭、卵巢萎缩,体内雌激素水平低下和高促性腺激素,卵巢组织退行性变化的加速,临床表现为原发性或继发性闭经、不孕、潮热多汗、阴道干涩、骨质疏松等[2],雌激素替代治疗为目前的主要治疗措施,但通常不能使POF患者得到根本改善,最终导致POF患者衰老加速。建立一种理想可靠的POF动物模型,对于POF发生、发展及其机制及其治疗研究尤显重要。本实验使用不同剂量顺铂(cisplatin or cis-diamminedichloroplatinum,CDDP)诱导小鼠化疗损伤性卵巢功能早衰[3],以期获得卵巢损伤较稳定,死亡率低、模型制备成功率高的药物损害性POF模型,为进一步探讨卵巢早衰的发生、发展以及防治等临床前研究提供合理的动物模型。
1 材料
1.1 动物 雌性ICR小鼠(6~8周)80只,体重28~30 g,购于北京华阜康生物科技股份有限公司,使用许可证编号:SCXK(京)20022 0001,21~25℃条件喂养,相对湿度50% ~70%,每日光照12 h,自由饮食饮水,适应性喂养一周后连续5 d,进行阴道涂片,将动情周期正常的小鼠纳入实验。
1.2 实验药物 CDDP,粉针剂,10 mg/支(海南齐鲁制药),采用生理盐水配制成实验浓度0.5 mg/mL分装,避光存于-20℃备用。
2 方法
2.1 分组和模型制备 ICR小鼠随机分为4组,每组20只。正常组小鼠每天腹腔注射生理盐水;模型1组:首次腹腔注射CDDP 3.0 mg/kg,接下6 d给予CDDP 2.0 mg/kg;模型2组:前3 d腹腔注射 CDDP 3.0 mg/kg,余下 4 d 给予 CDDP 2.0 mg/kg;模型3 组,连续7 d 给予 CDDP3.0 mg/kg,以上各组均从小鼠左侧腹股沟上方腹腔注射药均,并于停药24 h后每组取材10只小鼠,剩余小鼠观察其存活与动情周期恢复情况。
2.2 检测指标
2.2.1 一般状态 小鼠的饮食、活动、大小便情况,每日称量体重,并记录。
2.2.2 动情周期 每天上午8∶30行小鼠阴道脱落细胞涂片HE染色,光镜下观察小鼠动情周期变化。2.2.3 卵巢组织形态学 处死小鼠后,取留卵巢、子宫,常温下4%多聚甲醛固定过夜,送遵义医学院附属医院病理科进行常规石蜡包埋,制备4 μm切片,HE染色,光镜下观察组织形态学变化。
3 结果
3.1 CDDP对小鼠一般活动的影响 与正常组比较,模型1、2、3组小鼠在注射CDDP后,出现不同程度的精神萎靡,摄食、活动减少,皮毛竖立,光泽度下降,且大便偏稀、较少。模型组小鼠均从给药第3天开始体重逐渐下降,模型1组小鼠第5天后的体重下降差异具有显著性(P<0.05),模型2、3组则于第4天开始体重下降差异具有显著性(P<0.01),模型1、模型2、模型3组之间比较,以模型3组体重下降幅度最大(P<0.05)。正常组小鼠全部存活,模型1组小鼠停止CCDP注射第3天有1只小鼠死亡,模型2组小鼠在停药第2天死亡2只,两组死亡率分别为10%和20%;模型3组小鼠给药结束当日死亡1只,之后5日小鼠陆续出现死亡,死亡率达70%,与模型2组死亡率比较有显著性差异(P0.05,1=0.35 < 0.05);其余小鼠在注射顺铂结束14 d的观察期内均存活。
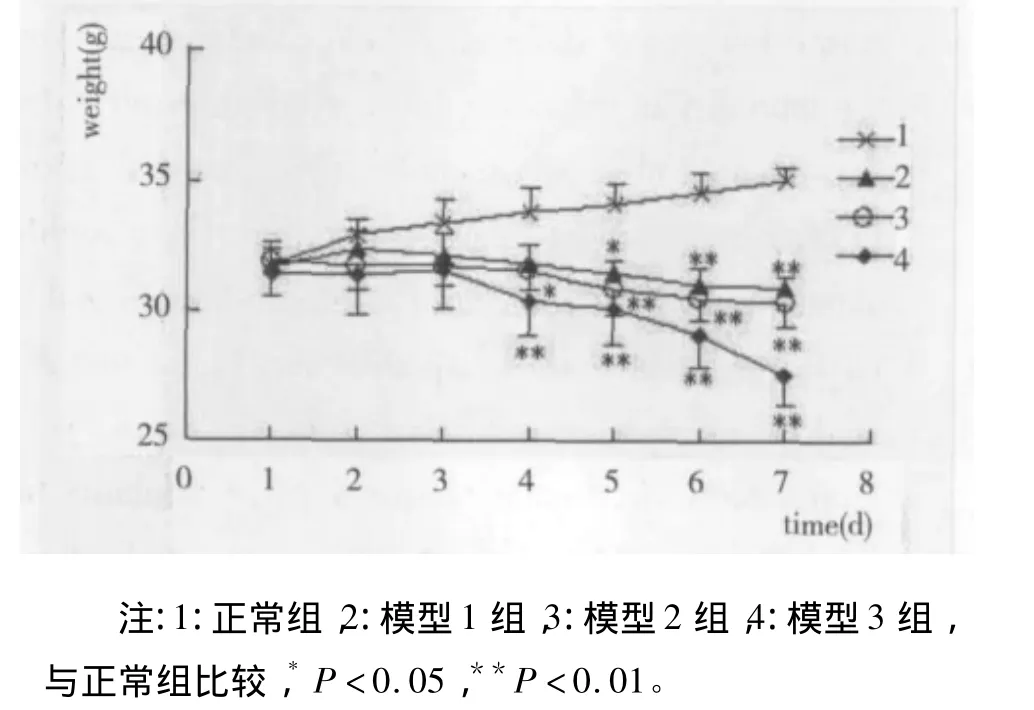
图1 不同剂量CCDP对POF小鼠体重的影响
3.2 动情周期观察 每日阴道涂片检测小鼠动情周期。正常小鼠的动情周期为4~5 d,包括动情前期、动情期、动情后期和动情间期。给CDDP期间,模型1、2、3组则出现明显周期紊乱,表现为动情后期和动情间期延长,少见动情前期和动情期。CDDP注射结束后14 d,模型1组有50%(5/10)小鼠恢复正常动情周期,模型2组仅有1只小鼠恢复正常动情周期,而模型3组动情周期持续紊乱;与正常组比较,模型1、2、3组小鼠动情周期紊乱发生率均明显升高(=16.81,P <0.01)。

图2 ICR小鼠动情周期各期HE染色涂片(×100)
3.3 CDDP改变卵巢组织形态学 如图3所示,正常小鼠卵巢外表光滑、红润,腹腔注射CDDP后,卵巢体积缩小,表面无光泽,有一定程度的皱缩,色较白。常规石蜡切片、HE染色后,光镜下观察(见图4),正常小鼠卵巢可见各级卵泡,发育较成熟卵泡位于与卵巢组织周边位置,卵母细胞形态均一,较圆,透明带清晰光滑,周边颗粒细胞排列整齐,呈放射状层叠排列。模型组卵巢组织则呈现不同程度的较多空泡样改变,卵泡闭锁和间质纤维化样改变,卵泡内淋巴细胞浸润。模型1组卵巢坏死细胞较少,可见成熟卵泡,形态结构较好,而模型2、3组卵巢组织结构紊乱,闭锁卵泡明显增加,各级典型卵泡明显减少,偶见杂乱排列的较成熟卵泡,尤其是模型3组基本见不到发育成熟的卵泡细胞,罕见个别较成熟卵泡,其细胞体积极小,有细胞核固缩现象,卵母细胞周围透明带不明显,核颗粒细胞仅见稀疏的1~2层、杂乱排列。

4 讨论
CDDP是临床用于治疗肿瘤的常用药物之一,作用似烷化剂,主要是通过干扰癌细胞的DNA复制,或与核蛋白及胞浆蛋白结合,达到肿瘤治疗效果。CDDP在抗肿瘤的同时,也对机体产生明显副作用[4]。研究报道,高浓度的CDDP即可抑制卵巢颗粒细胞生长,也可诱导其凋亡,从而明显抑制卵巢功能[5-6],使卵泡发育受阻,进而发展为排卵减少,雌激素水平低下,最终导致POF。
鉴于引起POF病因的多样性,目前在科研中,已建立的POF模型主要包括化学毒物诱导、化疗药物损伤、基因敲除、免疫性POF模型和双氧水局部损伤模型等[7-9],其中连续腹腔注射CDDP为常用的POF模型制备方法,所诱导的症状、激素水平与病理变化与临床所见的抗肿瘤化疗所致的POF极为相似[10],除表现为血清低雌激素、高促性腺激素水平外[11],卵巢组织病理学等也比较符合临床化疗后出现的 POF[12-13],且 CDDP 致 POF 模型费用低廉,成模时间短等特点,即适用于化疗所致POF的机制及防治研究,亦可用于CDDP的药理与毒理学研究。本实验中也发现,腹腔注射较高剂量CDDP后,小鼠出现精神萎靡、食欲下降、皮毛光泽度下降、动情周期紊乱,卵巢外观体积缩小,组织HE染色所观察到的卵巢组织结构紊乱,空泡样改变,发育卵泡数量的明显下降,少见成熟卵泡,卵泡内颗粒细胞层减少,闭锁卵泡增多,间质纤维化样改变,滤泡内淋巴细胞浸润,与文献报道一致[14]。但文献中所用CDDP剂量差异较大,常见剂量为1~3 mg/kg,多采用3 mg/kg连续腹腔注射5~7 d不等,但所致的卵巢损害程度与动物存活率的差异不明确,因而导致疾病改变及其治疗研究出现了一些不一致或难以阐释的现象;3 mg/kg连续腹腔注射7 d,动物死亡率高,卵巢及其他组织器官损伤严重也是一个突出问题。实验中参照艾浩等的方法[3],以2.0 ~3.0 mg/kg 3 种给药方案,不同 CDDP总给药量,分别设立3个模型组,结果显示,模型组1小鼠卵巢损伤相对较轻,卵巢组织仍可见成熟卵泡,停药后动情周期可自行恢复正常;模型组3小鼠卵巢损伤较重,动物死亡率高,卵巢组织基本见不到发育成熟的卵泡,且14 d内小鼠动情周期的紊乱难以恢复;模型组2前3 d给予CDDP 3 mg/kg,后4 d 给药 2.0 mg/kg,小鼠出现了动情周期紊乱和POF的卵巢组织相应组织病理学变化,但死亡率明显低于模型3组。由此可见,采用模型2组方案制备ICR小鼠POF,病理生理与组织病理学改变明显,组织损伤较为稳定,又不至引起过高的动物死亡,也至于导致有效治疗措施难发挥作用,更适用于探讨POF发病机制研究或治疗方案的评价。
[1]Liu T,Huang Y,Guo L,et al.CD44+/CD105+human amniotic fluid mesenchymal stem cells survive and proliferate in the ovary long-term in a mouse model of chemotherapy - induced premature ovarian failure[J].Int J Med Sci,2012,9(7):592 -602.
[2]Yu K,Ming J C,Cong J X.Secretion of estrogen from murine induced pluripotent stem cells co-cultured with ovarian granulosa cells in vitro[J].Cell Biology International Immediate Publication,2011,35(9):871 -874.
[3]艾浩,牛建昭,薛晓鸥,等.化疗损伤性卵巢功能早衰小鼠动物模型的研究[J].中国实验动物学报,2007,15(1):35-38.
[4]Xue S L,Su H F,Hu X Q,et al.Adjuvant combined systemic chemotherapy and intraperitoneal chemotherapy for locally advanced gastric cancer[J].Oncol Lett,2012,4(6):1309-1314.
[5]Ling J,Zhao K,Cui Y G,et al.Heat shock protein 10 regulated apoptosis of mouse ovarian granulosa cells[J].Gynecol Endocrinol,2011,27(1):63 -71.
[6]张春燕,何援利.顺铂对人卵巢黄素化颗粒细胞的毒性及凋亡的影响[J].中国药理学报,2008,24(6):796-799.
[7]高慧,夏天.卵巢早衰及其动物模型的研究进展[J].辽宁中医杂志,2008,35(11):1781 -1783.
[8]Ghadami M,El- Demerdash E,Zhang D,et al.Bone marrow transplantation restores follicular maturation and steroid hormones production in a mouse model for primary ovarian failure[J].PLoS One,2012,7(3):e32462.
[9]贺卫卫,谢琪璇,秦俊文,等.骨髓间充质干细胞对损伤卵巢的修复作用[J].暨南大学学报(医学版),2010,31(2):120-124.
[10]Yucebilgin M S,Terek MC,Ozsaran A,et al.Effect of chemotherapy on primordial follicular reserve of rat:an animal model of premature ovarian failure and infertility[J].Aust N Z J Obstet Gynaecol,2004,44(1):6 -9.
[11]吴琳,孔繁斗.顺铂对去势雌性大鼠骨代谢影响的实验研究[J].中国骨质疏松杂志,2008,14(9):661 -664.
[12]Borovskaya T G,Goldberg V E,Fomina TI,et al.Morphological and functional state of rat ovaries in early and late periods after administration of platinum cytostatics[J].Bull Exp Biol Med,2004,137(4):331-335.
[13]Wang Y,Li L Z,Zhang Y L,et al.L C,a novel estrone -rhein hybrid compound,promotes proliferation and differentiation and protects against cell death in human osteoblastic MG - 63 cells[J].Mol Cell Endocrinol,2011,344(1-2):59-68.
[14]Borovskaya T G,Goldberg V E,Fomina TI,et al.Morphological and functional state of rat varies in early and late periods after administration of platinum cytostatics[J].Bul Exp Biol Med,2004,137(4):331 -335.
