人脂肪间充质干细胞体外培养鉴定与诱导分化的初步研究*
2013-12-03郭常敏王达利魏在荣
郭常敏,王达利,魏在荣,龙 艳
(遵义医学院烧伤整形外科,贵州遵义 563099)
软组织损伤、骨折、软骨缺损等是外科常见病多发病,损伤修复与重建、骨折、软骨的再生与治疗也是外科棘手问题,自体脂肪移植也是目前美容外科较好的方式之一。骨髓来源的间充质干细胞(BMSC)是较早发现并应用于临床的成体干细胞之一[1],近年来通过对不同来源成体干细胞的研究和探索,有了进一步的发展,干细胞的应用逐渐广泛[2],但仍然存在多方面的不足,如来源有限,获取困难等,不能很好的解决、应用于临床问题,而脂肪间充质干细胞来源方便,可以是肥胖病人抽脂所得,也可以是外科手术中剩余的脂肪标本,总之来源方便,获取量多,且自体移植,避免了免疫排斥反应。目前多数学者对其定向诱导分化的研究局限于前3代细胞,多次传代后是否能保持良好的生物学特性还需要进一步明确。本文通过分离培养 ADSCs,并对P9进行定向诱导分化,证明P9仍保持良好干性,在特定微环境下可以定向诱导分化。经过多次传代以后,可以提供充足的ADSCs,这就解决了干细胞来源相对不足的问题,只要少量的干细胞经过多次传代即可满足临床需求,为组织工程提供了很好的种子细胞来源。
1 材料与方法
1.1 标本来源及制备 标本来源于遵义医学院整形外科手术病人剩余的脂肪组织,女性,28岁,无全身系统疾病,经患者知情同意,留取手术中剩余脂肪组织备用。
1.2 主要的仪器和试剂 CO2培养箱(Thermo Forma,USA),流 式 细 胞 仪 (FACSCalibur,BD,USA),流式结果分析软件CellQuest(USA),超纯水制备系统(MILLI-Q Biocel,MILLIPORE,USA),倒置相差显微镜(Olympus,Japan),高速低温离心机(Centrifuge 5804R,Eppendorf,Germany),恒温水浴摇床 (SBD 50,Heto,Denmark),- 80℃ 冰 箱(JOUAN Nordic,Denmark),正压过滤器(Millipore,USA),分散酶(Gibco,USA),Ⅰ型胶原酶 (Gibco,USA),0.125%胰蛋白酶(Gibco,USA),L - DMEM培养液 (Gibco,USA),胎牛血清 (FBS,Gibco,USA),小鼠抗人角蛋白19单克隆即用型抗体(Anti- CK19 antibody,Gene Tech,中国),小鼠抗人波形蛋白单克隆即用型抗体(Anti-vimentin antibody,Gene Tech,中国),小鼠抗人单克隆荧光标记抗体CD105-PerCP Cy5.5、CD44-PE、CD90-FITC、CD73-APC、CD34+45+11b+19+DR -PE(BD,USA),二步法抗兔/鼠通用型免疫组化检测试剂盒(Gene Tech,中国),碱性成纤维细胞生长因子(bFGF,Peprotech,USA),人间充质干细胞成脂肪细胞、成骨细胞、成软骨细胞诱导培养基(Cyagen,中国)。
1.3 ADSCs分离和培养 严格无菌条件下,在超净工作台内将外科手术切除新鲜脂肪组织5 g左右,用含1%双抗(PS)的D-PBS洗涤3次,用眼科剪眼科镊仔细剥离并弃除组织中的血管及筋膜,在培养皿中将脂肪肪组织剪成糊状后移入无菌青霉素瓶,加入2倍体积的1 mg/mL的Ⅰ型胶原酶37℃条件下,消化约1 h后加入等体积完全培养基(含10%胎牛血清的L-DMEM培养液、1%L-谷氨酰胺、1%PS)终止消化。200目孔径的钢网过滤收集细胞滤液,1 500 rpm离心12 min,弃上清后用完全培养液重悬细胞,接种于25 cm2细胞培养瓶,置于37℃,5%CO2饱和湿度条件下的孵箱内培养,24 h后观察更换含5 ng/mL bFGF的培养基。待原代细胞融合度达90%左右时,用含1%PS的D-PBS洗涤 2次,加入 0.125%胰蛋白酶 -0.02%EDTA 37℃消化30~60 s,倒置相差显微镜下观察待胞质回缩后用完全培养基终止消化,收集细胞,1 200 rpm离心5 min,弃上清,用含bFGF的培养基重悬细胞,以1∶2的比例传代,置于37℃,5%CO2,饱和湿度条件下孵箱内培养,每2~3 d换液一次,细胞融合80% ~90%传代。
1.4 观察细胞形态,检测增殖活力,计算倍增时间和扩增倍数 原代细胞培养24h后观察其贴壁情况。取第3代生长状态良好的贴壁细胞胰蛋白酶消化收集细胞,1 200 rpm离心6 min,完全培养基重悬细胞,调整密度为2×104/mL接种于24孔板中,次日每天消化3孔,细胞计数,倒置相差显微镜下计数3次,取平均值,以后每天消化3孔计数,8 d后根据细胞增殖情况绘制细胞曲线。期间每2~3 d换液一次。根据Td=T×[lg2/lg(Nt/N0)计算细胞倍增时间,T代表生长曲线中的指数增殖时间段,N0是接种时的细胞数,Nt是指数增殖末期的细胞数。根据Nt/N0计算细胞扩增倍数。
1.5 免疫细胞化学检测CK19、波形蛋白的表达取第3代贴壁细胞胰酶消化后,1 200 rpm离心6 min,完全培养基重悬细胞,调整细胞密度为2×104/mL接种于小培养皿中,待细胞生长到75%左右PBS冲洗,4%多聚甲醛固定30 min,PBS冲洗3次×3 min;滴加0.3%Triton-X100湿盒内室温孵育20 min,PBS冲洗3次×3 min;室温下封闭液封闭30 min;滴加一抗(小鼠抗人的单克隆抗体CK19、波形蛋白,空白对照组用PBS替代,4℃过夜。次日(16~17 h后)复温,PBS冲洗3次 ×3 min;滴加生物素标记的二抗(兔抗鼠IgG),37℃孵育30 min,PBS洗3次;3-二氨基联苯胺(DAB)显色10 s,自来水冲洗终止反应,苏木素复染1 min,梯度酒精脱水,二甲苯透明,中性树脂胶封片,观察结果并拍照。
1.6 流式细胞仪检测细胞表面标志 取第9代贴壁细胞,消化,离心,D-PBS重悬并调整细胞密度约为2.4×106/mL;取细胞悬液100μL加入3μL/8μL不同的荧光标记单克隆抗(CD105-PerCP Cy5.5、CD44 - PE、CD90 - FITC、CD73 - APC、CD34+45+11b+19+DR-PE)和同型阴性对照小鼠单克隆抗体振荡混匀,室温避光孵育20 min。每管加入2 mL含1%NaN3的PBS,混匀,1 000 rpm离心5 min,弃上清,振荡重悬细胞。每管加入200 μL含0.1%多聚甲醛的PBS溶液,混匀固定,4℃冰箱放置,待上流式细胞仪检测。
1.7 体外定向诱导分化能力检测 收集第8代细胞,参照诱导培养基说明书,制备诱导培养基和细胞悬液,按说明书参照浓度接种于6孔培养板中,进行如下分化诱导鉴定。
1.7.1 向成脂肪细胞诱导分化 细胞接种后每3 d换液一次,待细胞生长融合至80% ~90%,吸取完全培养基,每孔加入2 mL成脂分化诱导培养基A(成脂分化诱导基础培养基A 175 mL+FBS 20 mL+青链霉素(penicillin-streptomyc)2 mL+谷氨酰胺(Glutamine)2 mL+胰岛素(Insulin)200(L+IBMX200(L+吲哚美辛(Rosiglitazone)200(L+地塞米松(Dexamethasone)200(L)诱导培养3 d后,吸出培养基A,加入2 mL成脂诱导分化培养基B(成脂分化诱导基础培养基 B 175 mL+FBS 20 mL,penicillin-streptomyc 2 mL+Glutamine 2 mL+Insulin 200(L),24 h后再换回成脂诱导分化培养基A液,如此循环5次即诱导完成,吸出诱导培养基,PBS清洗2次,4%多聚甲醛固定30min,油红O染色30 min,镜检、拍照。
1.7.2 向成骨细胞诱导分化 细胞接种后每3 d换液一次,待细胞生长融合至80% ~90%,吸掉培养基,每孔加入2 mL成骨诱导培养基(成骨分化诱导基础培养基175 mL+FBS 20 mL+penicillinstreptomyc 2 mL+Glutamine 2 mL+抗坏血酸(A-scorbate)400(L+(-甘油磷酸钠(Glycerophosphate)2 mL+Dexamethasone 20(L),每3 d换一次液。常规诱导21 d后弃培养基,PBS清洗2次,加入2 mL 4%中性甲醛固定30 min,茜素红染色5 min,镜检、拍照。
1.7.3 向成软骨细胞诱导分化 细胞接种后离心1 000 rpm×6 min,离心后注意保持细胞团不被打散,置于37℃、5%CO2饱和湿度孵箱中,3 d换一次成软骨诱导培养液(基础培养基194 mL+A-scorbate 600(L+Dexamethasone 20(L+Sodium Pyruvate 200(L+Proline200(L+TGF-(32 mL+ITS supplement 2 mL+1%TGF-(3),换液时轻弹离心管壁使细胞团块脱壁悬浮,每次换液加诱导培养基1mL。常规诱导3 wk后弃培养基,PBS清洗2次,4%多聚甲醛固定30 min,石蜡包埋切片,脱蜡蒸馏水冲洗。阿利辛蓝染色液浸染30 min,终止染色、镜检、拍照。
2 结果
2.1 ADSCs形态及生长特点及增殖活力、倍增时间和扩增倍数 原代细胞培养24 h后首次观察,细胞形态不规则,呈梭型或多角形、排列紊乱,集落样生长。原代细胞生长较慢,7~8 d首次传代,传代后细胞增殖速度明显增加,3~4 d即生长融合至85% ~90%,连续多次传代后,细胞形态较为均一,多以梭形为主,呈放射状、漩涡状排列生长。传至8代细胞仍呈梭形,立体感好。细胞计数显示第1~2天生长缓慢,第3~5天进入对数期,第7~8天生长缓慢,进入平台期(见图1)。第3代细胞倍增时间约为51.6 h,扩增倍数为2.62倍。
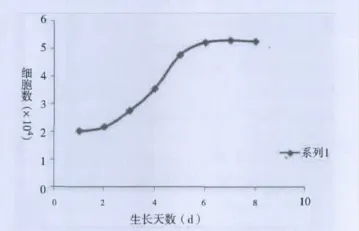
图1 ADSCsP3生长曲线(细胞数×104)
2.2 CK19、波形蛋白(vimentin)的表达 免疫细胞化学结果显示:该细胞不表达上皮细胞标志物CK19,间充质细胞标志物vimentin阳性表达,对照组结果呈阴性(见图2)。
2.3 流式细胞学检测ADSC细胞表面标志表达流式细胞学检测结果显示,第9代ADSC细胞CD105、CD90、CD44、CD73 分 别 为 91.25%,96.43%,99.69%,99.86%,CD45+34+11b+19+DR为0.43%(见图3)。

图2 ADSCs CK19及vimentin的表达(×100倍)
2.4 体外向成脂、成骨、成软骨细胞诱导分化 脂肪细胞诱导液加入9d后,细胞体积增大,胞质中有小的圆形、透亮的脂滴出现,随着诱导时间的延长,脂滴逐渐增多,体积增大,由原来的梭形变为圆形,互相融合,折光性增强。第17天见较多脂滴且环状排列,停止诱导,油红O染色见阳性(见图4 A)。成骨诱导10 d左右细胞外基质见有少量黑色组织沉积,似钙盐沉积,14 d左右见有圆形较明显钙结节形成,随着诱导时间的延长,黑色钙盐沉积增加,待诱导分化21 d后进行茜素红S染色,可见细胞外基质的钙盐被染成红色(见图4 B)。软骨诱导剂诱导培养后,见细胞团块逐渐增大,待诱导21 d后阿利辛蓝染色呈阳性(见图4 C)。

图3 ADSCs流式细胞检测

图4 ADSCs体外诱导分化结果
3 讨论
随着干细胞的广泛应用,继胚胎干细胞之后,骨髓间充质干细胞、脐带血来源的间充质干细胞等成体干细胞已成为组织工程学、创伤医学、再生医学、遗传医学等多种学科的研究热点。自 Zuk等[3]2001年提出ADSC的的概念以来,脂肪间充质干细胞因其比 BMSC产量更多、分离更方便、来源更广泛[4]的优点而成为研究热点之一。ADSCs体外定向诱导可以向脂肪细胞、软骨细胞、心肌细胞、骨细胞、神经元细胞等方向分化[5],因此在再生医学及组织工程学领域中有着重要的应用价值。目前ADSCs的培养多数局限于前3代,本实验对第9代ADSCs的生物学特性进行了初步研究,初步表明本分离、培养方法可能有望弥补ADSCs产量不足的问题,即可能只要5g左右脂肪,ADSCs即可以获得大量增殖。原代细胞贴壁融合90%,可获得0.8×106~1×106个细胞,经传至第9代,可获得约2×108个细胞,足够作为一名患者移植治疗的细胞数量。
本实验通过机械分离联合酶消化法分离、提取ADSCs。经过体外培养、传代纯化,取第3代贴壁细胞检测表皮细胞特异性标志CK19和间充质细胞特异性蛋白波形蛋白。波形蛋白是一种间充质来源的所有细胞骨架成份和特异性标志。本实验分离的细胞阳性表达波形蛋白,阴性表达CK19,可以证明实验所用细胞确实来源于间质。
间充质干细胞(MSC)因特异性阳性表达而不表达或低表达造血干细胞表面标志物CD45、CD34、CD14 或 CD11b、CD79a、CD19 或 HLA - DR[6],本实验依据该标准对第9代ADSC进行了检测,结果高表达 CD105、CD73、CD90,不表达(或低表达)CD34、CD45、11b、CD19、HLA - DR,符合 2006 年国际细胞治疗协会(ISCT)MSC检测指标CD45的表达率<2%[7]相吻合,即满足间质干细胞特异性表面分子的要求,排除了造血干细胞来源的可能。
本实验对P9 ADSCs进行定向分化诱导,向成脂方向诱导21 d后油红O染色阳性;向成骨方向诱导21 d后茜素红S染色,可见细胞外基质的钙盐被染成红色;向成软骨方向诱导21 d后进行固定、包埋、切片、脱蜡,阿利新兰特异性染成蓝色,说明ADSCs经诱导分化为成脂、成骨和成软骨细胞。可见P9 ADSCs仍然具有多向分化的能力,保持良好的干细胞多向分化潜能。且纯度高,性质稳定,则可由少量细胞经传代扩增,获取足够数量的种子细胞,解决了干细胞来源相对不足的问题,为组织工程、修复重建科学及其他医学学科提供了良好的种子细胞。
[1]毕薇薇,李超,宋广赜.人脂肪间充质干细胞的分离培养与生物学特性[J].中国组织工程研究与临床康复,2011,15(40):7493 -7496.
[2]Phinney D G,Prockop D J.Concise review:mesenchymal stem/multipotent stromal cells:the state of transdifferentiation and modes of tissue repair- - current views[J].Stem Cells,2007,25(11):2896 -2902.
[3]Zuk P A,Zhu M,M izunoH,et al,Multilineage cells from hum an adipose tissue:implication for cell-based therap ies[J].T issue Eng,2001,7(2):211 -228.
[4]JurgensW J,Oedayrajsingh - Varm aM J,H elderMN,et al.Effect of tissue - harvesting site on yield of stem cells derived from adipose tissue:implications for cell-based therapies[J].Cell Tissue Res,2008,332(3):415 -426.
[5]高华,王玉玲,姚亚妮,等,脂肪来源干细胞体外成骨和成脂及成神经的诱导分化研究[J].中国全科学,2011,14(5B):1568-1570.
[6]Gimble J M,Guilak F.Adipose- derived adult stem cells:isolation,characterization,and differentiation potential[J].Cytotherapy,2003,5:362 -369.
[7]Dominici M,Le Blanc K,Mueller I,et al.Minimal criteria for defining multipotent mesenchymal stromal cells.The International Society for Cellular Therapy position statement[J].Cytotherapy,2006,8(4):315 -317.
