鼻咽癌患者血清MIP-3α与cystatin A表达及其临床意义
2013-06-09李军汤敏中陆爱英钟伟铭高健全郑裕明曾洪陈万生梁伟蔡永林
李军汤敏中陆爱英钟伟铭高健全郑裕明曾洪陈万生梁伟蔡永林
1.梧州市卫生系统鼻咽癌病因学及分子机理重点实验室,广西 梧州 543002;
2.梧州市红十字会医院医学检验科,广西 梧州 543002;
3.北京工业大学生命科学与生物工程学院,北京 100022;
4.梧州市红十字会医院肿瘤科,广西 梧州 543002
鼻咽癌患者血清MIP-3α与cystatin A表达及其临床意义
李军1,2汤敏中1,3陆爱英1,2钟伟铭4高健全4郑裕明1曾洪1陈万生4梁伟4蔡永林1,2
1.梧州市卫生系统鼻咽癌病因学及分子机理重点实验室,广西 梧州 543002;
2.梧州市红十字会医院医学检验科,广西 梧州 543002;
3.北京工业大学生命科学与生物工程学院,北京 100022;
4.梧州市红十字会医院肿瘤科,广西 梧州 543002
背景与目的:目前,检测鼻咽癌的病灶残留、复发、远处转移,评价放化疗敏感性及判断预后主要依赖影像学的检查。寻找鼻咽癌早期诊断及预后相关的特异性分子标志物对鼻咽癌的早期诊断及个体化治疗具有重要意义。本研究通过检测血清巨噬细胞炎性蛋白-3α(macrophage inflammatory protein-3α,MIP-3α)和cystatin A蛋白在鼻咽癌患者治疗前、后及健康人中的表达情况,探讨其在鼻咽癌诊断、与临床病理特征关系以及疗效评价中的作用。方法:应用定量酶联免疫吸附法检测140例初治无远处转移的鼻咽癌患者治疗前、治疗结束后血清中MIP-3α和cystatin A的表达情况,并以100名健康体检者为对照。结果:以血清MIP-3α水平为31 pg/mL及cystatin A水平为16 ng/mL诊断鼻咽癌的敏感度分别为92.1%及42.1%,特异度分别为86.0%及85.0%。140例鼻咽癌患者经过治疗后均达到完全缓解或者部分缓解。鼻咽癌患者治疗前血清MIP-3α和cystatin A水平显著高于治疗后和健康对照者。MIP-3α和cystatin A均与鼻咽癌临床分期相关,MIP-3α还与T分期有关。治疗后完全缓解患者的血清MIP-3α降至健康对照者水平。部分缓解患者仍高于健康对照者水平,而完全缓解与部分缓解患者的血清cystatin A均降至健康对照者水平。在1年内发生远处转移的患者治疗后血清MIP-3α和cystatin A水平均明显高于未发生远处转移患者和健康对照者。MIP-3α和cystatin A表达之间存在相关性。结论:血清MIP-3α水平作为辅助诊断鼻咽癌的指标有一定的临床意义。血清MIP-3α与cystatin A检测有助于判断鼻咽癌分期和治疗后的近期疗效。
鼻咽癌;巨噬细胞炎性蛋白-3α;Cystatin A;临床疗效
鼻咽癌(nasopharyngeal carcinoma)是中国及东南亚常见的头颈部恶性肿瘤,对放射治疗较为敏感。目前局部晚期鼻咽癌患者经过同期放化疗治疗后,其5年总生存率及无病生存率可达到70%[1-2]。当前,鼻咽癌预后评估主要基于临床TNM分期,但即使临床分期相同的患者,其治疗效果也有很大差异,提示TNM分期仍不足以精确预测该疾病的预后。目前,检测鼻咽癌的病灶残留、复发、远处转移、评价放化疗敏感性及判断预后主要依赖影像学的检查。寻找鼻咽癌早期诊断及预后相关的特异性分子标志物对鼻咽癌的早期诊断及个体化治疗具有重要意义。
鼻咽癌重要的病理特征是具有广泛的良性淋巴细胞浸润。虽然这些肿瘤浸润的淋巴细胞特征尚未被阐明,但在鼻咽癌微环境中肿瘤细胞和肿瘤浸润淋巴细胞的交互作用可能在肿瘤形成中起重要作用;而细胞因子在此交互作用中可能起着关键的介导作用。最近的研究显示,趋化性细胞因子在肿瘤增殖和转移中起重要作用。人的趋化性细胞因子根据半胱氨酸的位置、排列方式和数量可分为4类:CC亚族、CXC亚族、C亚族和CX3C亚族[3]。这些趋化性细胞因子通过不同的跨膜信号转导通路,激活与细胞运动、侵袭、转移有关的基因。巨噬细胞炎性蛋白-3α(macrophage inflammatory protein-3α,MIP-3α)由CCL20基因编码,属于CC亚族的趋化性细胞因子,可诱导白细胞移动到炎性反应部位,通过淋巴组织调节白细胞通量,其表达水平与许多恶性肿瘤进展、血管生成、局部炎性细胞浸润、转移或侵袭能力及预后密切相关[4]。溶酶体半胱氨酸蛋白酶对细胞外基质成分的降解是肿瘤细胞突破基底膜进而发生侵袭、转移的关键步骤。近年来,随着对肿瘤发病机制研究的不断深入,学者们发现半胱氨酸蛋白酶抑制剂(cystatins)家族作为半胱氨酸蛋白酶的内源性抑制剂,与肿瘤的发生、发展、浸润和转移关系非常密切,有可能成为临床诊断和预后检测的分子指标[5]。本研究通过定量酶联免疫吸附法(ELISA)检测鼻咽癌患者治疗前、后血清中MIP-3α及cystatin A的水平,探讨其在鼻咽癌诊断、与临床病理特征关系以及疗效评价中的作用。
1 资料和方法
1.1 研究对象
收集自2009年2月—2010年5月梧州市红十字会医院肿瘤科收治的140例初治鼻咽癌患者,其中男性101例,女性39例,中位年龄47岁(10~76岁)。所有患者均经活检病理证实为鼻咽癌,按照WHO分型原则,角化型鳞癌3例,分化型非角化性癌20例,未分化型非角化性癌117例。放疗前作鼻咽部MRI、鼻咽纤维镜或间接鼻咽镜检查,常规胸片、腹部B超以及胸部CT、ECT等检查,以明确肿瘤范围、排除远处转移。所有患者根据上述检查结果按照“鼻咽癌2008分期”方案[6]进行临床分期。并以100名健康体检者为对照,男性71例,女性29例,中位年龄49岁(21~75岁)。
1.2 治疗方法
所有患者均接受常规二维放射治疗或三维适形放射治疗,鼻咽常规剂量68~74 Gy,颈淋巴结常规剂量64~70 Gy,预防剂量为50~56 Gy;有1例患者在放疗第6周后,出现Ⅲ度口咽反应,拒绝继续放疗,其鼻咽部治疗剂量仅为58 Gy。对Ⅲ、Ⅳa期的患者在放疗基础上加用同期化疗或诱导化疗。诱导化疗选择顺铂(25 mg/m2,第1~3天)加5-氟尿嘧啶(450 mg/m2,第1~3天),每3周1次,共2个疗程。同期化疗选择顺铂(25 mg/m2,第1~3天),每3周1次,共3个疗程;化疗在放疗当天开始。
1.3 实验方法
进入研究队列的患者在治疗前、治疗结束后各抽血1次。离心分离血清,-70℃冷冻保存待检。采用ELISA,MIP-3α及cystatin A定量ELISA检测试剂盒购自USCN公司。所有操作按试剂说明书进行。
1.4 近期疗效评价
在治疗结束后3个月依据体格检查、鼻咽纤维镜及MRI结果评价近期疗效。采用WHO实体瘤疗效评价标准分为完全缓解(complete remission)、部分缓解(partial remission)、稳定(stable disease)和进展(progression disease)。根据近期疗效评估结果把鼻咽癌患者分为完全缓解组和部分缓解组;根据1年随访结果分为未发生远处转移组和发生远处转移组。
1.5 统计学处理
应用SPSS 13.0软件进行统计分析。结果采用x±s 表示。患者治疗前、后MIP-3α及cystatin A水平间比较采用配对t检验;两组间均数比较采用独立样本t检验或者校正t’ 检验;多组间均数比较采用单向方差分析,多重比较采用SNK检验。采用受试者工作特征(ROC)曲线确定MIP-3α及cystatin A检测的截断点,计算相应的敏感度、特异度、准确度及曲线下面积等评价指标。MIP-3α和cystatin A水平相关性采用Pearson相关分析。用Kaplan-Meier法计算患者生存率。P<0.05为差异有统计学意义。
2 结 果
2.1 鼻咽癌患者治疗前、后和健康对照者血清MIP-3α及cystatin A水平比较
鼻咽癌患者治疗前血清MIP-3α水平为(87.20±74.05)pg/mL,显著高于治疗后的(23.58±22.56)pg/mL和对照者的(20.95±12.82)pg/mL(t=11.738,P<0.001;t’=10.371,P<0.001);而患者治疗后血清MIP-3α水平与对照者比较差异无统计学意义(t’=1.148,P=0.252,图1A)。
鼻咽癌患者治疗前血清cystatin A为(17.67±13.79)ng/mL,显著高于治疗后的(10.57±8.14)ng/mL和对照者的(10.40±5.82)ng/mL(t=9.706,P<0.001;t’=5.579,P<0.001);而患者治疗后血清cystatin A水平与对照者比较差异无统计学意义(t’=0.190,P=0.850,图1B)。
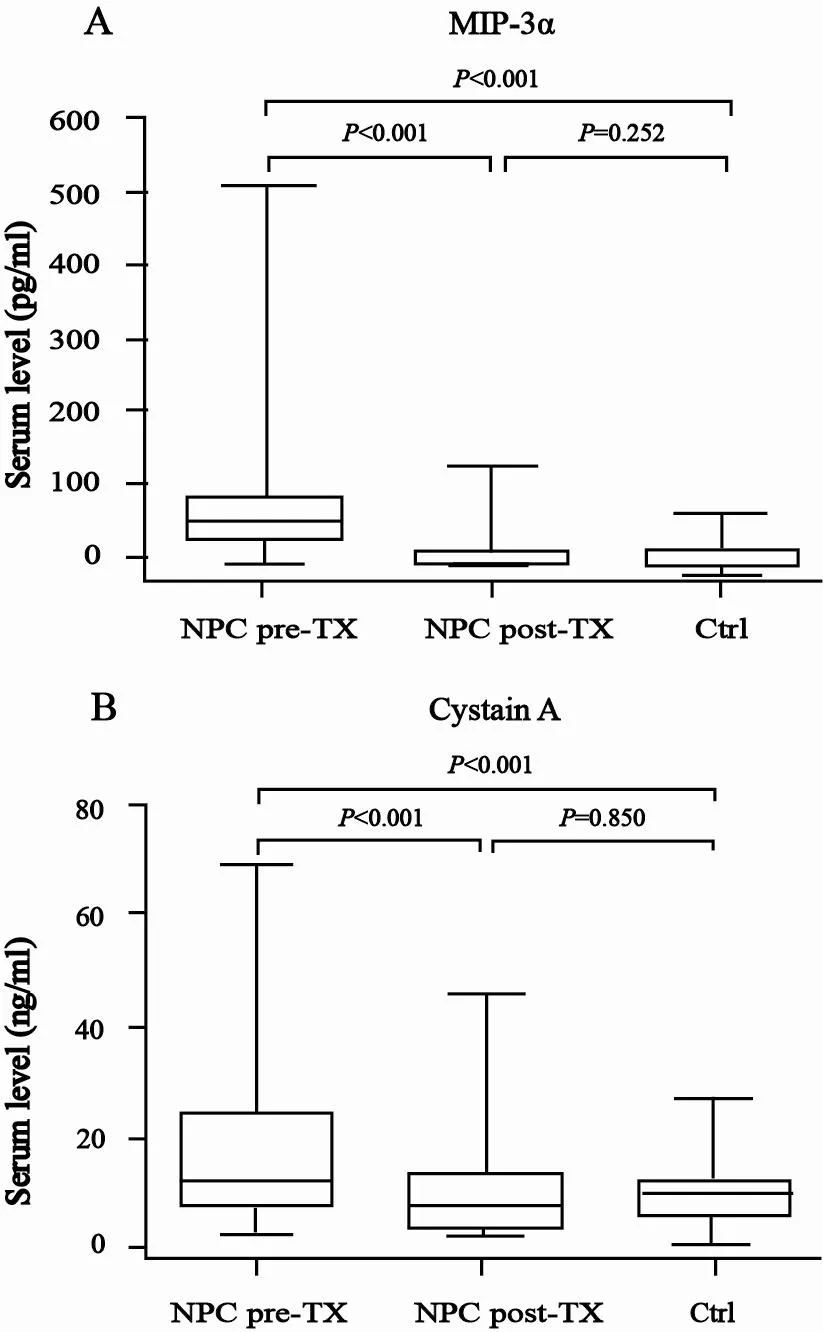
图 1 治疗前、后鼻咽癌患者和对照组血清MIP-3α及cystatin A水平Fig. 1 Serum MIP-3α and cystatin A levels in NPC patients before and after treatment and healthy controls
2.2 治疗前血清MIP-3α及cystatin A水平与鼻咽癌患者临床病理特征的关系
治疗前血清MIP-3α水平与鼻咽癌患者年龄、性别和N分期无关(P>0.05),而未分化型非角化性癌、T3~T4分期、临床Ⅲ~Ⅳa期患者的血清MIP-3α水平分别显著高于分化型非角化性癌、T1~T2分期、临床Ⅰ~Ⅱ期患者(P<0.05,表1)。
治疗前血清cystatin A水平与鼻咽癌患者性别、病理类型、T分期和N分期无关(P>0.05),而年龄45岁以上、临床Ⅲ~Ⅳa期患者的血清cystatin A水平分别显著高于45岁以下、临床Ⅰ~Ⅱ期患者(P<0.05,表1)。
鼻咽癌患者治疗前血清MIP-3α及cystatin A水平呈一定的正相关 (r=0.402,P<0.001)。

表 1 治疗前血清MIP-3α及cystatin A水平与鼻咽癌患者临床病理特征的关系Tab. 1 Association of pre-treatment serum MIP-3α and cystatin A levels with clinicopathologic characteristics in NPC patients
2.3 血清MIP-3α及cystatin A对鼻咽癌的诊断效能
以血清MIP-3α水平31 pg/mL为截断点,诊断鼻咽癌的敏感度为92.1%,特异度为86.0%,准确度为89.6%,ROC曲线下面积为0.948;以血清cystatin A水平16 ng/mL为截断点,诊断鼻咽癌的敏感度为42.1%,特异度为85.0%,准确度为60.0%,ROC曲线下面积为0.645(图2)。
2.4 治疗后血清MIP-3α及cystatin A水平与鼻咽癌近期疗效的关系
140例患者均完成治疗,34例(24.3%)患者接受单纯放疗,106例(75.7%)患者接受放化综合治疗。治疗结束后3个月评价鼻咽原发灶和颈部淋巴结转移灶的疗效。结果显示,132例(94.3%)患者鼻咽原发灶完全缓解,8例(5.7%)患者鼻咽原发灶部分缓解;121例(86.4%)患者颈部淋巴结转移灶完全缓解,19例(13.6%)患者颈部淋巴结转移灶部分缓解。

图 2 ROC曲线分析MIP-3α及cystatin A对鼻咽癌的诊断效能Fig. 2 Diagnostic efficacies of MIP-3α and cystatin A level for NPC by ROC curve
鼻咽原发灶完全缓解组患者血清MIP-3α水平为(22.42±20.23)pg/mL,显著低于部分缓解组患者的(42.79±34.80)pg/mL(P<0.05),而与对照组比较差异无统计学意义(P>0.05,图3A)。鼻咽原发灶完全缓解组患者与部分缓解组患者血清cystatin A水平分别为(10.43±8.25)ng/mL及(12.88±5.94)ng/mL,与对照组比较差异无统计学意义(P=0.641,图3B)。
颈部淋巴结转移灶完全缓解组患者血清MIP-3α水平为(21.66±18.49)pg/mL,显著低于部分缓解组患者的(35.87±28.30)pg/mL(P<0.05),而与对照组比较差异无统计学意义(P>0.05,图4A)。颈部淋巴结转移灶完全缓解组患者与部分缓解组患者血清cystatin A水平分别为(10.16±7.89) ng/mL及(13.17±9.36)ng/mL,与对照组比较差异无统计学意义(P=0.239,图4B)。
2.5 生存情况
140例鼻咽癌患者1年总生存率为97.1%。随访1年期间,有7例患者发生远处转移,1例患者发生鼻咽复发。发生远处转移患者的治疗后血清MIP-3α及cystatin A水平分别为(53.78±32.54) pg/mL和(18.24±9.29)ng/mL,均显著高于未发生远处转移患者的(22.00±20.91)pg/mL和(10.17±7.91) ng/mL(P<0.05);未发生远处转移患者治疗后血清MIP-3α及cystatin A水平与对照者比较差异无统计学意义(P>0.05,图5)。
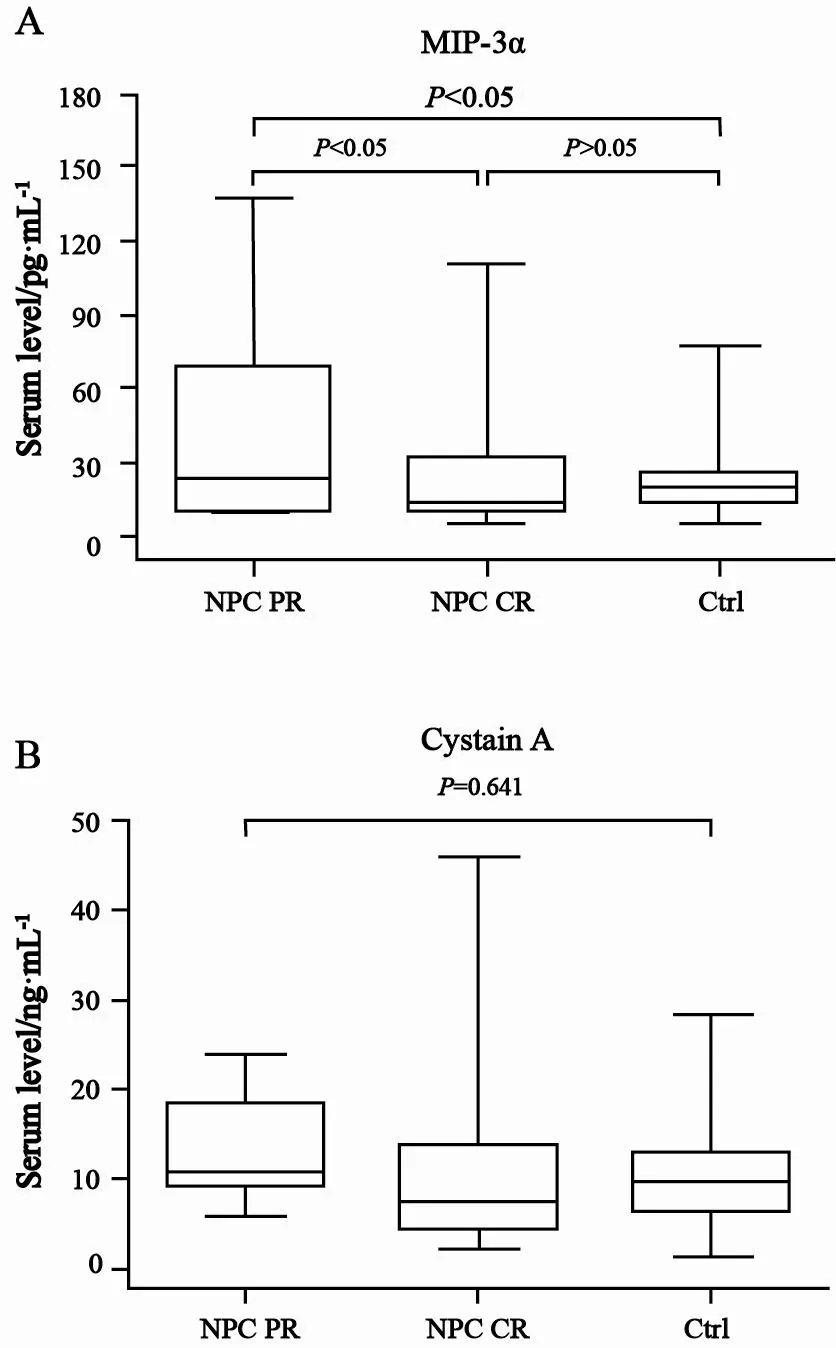
图 3 鼻咽原发灶完全缓解组、部分缓解组患者及健康对照者血清MIP-3α和cystatin A水平比较Fig. 3 Post-treatment serum MIP-3α and cystatin A levels in NPC patients with complete remission and partial remission in primary tumor, and in controls
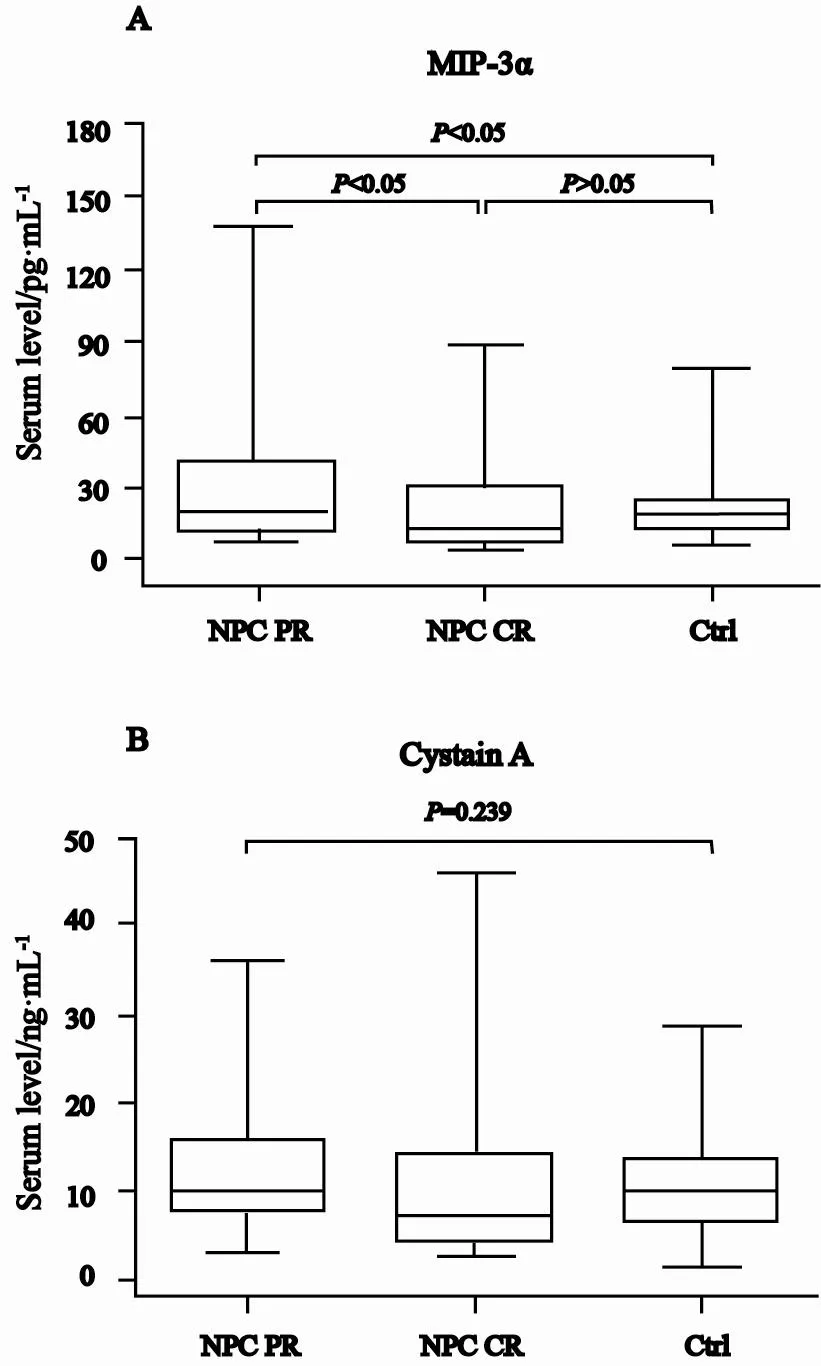
图4 颈部淋巴结转移灶完全缓解组、部分缓解组患者及健康对照者血清MIP-3α和cystatin A水平比较Fig.4 Post-treatment serum MIP-3α and cystatin A levels in NPC patients with complete remission and partial remission in cervical lymph nodes, and in controls

图 5 随访1年发生远处转移鼻咽癌患者、未发生远处转移患者及健康对照者血清MIP-3α和cystatin A水平比较Fig. 5 Post-treatment serum MIP-3α and cystatin A levels in NPC patients with and without distant metastasis after 1-year follow-up, and in controls
3 讨 论
近年来的研究显示浸润T淋巴细胞可能通过膜结合配体或者分泌细胞因子促进肿瘤生长和存活;同样,瘤内的调节性T淋巴细胞可以增强局部的免疫抑制以帮助鼻咽癌细胞逃避抗肿瘤免疫应答[7]。但是T细胞如何被招募到鼻咽癌组织仍未明确。有证据显示趋化性细胞因子可由肿瘤细胞以及肿瘤微环境中的细胞包括肿瘤相关成纤维细胞、间质细胞、内皮细胞、肿瘤相关巨噬细胞和中性粒细胞产生。趋化性细胞因子可通过吸引内皮细胞和促进血管生成或者通过影响癌细胞移动性的方式促进肿瘤生长和转移[8]。CCL20基因编码的MIP-3α蛋白是T细胞及未成熟树突状细胞强有力的趋化物。据报道多发性骨髓瘤[9]、肝细胞癌[10]、口腔上皮癌[11]MIP-3α表达均升高,MIP-3α及其受体CCR6可促进胰腺癌细胞的生长和侵袭[12]。
本研究结果显示,鼻咽癌患者治疗前血清MIP-3α水平显著高于健康对照者,治疗后明显下降,MIP-3α的敏感度和特异度较高,对于辅助诊断鼻咽癌有一定的临床意义。在本文中,分析初治不同TNM分期鼻咽癌患者的血清MIP-3α水平,发现T3~T4期患者血清MIP-3α水平显著高于T1~T2分期患者,临床Ⅲ~Ⅳa期患者的血清MIP-3α水平明显高于Ⅰ~Ⅱ期患者,提示初治鼻咽癌患者血清MIP-3α水平可能与原发灶的进展有关,随着肿瘤进展,血清MIP-3α水平有上升的趋势。经治疗后,近期疗效达到完全缓解的患者血清MIP-3α水平降至健康对照者水平;而部分缓解的患者其血清MIP-3α浓度仍高于健康对照者。在1年内发生远处转移的患者其治疗后血清MIP-3α水平亦明显高于未发生远处转移患者和健康对照者。提示血清MIP-3α水平可作为鼻咽癌血清学诊断、判断分期和预测近期疗效的潜在指标。
基膜损伤被认为是肿瘤侵袭的重要标志,蛋白水解酶导致的细胞外基质降解是肿瘤细胞侵袭和转移的关键步骤。目前研究较多的细胞外基质蛋白水解酶包括木瓜蛋白酶样的溶酶体半胱氨酸蛋白酶,如cathepsin B、H和L等,以及它们的生物抑制剂cystatin A、B和C等。Cathepsins与cystatins共同参与肿瘤生长、侵袭以及转移过程中的细胞外基质的降解和重建[13]。目前有关于cystatin A在肿瘤发生和转移的预后价值方面的作用仍存在争议。在肿瘤中,cystatin的抑制效应有利于抵消肿瘤相关的蛋白水解酶活性,也有可能因为抑制抗肿瘤免疫应答半胱氨酸蛋白水解酶功能而产生有害影响,这主要依赖于其在细胞和组织中的定位[13]。Kuopio等[14]报道cystatin A阳性乳腺癌患者的肿瘤体积大于阴性患者,其死亡风险也显著较高。Parker等[15]则报道高表达cystatin A的浸润性乳腺导管癌患者的预后和生存更佳,cystatin A表达可通过抑制cathepsin B的方式来减少乳腺癌远处转移;cystatin A在肿瘤原位灶和转移灶微环境可能有差异调节机制。在非小细胞肺癌[16]、头颈部鳞癌[17]、喉癌[18]患者肿瘤组织中cystatin A高表达,cystatin A水平升高与患者预后较好呈正相关。肝癌[19]、结直肠癌[20]患者血清cystatin A水平升高,cystatin A水平与肝癌肿瘤体积及病损部位数目呈正相关,而高水平的cystatin A则与短的结直肠癌生存时间相关。上述所观察到的cystatin A表达水平与患者生存的关系各有不同,可能与不同生物样本类型的内在差异有关。肿瘤组织中cystatin A表达上调在一定范围内可以反向平衡过表达的肿瘤相关蛋白水解酶活性。细胞外cystatins水平可能不仅是反映肿瘤本身的局部表达变化,而且与机体对恶性疾病的系统性免疫应答有关。综上所述,血清MIP-3α与cystatin A可作为判断鼻咽癌分期和治疗后近期疗效的新的肿瘤标志物,但是否可能成为鼻咽癌患者长期生存的预测指标,仍需进一步随访观察。
[1] CHENG S H, JIAN J J, TSAI S Y, et al. Long-term survival of nasopharyngeal carcinoma following concomitant radiotherapy and chemotherapy[J]. Int J Radiat Oncol Biol Phys, 2000, 48(5): 1323-1330.
[2] LIN J C, JAN J S, HSU C Y, et al. Phase III study of concurrent chemoradiotherapy versus radiotherapy alone for advanced nasopharyngeal carcinoma: positive effect on overall and progression-free survival[J]. J Clin Oncol, 2003, 21(4): 631-637.
[3] CHARO I F, RANSOHOFF R M. The many roles of chemokines and chemokine receptors in inflammation[J]. N Engl J Med, 2006, 354(6): 610-621.
[4] SCHUTYSER E, STRUYF S, Van DAMME J. The CC chemokine CCL20 and its receptor CCR6[J]. Cytokine Growth Factor Rev, 2003, 14(5): 409-426.
[5] RIVENBARK A G, COLEMAN W B. Epigenetic regulation of cystatins in cancer[J]. Front Biosci, 2009, 14: 453-462.
[6] 中国鼻咽癌临床分期工作委员会. 鼻咽癌'92分期修订工作报告[J]. 中华放射肿瘤学杂志, 2009, 18(1): 2-6.
[7] LAU K M, CHENG S H, LO K W, et al. Increase in circulating Foxp3+CD4+CD25(high) regulatory T cells in nasopharyngeal carcinoma patients[J]. Br J Cancer, 2007, 96(4): 617-622.
[8] LAZENNEC G, RICHMOND A. Chemokines and chemokine receptors: new insights into cancer-related inflammation[J]. Trends Mol Med, 2010, 16(3): 133-144.
[9] GIULIANI N, LISIGNOLI G, COLLA S, et al. CC-chemokine ligand 20/macrophage inflammatory protein-3alpha and CC-chemokine receptor 6 are overexpressed in myeloma microenvironment related to osteolytic bone lesions[J]. Cancer Res, 2008, 68(16): 6840-6850.
[10] YAMAUCHI K, AKBAR S M, HORIIKE N, et al. Increased serum levels of macrophage inflammatory protein-3alpha in hepatocellular carcinoma: relationship with clinical factors and prognostic importance during therapy[J]. Int J Mol Med, 2003, 11(5): 601-605.
[11] CHANG K P, KAO H K, YEN T C, et al. Overexpression of macrophage inflammatory protein-3alpha in oral cavity squamous cell carcinoma is associated with nodal metastasis[J]. Oral Oncol, 2011, 47(2): 108-113.
[12] CAMPBELL A S, ALBO D, KIMSEY T F, et al. Macrophage inflammatory protein-3alpha promotes pancreatic cancer cell invasion[J]. J Surg Res, 2005, 123(1): 96-101.
[13] MAGISTER S, KOS J. Cystatins in immune system[J]. J Cancer, 2013, 4(1): 45-56.
[14] KUOPIO T, KANKAANRANTA A, JALAVA P, et al. Cysteine proteinase inhibitor cystatin A in breast cancer[J]. Cancer Res, 1998, 58(3): 432-436.
[15] PARKER B S, CIOCCA D R, BIDWELL B N, et al. Primary tumour expression of the cysteine cathepsin inhibitor Stefin A inhibits distant metastasis in breast cancer[J]. J Pathol, 2008, 214(3): 337-346.
[16] WERLE B, SCHANZENBACHER U, LAH T T, et al. Cystatins in non-small cell lung cancer: tissue levels, localization and relation to prognosis[J]. Oncol Rep, 2006, 16(4): 647-655.
[17] STROJAN P, ANICIN A, SVETIC B, et al. Stefin a and stefin B: markers for prognosis in operable squamous cell carcinoma of the head and neck[J]. Int J Radiat Oncol Biol Phys, 2007, 68(5): 1335-1341.
[18] LI C, CHEN L, WANG J, et al. Expression and clinical significance of cathepsin B and stefin A in laryngeal cancer[J]. Oncol Rep, 2011, 26(4): 869-875.
[19] LETO G, TUMMINELLO F M, PIZZOLANTI G, et al. Lysosomal cathepsins B and L and Stefin A blood levels in patients with hepatocellular carcinoma and/or liver cirrhosis: potential clinical implications[J]. Oncology, 1997, 54(1): 79-83.
[20] KOS J, KRASOVEC M, CIMERMAN N, et al. Cysteine proteinase inhibitors stefin A, stefin B, and cystatin C in sera from patients with colorectal cancer: relation to prognosis[J]. Clin Cancer Res, 2000, 6(2): 505-511.
Expression of serum MIP-3α and cystatin A in patients with nasopharyngeal carcinoma and their clinical significance
LI Jun1,2, TANG Min-zhong1,3, LU Ai-ying1,2, ZHONG Wei-ming4, GAO Jian-quan4, ZHENG Yu-ming1, ZENG Hong1, CHEN Wan-sheng4, LIANG Wei4, CAI Yong-lin1,2(1.Wuzhou Health System Key Laboratory for Nasopharyngeal Carcinoma Etiology and Molecular Mechanism, Wuzhou Guangxi 543002, China; 2.Clinical Laboratory, Wuzhou Red Cross Hospital, Wuzhou Guangxi 543002, China; 3.College of Life Science and Bio-Engineering, Beijing University of Technology, Beijing 100022, China; 4.Department of Oncology, Wuzhou Red Cross Hospital, Wuzhou Guangxi 543002, China)
Background and purpose: To date, it mainly depended on imaging examination for detection of residual lesions, recurrence and distant metastasis, evaluation the sensitivity of radiotherapy and chemotherapy, and prognosis in nasopharyngeal carcinoma (NPC). Thus, searching for new tumor markers for NPC early diagnosis and individualized treatment is still merited. This study was aimed to investigate the expressions of serum macrophageinflammatory protein (MIP)-3α and cystatin A in patients with NPC before and after treatment, and to explore two markers’ value in NPC diagnosis, clinicopathological characteristics and clinical outcome assessment. Methods: The serum levels of MIP-3α and cystatin A in 140 primary NPC patients without distant metastasis before and after treatment were detected by enzyme-linked immunosorbent assay (ELISA) and compared with those in 100 healthy controls. Results: The sensitivity of MIP-3α and cystatin A were 92.1% and 42.1%, respectively; and the specificity of MIP-3α and cystatin A were 86.0% and 85.0%, respectively. All 140 NPC patients had complete remission (CR) or partial remission (PR). Serum levels of MIP-3α and cystatin A in pre-treatment patients with NPC were higher than those in post-treatment patients and controls. Serum MIP-3α and cystatin A levels were associated with overall stage of NPC, and MIP-3α was also associated with T classification of NPC. The serum MIP-3α level in NPC with CR after treatment reduced to the level in control group, and that was still significantly higher in NPC with PR than in control group. No significant difference was found in the serum cystatin A level between NPC with CR or PR after treatment and control group. During 1-year follow-up, the post-treatment serum levels of MIP-3α and cystatin A were significantly higher in patients with distant metastasis than in patients without distant metastasis and controls. There was found statistically significant correlation between MIP-3α and cystatin A.Conclusion: MIP-3α may be a potential marker of NPC serological diagnosis. The detection of serum MIP-3α and cystatin A may contribute to the NPC staging and prediction of short-term clinical outcomes.
Nasopharyngeal carcinoma; Macrophage inflammatory protein-3α; Cystatin A; Clinical outcome
10.3969/j.issn.1007-3969.2013.10.011
R739.62
:A
:1007-3639(2013)10-0845-07Correspondence to: CAI Yong-lin E-mail: cylzen@163.com
2013-06-17
2013-09-30)
广西科技计划项目(No:11194011,114003A-49)。
蔡永林 E-mail:cylzen@163.com
