加拿大一枝黄花总黄酮最佳提取工艺的研究
2013-06-07李彩景
李彩景
福建省立医院药学部,福建 福州 350001
加拿大一枝黄花总黄酮最佳提取工艺的研究
李彩景
福建省立医院药学部,福建 福州 350001
目的:提取一枝黄花中总黄酮并测定含量,确定最佳提取工艺。方法:采用乙醇回流提取总黄酮,比色法测定总黄酮的含量,高效液相测定总黄酮中芦丁含量,冷浸法测定总黄酮浸出物含量。结果:用70%的8倍于加拿大一枝黄花体积乙醇,提取3次,1.5h/次,提取效果较好。
加拿大一枝黄花;总黄酮;含量测定
加拿大一枝黄花(Solidago Canadensis L)[1],是原产于北美的一种菊科多年生草本植物,20世纪30年代开始进入我国[2],现在这种植物已成为我国大部分境内迅速扩散传播的恶性杂草。加拿大一枝黄花包含的主要成分有皂苷、挥发油和黄酮等,其乙醇提取物具有很强的抗氧化和自由基消除能力,在诸多类型天然抗氧化剂中[3],黄酮类成分能有效减轻细胞的过氧化胁迫,阻止低密度脂质的过氧化等作用。为了综合利用加拿大一枝黄花,变废为宝[4],用植物类黄酮的独特优势,确定加拿大一枝黄花总黄酮的最佳提取工艺,为后续开辟安全、无副作用的绿色化妆品提供便利[5]。
1 加拿大一枝黄花提取工艺研究
1.1 材料来源及处理 加拿大一枝黄花采自南京青龙山,加拿大一枝黄花打粉过40目筛备用[6]。
1.2 正交试验表头设计及总黄酮的提取

表1表头设计

表2 正交实验表
上述试验药材加热回流得到乙醇提取液,挥去乙醇[7],干燥后得浸膏,称重(g),如表3。

表3 浸膏质量
1.3 紫外法分光光度法(UV)测定样品中总黄酮含量
1.3.1 仪器与试剂
752紫外可见分光光度计(上海精密科学仪器有限公司)
芦丁对照品:中国药品生物制品鉴定所(100080-200306)
甲醇:色谱纯;亚硝酸钠,硝酸铝,氢氧化钠:分析纯;蒸馏水。
1.3.2 溶液配制
(1)5%亚硝酸钠;10%硝酸铝;1mol/L NAOH溶液。
称取亚硝酸钠2.5g置50ml烧杯中,加水配制成5%亚硝酸钠溶液;
称取硝酸铝5g置50ml烧杯中,加水配制成10%硝酸铝溶液;
称取NaOH8g置200ml烧杯中,加水配制成1mol/L NAOH溶液。
(2)对照品溶液配制
精密称取干燥至恒重的芦丁对照品50mg置100ml容量瓶中,加甲醇适量,置水浴上微热,使芦丁溶解,放冷,加甲醇至刻度,摇匀,得0.5mg/ml对照品溶液。
1.3.3 标准曲线制备
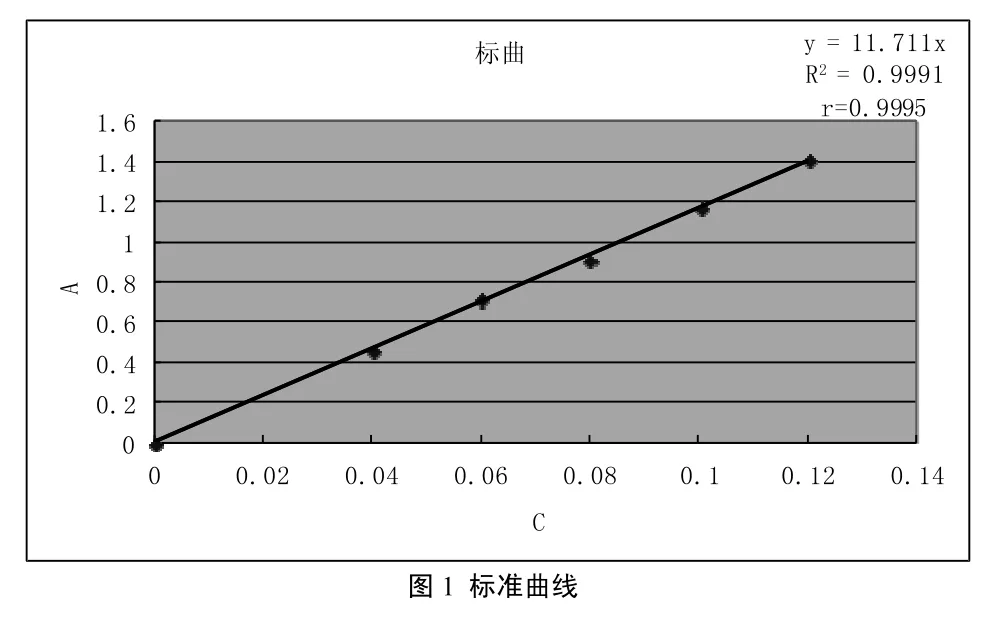
精密量取对照品溶液(0.5mg/ml)0.0,2.0,3.0,4.0,5.0,6.0ml分别置于25ml容量瓶中,各加水至6.0ml,加5%亚硝酸钠溶液1ml,充分摇匀,放置6min,加入10%硝酸铝溶液1ml,充分摇匀,放置6mim,加入1mol/L NAOH溶液10ml,再加水至刻度,摇匀,放置15min,于分光光度计上以第一份溶液为空白,在510nm波长[8],钨灯,测定吸光度值A,表4,以A为纵坐标,对照品溶液浓度C为横坐标,绘制标准曲线。如图1,经回归分析得回归方程:Y=11.711X,相关系数R2=0.9991,r =0.9995

表4 吸光度值A
1.4 样品溶液总黄酮含量测定
精密称取浸膏0.25g,置100ml容量瓶中,加甲醇至刻度,再分别量取5ml置25ml容量瓶中,照标准曲线制备项的方法,自“各加水至6ml”起依法操作,直至测定出样品的吸光度值[9],在根据标准曲线计算总黄酮含量,表5。
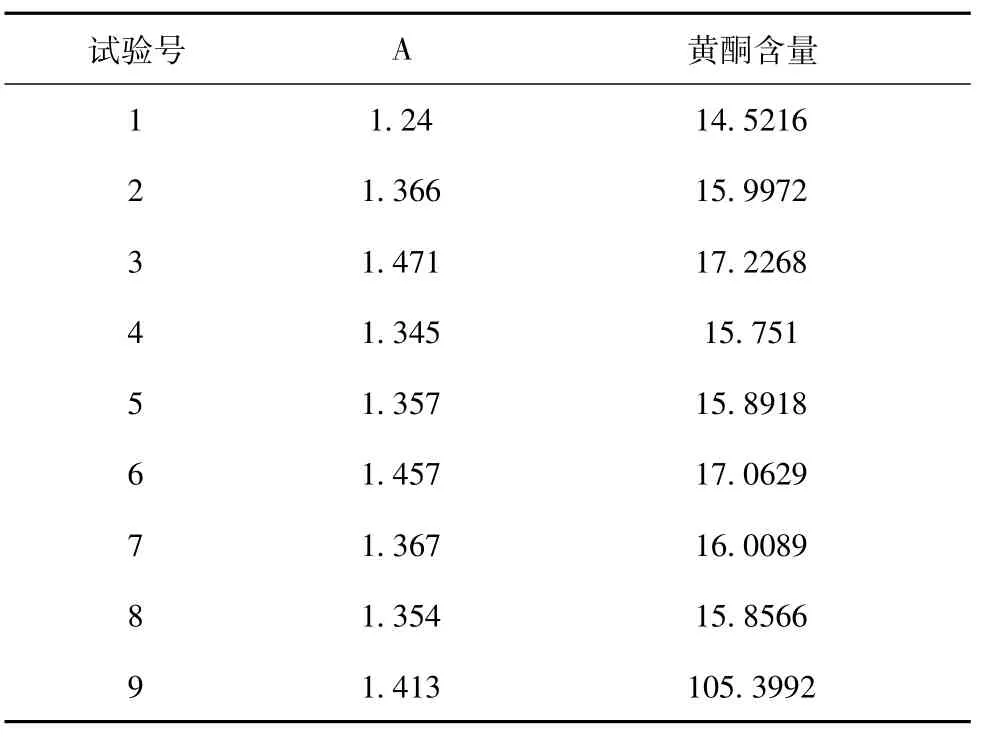
表5 样品溶液总黄酮含量测定
1.5 高效液相(HPLC)测定样品中芦丁含量
1.5.1 仪器与试剂
Waters2690高效液相色谱仪,996PDA二极管矩阵检测器,Millennium32色谱管理系统;
芦丁对照品:中国药品生物制品鉴定所(100080-200306);甲醇:色谱纯;重蒸馏水:自制。
1.5.2 方法与结果
色谱条件的选择和系统适用性试验:Alltima C18柱(4.6x250nm;5μm),柱温为300C;以甲醇-0.4%磷酸水(30:70)为流动相,流速为1.0ml/min;检测波长为360nm。在上述色谱条件下,理论塔板数按芦丁计算为6130[10]。
1.5.3 溶液的配置
对照品溶液的制备:精密称取芦丁对照品适量,加甲醇制成每1ml含100μg的溶液。
样品溶液的制备:精密称取加拿大一枝黄花浸膏0.25g,置100ml容量瓶中,加甲醇至刻度。精密吸取1ml溶液置25ml容量瓶中,加甲醇至刻度。
1.5.4 方法学考察
(1)外标一点法[11]:称取芦丁对照品10mg,精密称定,加甲醇制成对照品贮备液,再精密吸取上述对照品溶液0.8ml,用甲醇定容至5ml,吸取20μl对照品溶液注入液相色谱仪测定,得到其峰面积4129。
(2)样品含量测定:分别精密吸取样品溶液20μl注入高效液相色谱仪测定,根据外标一点法计算结果如表6:
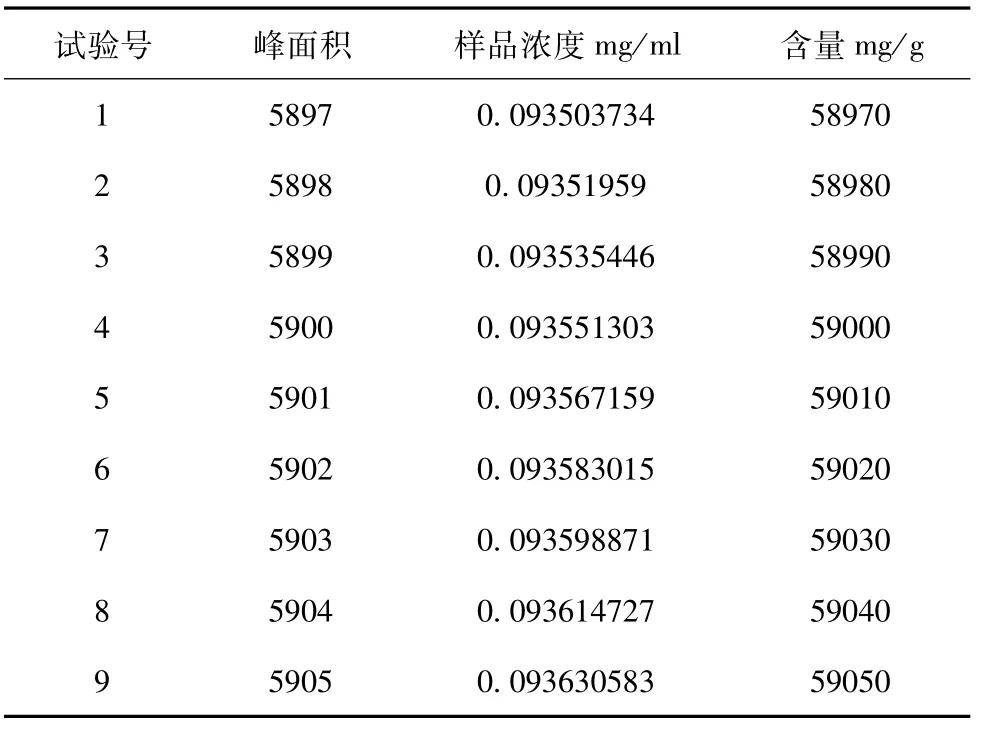
表6 样品含量
1.6 浸出物量的测定—冷浸法
精密称取浸膏4g,置100ml锥形瓶中,精密加70%乙醇,密塞,冷浸,前6小时内时时振摇,再静置18小时,用干燥滤器滤过,取20ml滤液[12]。挥去乙醇,干燥精密称重(g),表7。

表7 浸出物含量
2 结果与分析
采用SPSS13.0进行结果统计。
2.1 紫外SPSS统计结果

表8 总黄酮含量正交结果
2.2 HPLCSPSS统计结果
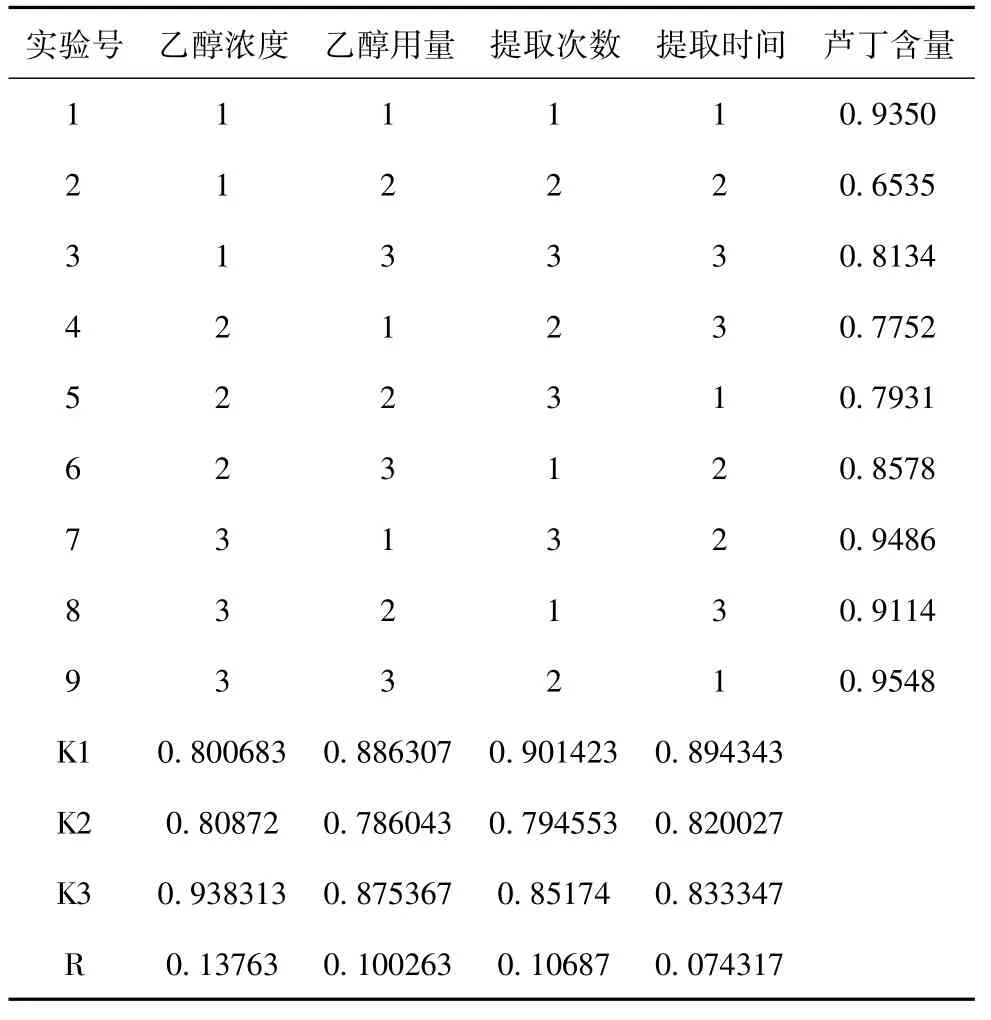
表9 芦丁含量正交结果
3 正交加权统计结果
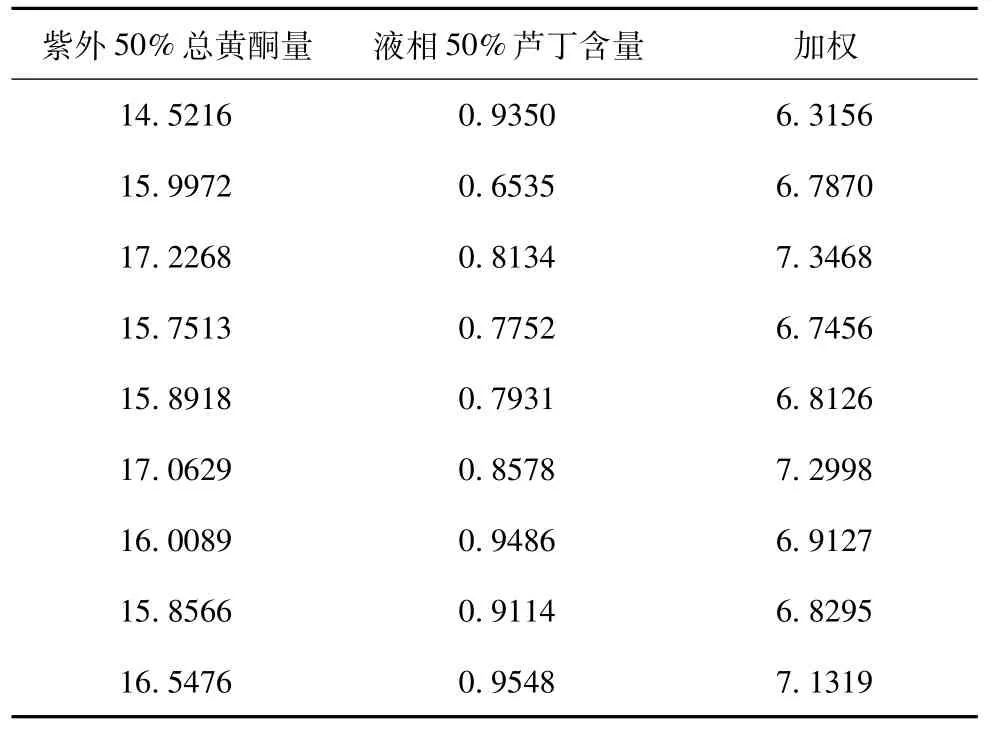
表10 正交加权统计结果
4 结论
根据紫外、液相、浸出物结果的加权,得出最佳提取工艺:70%的8倍于原药材体积乙醇,提取3次,1.5h/次。
5 讨论
加拿大一枝黄花中含有较为丰富的黄酮类成分[13],正交试验中影响提取的效率的四个因素(乙醇浓度,乙醇体积,提取的时间,提取的次数)中提取的时间和提取的次数影响较小,而乙醇的浓度影响显著。所以用7%的8倍于原药材体积乙醇,提取3次,1.5h/次,提取较完全[14]。
加拿大一枝黄花乙醇提取物具有很强的抗氧化和自由基消除能力,而活性氧与自由基的产生被认为与人类的众多疾病的发生密切相关,在诸多类型天然抗氧化剂中[15],黄酮类成分能有效减轻细胞的过氧化胁迫,阻止低密度脂质的过氧化,预防和治疗多种疾病。通过对加拿大一枝黄花黄酮化合物提取工艺的研究,可以综合利用加拿大一枝黄花,变废为宝[16],同时可以扩大药源,极大的利用资源,具有良好的社会效益[17~18]。
[1]周明华,冉俊祥,陆军,等.应重视强加拿大一枝黄花的防治工作[J].植物检疫,2005,19(4):254-255.
[2]MCCABE P H,MCCRINDLE R,MURRAY R D H.Constituents of solidago species.Ⅰ.The constitution and strereochemistry of diterpenoids from Solidago Cabadensis L.[J].Tetrahedron,1969,25(10):2233-2239.
[3]MCCABE P H,MCCRINDLE R,MURRAY R D H.Constituents of solidago species.Ⅰ.The constitution and strereochemistry of diterpenoids from Solidago Cabadensis L[J].Tetrahedron,1969,25(10):2233-2239.
[4]MCCABE P H,MCCRINDLE R,MURRAY R D H.Constituents of solidago species.Ⅰ.The constitution and strereochemistry of diterpenoids from Solidago Cabadensis L[J].Tetrahedron,1969,25(10):2233-2239.
[5]McCABE P H,MCCRINDLE R,MURRAY R D H,et al.Constituents of solidago species.Ⅱ.reaction of soledagenone,the major diterpenoids form Solidago Canadensis L[J].Tetrahedron,1970,26(13):3091-3097.
[6]McCABE P H,MCCRINDLE R,MURRAY R D H,et al.Constituents of solidago species.Ⅱ.reaction of soledagenone,the major diterpenoids form Solidago Canadensis L[J].Tetrahedron,1970,26(13):3091-3097.
[7]STEPHANIE MELCHING,NILS BüLOW,KOLJA WIHSTUTZ,et al.Natural occurrence of both enantiomers of cadina-3,5-diene andδ-amorphene[J]. Phytochemistry,1997,44(7):1291-1296.
[8]SUSAN E HEADY,ROGER G LAMBERT,CHARLES V COVELL Jr.Determination of free amino acids in larval insect and gall tissues of the goldenrod,Solidago Canadensis L[J].Comparative Biochemistry and Physiology Part B:Biochemistry and Molecular Biology,1982,73(3):641-644.
[9]PAPATI,K SZENTMIHáLYI,A BALáZS,et al.HPLC analysis of the flavonoids in pharmaceutical preparations from Canadian goldenrod(Solidago Canadensis)[J].Chromatographia,2002,56(1):S65-S68.
[10]PRAKASH CHATURVEDULA V S,BING-NAN ZHOU,ZHIJIE GAO,et al.New lupane triterpenoids from Solidago Canadensis that inhibit the lyase activity of DNA polymerase[J].Bioorganic&Medicinal Chemistry,2004,23(12):6271 -6275.
[11]崔小兵,李伟,张萍,等.加拿大一枝黄花与一枝黄花中芦丁的比较研究[J].中国野生植物资源2008,S567.239.
[12]印丽萍,谭永彬,沈国辉,等.加拿大一枝黄花(Solidago Canadensis L.)的研究进展[J].杂草科学,2004,4:8-11.
[13]印丽萍,谭永彬,沈国辉,等.加拿大一枝黄花(Solidago Canadensis L.)的研究进展[J].杂草科学,2004,4:8-11.
[14]王开金,陈列忠,李宁,等.加拿大一枝黄花黄酮类成分及抗氧化与自由基消除活性的研究[J].中国药学杂志,2006,41(7):493-497.
[15]中国药典委员会,中华人民共和国药典,一部[S],广州:广东科技出版社,2005:187
[16]张劲松,李博,陈家宽,等.加拿大一枝黄花挥发油成分及其抗菌活性[J].复旦学报:自然科学版2006,45(3):412-416.
[17]竺传松,竺锡武,陈海敏,等.加拿大一枝黄花提取物抑菌作用初步研究[J].湖南农业科学,2006(4):76-77,80.
[18]段玉清,谢笔钧.加拿大一枝黄花黄酮类化合物在化妆品领域的研究与开发现状[J].黄酮类化合物化妆品,2002,12(6):23-26.
R284.2
A
1007-8517(2013)01-0028-03
2012.10.22)
