他可莫司联合小剂量激素治疗IgA肾病效果观察
2013-05-31张俊贤钱建忠
张俊贤,钱建忠
(吴江市盛泽医院肾内科,江苏 苏州 215228)
IgA肾病是进展性疾病,也是慢性肾脏病和终末期肾衰竭的主要原因[1]。延缓或逆转IgA肾病的进展是临床和基础研究的棘手问题。参与IgA肾病发病的因素有多种,包括遗传、IgA分子的异常以及肾小球系膜细胞对IgA沉积的反应等[2],其中免疫功能紊乱起着重要作用。因此,目前治疗IgA肾病的基本方案主要集中于激素和免疫抑制剂。激素治疗IgA肾病的疗效已得到肯定,而免疫抑制剂,如环磷酰胺、吗替麦烤酚酯、来复米特和咪唑立宾等治疗IgA肾病疗效尚未达成一致,且部分药物不良反应较大,限制了此类药物的广泛应用。
他克莫司是一种新型的免疫抑制剂,通过抑制T细胞活化和T辅助细胞依赖型 B细胞的增殖,抑制淋巴因子如 IL-2、IL-3和干扰素-γ的生成以及IL-2受体的表达,从而发挥免疫抑制效应。其目前已成为肾移植抗排斥反应的常规用药[3]。对狼疮性肾炎、膜性肾病、局灶阶段性肾小球硬化及系膜增生性肾小球肾炎的治疗有效[4-6]。本研究观察他克莫司联合小剂量激素治疗IgA肾病安全性及有效性,旨在为临床治疗IgA肾病提供安全且有效的方案。
1 对象与方法
1.1 病例
选择2007年11月至2008年10月在我院肾病内科住院的IgA肾病患者25例,年龄16~57岁,平均36.3岁,其中,男11例,女14例。肾活检前平均病程时间为8.83个月;尿蛋白定量平均为2.14 g,所有患者血糖均正常。25例患者,Lee氏Ⅱ级11例,Lee氏Ⅲ级8例,Lee氏Ⅳ级5例,Lee氏Ⅲ~Ⅳ级1例。
患者选择标准:病理类型为LeeⅡ~Ⅳ级;血肌酐<221 μmol/L;24 h 尿蛋白量 1.0 ~3.5 g;育龄妇女患者妊娠试验结果阴性,并同意采取避孕措施;患者本人同意并签署知情同意书。排除标准:合并狼疮性肾病、过敏性紫癜、强直性脊柱炎、肿瘤等继发性IgA肾病者;近1个月曾接受细胞毒性药物、免疫抑制剂等药物治疗;合并其他严重肾脏疾病;血肌酐>221 μmol/L;合并严重感染等致命性并发症;HBV血清学检测HbsAg、HbeAg、抗HBc阳性,HCV阳性及转氨酶超过正常值上限1倍者;患有恶性肿瘤或有恶性肿瘤病史、HIV感染史,禁止使用糖皮质激素及免疫抑制剂的患者;对大环内酯类药物过敏者。
1.2 分组及治疗方案
1.2.1 分组 25例IgA肾病患者,其中2例患者Lee氏分级分别为Ⅲ和Ⅳ级,使用激素联合吗替麦考酚酯治疗4个月后无效,停药2月后直接进入联合治疗组。其余23例患者随机分成2组,单纯激素组(n=14)和联合治疗组(n=9),前者给予单纯激素治疗,后者给予他克莫司联合小剂量激素治疗。
1.2.2 治疗方案 他克莫司给药方案:他克莫司(日本藤泽公司)起始口服剂量为0.075 mg/(kg·d),分2次于餐前1 h服用,连续6个月。服用10 d后检测全血他克莫司血药物浓度,以后每月检测1次,维持其血药物浓度为3~5 μg/L,如果浓度偏低,加大剂量,最大剂量不超过0.15 mg/(kg·d)。
激素给药方案:联合治疗组糖皮质激素(泼尼松龙)起始剂量为30 mg/d,单纯激素组则为0.5mg/(kg·d),两组均于8周后每4周减5 mg,减至10 mg/d后,按此剂量维持,且维持给药在1年以上。
治疗过程中出现下列情况,需要调整剂量:①服用他克莫司过程中出现肾功能恶化(肾功能正常者出现肾功能不全,或者肾功能不全者,血肌酐上升≥30%),剂量应减少30%,2周后复查肾功能无好转,则停药;② 药物浓度 >5 μg/L,剂量减少30%;③ 用药后如果出现白细胞 <3.0×109/L,但>2.0×109/L,剂量减半,1周后不能恢复则停药;白细胞<2.0×109/L,或中性粒细胞绝对值<1.0×109/L,暂时停药,如不能恢复则退出;④ 如出现高血糖,则调整剂量或者使用降糖药物治疗。退出试验标准:出现严重感染或其他不可解释之严重并发症者;治疗过程中发生妊娠者。
1.3 其他治疗
如果用钙离子拮抗剂和(或)β-受体阻断剂能将血压控制在125/75 mmHg以下,则不用血管紧张素转换酶抑制剂(ACEI)或血管紧张素Ⅱ受体阻滞剂(ARB)。如治疗前已经使用ACEI或ARB 4周以上,可继续使用,但不能合并使用,如已合并使用则停用其中一种。如在治疗过程中出现高血压时,不再加用ACEI或ARB,可以合并使用保肝药,但不能用联苯双脂,不能同时应用其他免疫抑制剂或者细胞毒药物。
1.4 观察指标
检测治疗前及治疗后 10 d,1,2,4,6 个月的肝功能、肾功能、血糖、血常规、24 h尿蛋白量等指标。记录治疗中出现的不良反应,如高血糖、高血压和肾功能恶化等。
1.5 疗效评价
疗效评价包括完全缓解、部分缓解及无效。完全缓解为24 h尿蛋白量低于0.3 g,且血肌酐不超过治疗前的2倍;部分缓解为24 h尿蛋白量较治疗前减少30%以上,但高于0.3 g,且血肌酐不超过治疗前的2倍;无效为24 h尿蛋白量未达到上述标准,或血肌酐超过治疗前的2倍。有效率=(完全缓解例数+部分缓解例数)/总例数×100%,完全缓解率=完全缓解例数/总例数×100%。
1.6 数据处理
用SPSS 14.0统计软件进行统计学处理。计量资料以均数±标准差)表示,计数资料以例数及百分数表示。多组间均数比较采用单因素方差分析。率的比较采用χ2检验。P<0.05为差异有统计学意义。
2 结果
2.1 一般情况
在治疗过程中所出现的不良反应均给予相应处理后症状缓解,无患者退出试验。
2.2 临床疗效
联合治疗组在治疗后10 d有效率及治疗后6个月时完全缓解率明显高于单纯激素组(P均=0.037)。两组间治疗后6个月尿蛋白定量比较,差异有统计学意义(P=0.036)。单纯激素组和联合治疗组在治疗过程中24 h尿蛋白定量呈下降趋势。见表1-2。

表1 两组患者的疗效比较Tab 1 Comparison of curative effect between the two groups
表2 两组患者各观察指标在治疗前和治疗中的变化 Tab 2 Comparison of various indexes between two groups before and after treatment

表2 两组患者各观察指标在治疗前和治疗中的变化 Tab 2 Comparison of various indexes between two groups before and after treatment
a:P <0.05,b:P <0.01,与同组治疗前比较;c:P <0.05,与同期单纯激素组比较
舒张压/mmHg单纯激素组组别 24 h尿蛋白/(g·L-1)血肌酐/(μmol·L-1)血糖/(mmol·L-1)白细胞/(×109)谷丙转氨酶/(U·L-1)收缩压/mmHg治疗前 2.0 ±0.9 91.2 ±24.6 5.7 ±0.7 6.2 ±1.1 24.1 ±20.4 135.6 ±12.8 76.4 ±10.8治疗后 10 d 1.9 ±1.0 90.2 ±20.1 5.4 ±0.6 7.3 ±2.3 26.1 ±11.8 131.6 ±10.9 74.9 ±10.3治疗后 1 个月 1.5 ±0.8 89.7 ±18.5 5.8 ±1.4 7.4 ±1.8 26.5 ±12.5 129.4 ±11.4 74.6 ±10.4治疗后 2 个月 1.2 ±0.7a 88.6 ±20.4 5.3 ±0.9 5.9 ±1.4 25.4 ±12.7 132.7 ±11.8 74.3 ±9.7治疗后 4 个月 1.1 ±0.7b 92.4 ±19.6 5.3 ±1.2 6.1 ±1.7 24.9 ±13.9 129.7 ±10.6 73.8 ±10.7治疗后 6 个月 1.0 ±0.6b 89.5 ±20.4 5.1 ±0.8 7.2 ±2.1 24.3 ±14.3 128.4 ±11.3 74.2 ±9.6 F 值 4.510 0.071 0.947 1.980 0.063 0.779 0.826 P 值 0.001 0.996 0.456 0.091 0.997 0.568 0.859联合治疗组治疗前 2.1 ±0.8 86.5 ±19.8 5.3 ±0.8 9.7 ±5.0 20.0 ±11.4 127.3 ±13.7 73.6 ±8.4治疗后 10 d 1.5 ±0.8 89.6 ±17.0 5.2 ±1.0 8.4 ±3.2 23.0 ±9.4 126.4 ±12.9 73.1 ±7.6治疗后 1 个月 1.2 ±0.8a 84.3 ±18.1 4.9 ±0.7 7.9 ±2.6 25.5 ±8.8 125.9 ±13.2 72.8 ±6.9治疗后 2 个月 0.9 ±0.6b 87.6 ±20.5 4.8 ±0.8 7.8 ±2.7 23.7 ±9.7 127.1 ±11.6 72.6 ±7.2治疗后 4 个月 0.6 ±0.5b 90.4 ±20.6 5.1 ±0.6 7.6 ±3.1 24.3 ±8.6 123.7 ±10.9 73.4 ±7.4治疗后 6 个月 0.5 ±0.5b,c 87.4 ±17.6 4.7 ±0.5 6.7 ±2.8 22.9 ±10.4 124.6 ±12.5 72.9 ±7.7 F 值 12.032 0.180 1.315 2.443 0.392 0.161 0.033 P值0.000 0.969 0.270 0.044 0.852 0.976 0.999
治疗后,随着病理损害加重,两组完全缓解率及有效率均呈下降趋势,但就单个一级而言,他克莫司联合小剂量激素疗效较单纯激素好,但差异无统计学意义,见表3。
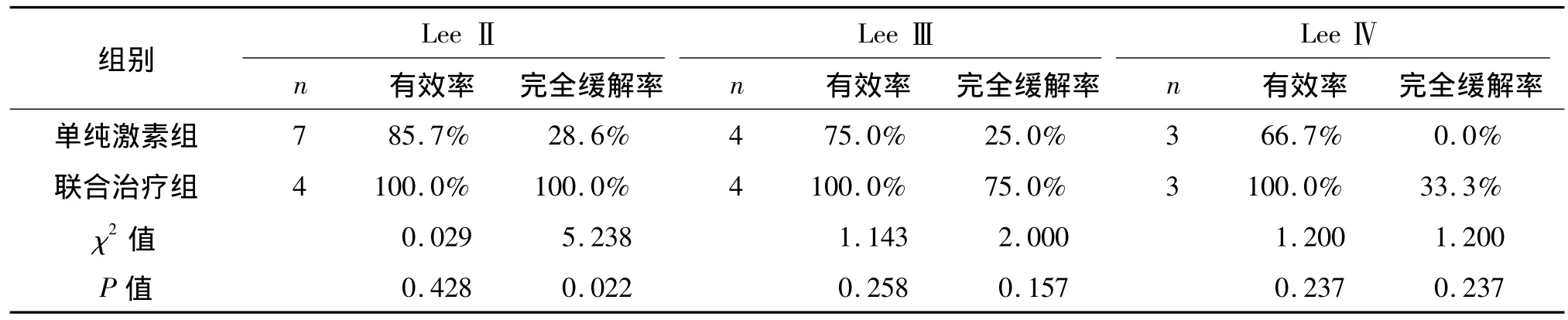
表3 两组患者中Lee氏分级情况及治疗效果Tab 3 The Lee grades and therapeutic effect in two groups
2.3 不良反应
在治疗前及治疗过程中,单纯激素组与联合治疗组的血肌酐、转氨酶、白细胞、血压等变化呈波动性,两组间比较,差异无统计学意义,见表2。
单纯激素组5例出现糖耐量异常;3例通过控制饮食血糖控制在6.20 mmol/L以下;2例控制饮食后空腹血糖仍在8.0 mmol/L以上,给予胰岛素降血糖治疗;1例出现咳嗽、咳痰伴发热,给予抗感染治疗1周后,体温恢复正常。
联合治疗组2例出现糖耐量异常,血糖最高达7.07 mmol/L,给予控制饮食后,血糖降至正常范围;1例出现震颤,经调整他克莫司血药浓度后,患者症状有所减轻。
所有患者均随访6个月,均无痤疮、多毛症、肱骨或股骨头坏死、腹泻、消化道溃疡等不良反应,各项生命体征较平稳。
3 讨论
原发性IgA肾病是目前全球最常见的肾小球疾病,也是我国最常见的慢性肾脏病和慢性肾衰竭的首要原发病[1]。IgA肾病的发病机制尚未完全阐明,缺乏有效的治疗药物。在IgA肾病的发生发展中,主要是免疫介导性炎症,免疫反应为始动因素,由其介导炎性反应而致病;系膜细胞受刺激后分泌多种炎性因子,而炎性因子又反过来促进系膜细胞异常分泌其他炎症介质、细胞因子和生长因子,加重炎性反应[2]。对伴有大、中量蛋白尿表现的IgA肾病,采用激素和免疫抑制剂治疗已较为肯定。目前用于临床的免疫抑制剂有环磷酰胺、咪唑立宾、来复米特、吗替麦考酚酯等,但这些药物的疗效报道尚未一致,部分药物的不良反应限制了其广泛应用[3-7]。
糖皮质激素作为抗炎和免疫抑制剂治疗IgA肾病已使用20余年[1]。激素治疗IgA肾病不仅能减少蛋白尿,而且能保护肾功能,延缓终末期肾病的进展[8]。故本研究采用用糖皮质激素治疗作为对照。
他克莫司是新型强效免疫抑制剂,能全面抑制T淋巴细胞的作用[9],不仅可用于免疫反应的预防,还能治疗已发生的免疫反应及自身免疫性疾病[10]。另外,他克莫司还可以直接作用于足细胞,保护其结构和功能[11]。他克莫司与环孢素都属于新一代的钙调神经磷酸酶抑制剂,但两者在细胞内作用的受体不同;他克莫司还能通过环孢素A不敏感的途径发挥独特的免疫抑制作用。对环磷酰胺及环孢素无效的患者仍有一定作用[9]。故本研究选择他克莫司,目的在于选择一种有效、不良反应较小的治疗方案。
结果显示,他克莫司联合激素治疗较单纯糖皮质激素治疗起效快,且疗效好;两组腹泻、血压升高及血肌酐上升、高血糖等不良反应的发生率比较,差异无统计学意义。
本研究显示,两组Lee氏分级各级的疗效随着病理损害加重,完全缓解率及有效率均呈下降趋势,就单一个级别而言,联合治疗组疗效优于单纯激素组,但差异无统计学意义。根据目前观察结果尚不能决定在何种病理损害中,应给予激素联合免疫抑制剂他克莫司。因为本研究患者例数较少,尚需要积累更多的临床病例资料,以便进一步进行证实。
虽然本研究中所有患者血肌酐在治疗过程中均未见明显升高,且尿蛋白呈下降趋势,但未进行肾脏组织活检术来直接观察两组患者肾脏病理变化,未能更直接地评价两种治疗方案的疗效。
从上述结果中我们看到,他克莫司联合小剂量激素对于表现为持续中等量蛋白尿的IgA肾病有显著的近期临床缓解作用,并且不良反应少;但其对IgA肾病的远期肾功能的保护作用、治疗后肾脏病理的改变及不良反应等有待于进一步研究。
[1] Monteiro RC,Moura IC,Launay P,et al.Pathogenic significance of IgA receptor interactions in IgA receptor interactions in IgA nephropathy[J].Trends Mol Med,2002,8(10):464-468.
[2] Pozzi C,Adnrulli S,Del Vecchio L,et a1.Corticosteroid effectiveness in IgA nephropathy:long-term results of a randomized,controlled trial[J].J Am Soc Nephrol,2004,15(1):157-163.
[3] Li YJ,Du Y,Li CX,et al.Family-based association study showing that immunoglobulin A nephropathy is associated with the polymorphisms 2093C and 2180T in the 3'untranslated region of the Megsin gene[J].J Am Soc Nephrol,2004,15(7):1739 -1743.
[4] 刘云,刘向东,朱铁锤.伴有中等量蛋白尿的IgA肾病的治疗[J].中国医药导报,2006,3(26):23-24.
[5] Kawasaki Y,Suzuki J,Sakai N,et al.Efficacy of prednisolone and mizoribine therapy for diffuse IgA nephropathy[J].Am J Nephrol,2004,24(1):147 - 153.
[6] 张欣洲,何永成,罗琼,等.来复米特治疗IgA肾病的多中心临床对照研究[J].中国实用内科杂志,2008,28(2):110-112.
[7] Frisch G,Lin J,Rosenstock J,et al.Mycophenolate mofetil(MMF)vs placebo in patients with moderately advanced IgA nephropathy:a double-blind randomized controlled trial[J].Nephrol Dial Transplant,2005,20(10):2139-2145.
[8] Cheng J,Zhang X,Zhang W,et al.Efficacy and safety of glucocorticoids therapy for IgA nephropathy:a metaanalysis of randomized controlled trials[J].Am J Nephrol,2009,30(4):315 -322.
[9] 李红梅,施向东.他克莫司治疗激素抵抗性肾病综合征[J].实用医学杂志,2009,25(22):3871-3873.
[10] 陈伟珍,陈德君,徐光标.他克莫司对特发性膜性肾病的治疗观察[J].实用医学杂志,2009,25(10):1674-1675.
[11] Faul C,Donnelly M,Merscher-Gomez S,et al.The actin cytoskeleton of kidney podocytes is a direct target of the antiproteinuric effect of cyclosporine A[J].Nat Med,2008,14(9):931-938.
