幽门螺杆菌CagL蛋白单克隆抗体的制备与鉴定
2013-05-31朱虹陈珵凌峰邵晨余敏邵世和
朱虹,陈珵,凌峰,邵晨,余敏,邵世和
(江苏大学基础医学与医学技术学院,江苏 镇江 212013)
CagL(cytotoxin-associated gene L)蛋白是幽门螺杆菌(Helicobacter pylori,H.pylori)Ⅳ型分泌系统(typeⅣsecretion system,TFSS)菌毛结构的表面蛋白,桥联TFSS与靶细胞的特异性黏附。CagL蛋白分子上的RGD基序被宿主细胞上的整合素α5β1受体所识别,可激活整合素依赖性的细胞信号转导通路,介导CagA蛋白在胞内定位,启动及稳固CagA的磷酸化,进而导致IL-8水平升高[1]。本实验以CagL蛋白为研究对象,原核表达并制备CagL融合蛋白,以其为抗原免疫BALB/c小鼠;运用细胞融合技术将免疫的脾细胞与小鼠骨髓瘤细胞融合后获得杂交瘤细胞,通过有限稀释法筛选得到3株能够稳定分泌抗CagL蛋白单克隆抗体(monoclonal antibody,mAb)的杂交瘤细胞株,并对其性质进行鉴定。
1 材料与方法
1.1 菌株、质粒和细胞
大肠埃希菌E.coli BL21(DE3),江苏大学基础医学与医学技术学院实验室保存;原核表达载体pET-28a(+)-cagL,本课题组自行制备;H.pylori NCTC11637标准菌株、H.pylori 26695标准菌株,均为中国疾病预防控制中心张建中教授馈赠;H.pylori临床分离株M13,第三军医大学郭军教授馈赠;H.pylori临床分离株来自山东省威海市市立医院送检的两份胃黏膜标本,编号HP-1和HP-2。小鼠骨髓瘤细胞SP2/0购自中国科学院典型培养物保藏委员会细胞库。
1.2 实验动物
SPF级雌性BALB/c小鼠购自扬州大学比较医学中心,免疫接种小鼠为5~7周龄,腹腔积液制备时小鼠8周龄以上。
1.3 主要试剂
IPTG购自TaKaRa公司;Ni2+-NTA亲和层析柱购自Qiagen公司;预染蛋白分子质量标准、ECL化学发光试剂盒购自碧云天生物技术有限公司;RPMI-1640培养基、HAT选择培养基、HT选择培养基及胎牛血清购自Gibco公司;PEG细胞融合剂购自Sigma公司;HRP标记羊抗鼠IgG(H+L)抗体购自北京全式金生物技术有限公司公司;哥伦比亚培养基、微需氧袋购自Oxoid公司;PVDF蛋白免疫印迹反应膜购自Bio-Rad公司;鼠单克隆抗体快速分型试剂盒购自Thermo公司。其他化学试剂均为分析纯,按分子克隆实验指南配制。
1.4 免疫原的制备
幽门螺杆菌CagL蛋白基因工程重组菌(本课题组自行制备)经37℃振摇培养至对数生长期,加IPTG(终浓度1.0 mmol/L)诱导表达4~6 h;收集菌液,超声破菌,离心后收集上清;Ni2+-NTA亲和柱纯化融合蛋白,12%SDS-PAGE电泳并分析目的蛋白的表达情况及其纯度。
1.5 CagL蛋白单克隆抗体的制备
1.5.1 小鼠的免疫 400 μg/mL CagL融合蛋白与等体积完全弗氏佐剂混合乳化,注射于6周龄雌性BALB/c小鼠颈背部皮下,每只0.4 mL;两周后用等体积不完全弗氏佐剂免疫,剂量及途径不变;1周后抗原量降为200 μg/mL进行免疫接种;1周后小鼠腹腔注射100 μg/mL CagL蛋白,每只0.1 mL;3 d后间接ELISA法检测多抗效价,效价达到预期状态时再进行末次尾静脉加强免疫1次,3 d后进行融合。
1.5.2 小鼠骨髓瘤细胞的准备 按照文献[2]方法活体制备小鼠骨髓瘤 SP2/0细胞。将1×106SP2/0细胞接种在6~8周龄正常雌性BALB/c小鼠背部皮下两侧,大约10~15 d后注射部位长出实体瘤,无菌取出实体瘤用于融合实验。
1.5.3 细胞融合及阳性杂交瘤细胞的筛选 将末次加强免疫的小鼠脾细胞与实体瘤SP2/0细胞在PEG的作用下进行融合,融合10 d后筛选阳性杂交瘤细胞,再用有限稀释法经3次亚克隆筛选出能稳定分泌目的蛋白单克隆抗体的杂交瘤细胞株,并扩大培养和及时冻存。
1.6 腹腔积液的制备与纯化
将8周龄雌性BALB/c小鼠腹腔接种灭菌液体石蜡,每只0.3 ~0.5 mL,10 d 后每只小鼠腹腔接种1×106杂交瘤细胞,待腹部膨大后无菌收集腹腔积液,离心获得上清液,-20℃冻存备用。
1.7 CagL蛋白单克隆抗体的鉴定
1.7.1 免疫球蛋白类型鉴定 将待测杂交瘤细胞培养上清经适当比例稀释后,按鼠单克隆抗体快速分型试剂盒说明书进行操作,酶标仪读取D(450 nm)值,D(450 nm)≥0.2为阳性,阳性者即为该mAb的免疫球蛋白类型。
1.7.2 效价测定 采用间接ELISA法测定杂交瘤细胞培养上清及腹腔积液中mAb的效价。1.0 μg/mL CagL蛋白过夜包被;1%BSA封闭;待测培养上清或腹腔积液依次做梯度倍比稀释,每孔100 μL,设置阴性、阳性及空白对照,37℃孵育2 h;洗板后加入工作浓度的酶标二抗,37℃孵育1 h;洗板后加TMB底物显色液,避光37℃孵育10 min,最后加终止液,酶标仪读取D(450 nm)值。以阳性光密度值与阴性光密度值的比值≥2.1时最大稀释倍数为细胞培养上清或腹腔积液中mAb的效价。
1.7.3 非竞争ELISA法测定mAb的相对亲和力用相对亲和常数(Kaff)的大小来表示相对亲和力[3]。CagL 蛋白稀释成 0.25、0.50、1.00、2.00 μg/mL 4个浓度(四者浓度之比为1∶2∶4∶8)过夜包被;1%BSA封闭;将待检单抗进行倍比稀释,每孔100 μL,37℃孵育2 h;其余步骤同前面的间接ELISA法。酶标仪读取D(450 nm)值。以D(450 nm)值为纵坐标,抗体浓度的对数值为横坐标绘制4种浓度的抗原包被条件下单抗的结合反应曲线。根据结合反应曲线中50%D(450 nm)所对应的抗体浓度[Ab]计算 Kaff值,计算公式:Kaff=(n-2)/2 ×(n[Ab']-[Ab]),单位为 L/mol,[Ab'](mol/L)是抗原浓度为[Ag']时50%D(450 nm)值所对应的抗体浓度,[Ab](mol/L)是抗原浓度为[Ag]时50%D(450 nm)值所对应的抗体浓度。
1.7.4 相加ELISA法初步鉴别单抗识别表位的异同[4]每孔包被的CagL蛋白终量为50 ng;包被过夜后1%BSA封闭;稀释待测mAb到各自饱和时的浓度,每一种单抗各自单独加入100 μL/孔,再以两两各50 μL混合加入每孔,注意保持混合后各抗体的饱和浓度;其余步骤同前面的间接ELISA法。酶标仪测得不同的单抗在各自饱和浓度下反应的D(450 nm)值及两两混合反应的D(450 nm)值。再计算加成指数(AI),公式:AI=[2×D1+2/(D1+D2)-1]×100% ,其中D1、D2为不同株的两种抗体各自的D(450 nm)值,D1+2为两者混合的D(450 nm)值。选用50% 为判别标准,当AI>50%时,两种抗体识别两个不同的表位;当 AI<50%时,两者识别相似或相同的表位。
1.7.5 蛋白质印迹法鉴定mAb的特异性 按常规方法进行蛋白质印迹,加样样本为CagL纯化蛋白、诱导表达后E.coli BL21全菌蛋白、两株H.pylori标准菌株的全菌蛋白、3株H.pylori临床株的全菌蛋白,用不含表达载体的E.coli BL21全菌蛋白作为对照。
1.8 冻溶法检测杂交瘤细胞株的稳定性
将分泌单克隆抗体的杂交瘤细胞株在液氮中冻存3个月后复苏、传代,用间接ELISA法检测杂交瘤细胞分泌mAb的效价,并判断其稳定性。
2 结果
2.1 CagL免疫原的表达及鉴定
纯化的CagL蛋白样品SDS-PAGE电泳结果显示,在相对分子质量约为32 000处可见特异性目的条带;Quantity One软件灰度扫描分析表明融合蛋白的纯度达85%以上,见图1。
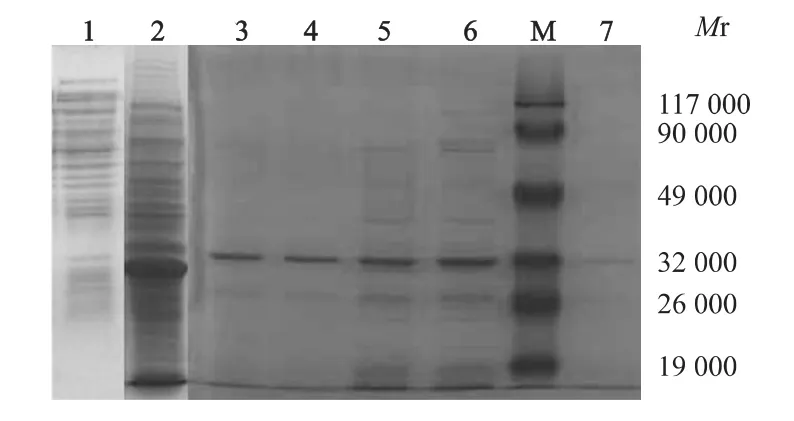
图1 SDS-PAGE电泳分析CagL融合蛋白的表达Fig 1 SDS-PAGE analysis of the expression of CagL fusion protein
2.2 杂交瘤细胞株的建立
经过细胞融合、间接ELISA法的初筛、复检以及3次亚克隆,最终获得了3株能稳定分泌抗CagL蛋白mAb的杂交瘤细胞株,将其命名为HPL-1C9、HPL-2G10和 HPL-3E6。
2.3 单抗免疫球蛋白的类型
3株mAb的免疫球蛋白类别及亚型见表1。
2.4 单克隆抗体的效价
间接ELISA法检测表明3株杂交瘤细胞培养上清的mAb效价均在1∶64~1∶128之间;纯化后腹腔积液型mAb的效价均在1∶16 000以上,见表1。
2.5 相对亲和力
经曲线回归拟合抗体浓度与D(450 nm)的曲线模型,得出50%D(450 nm)对应的抗体浓度,计算出3株mAb的相对亲和常数,见表1。结果表明3株mAb的亲和常数均在109数量级,具有较好的抗原结合能力。
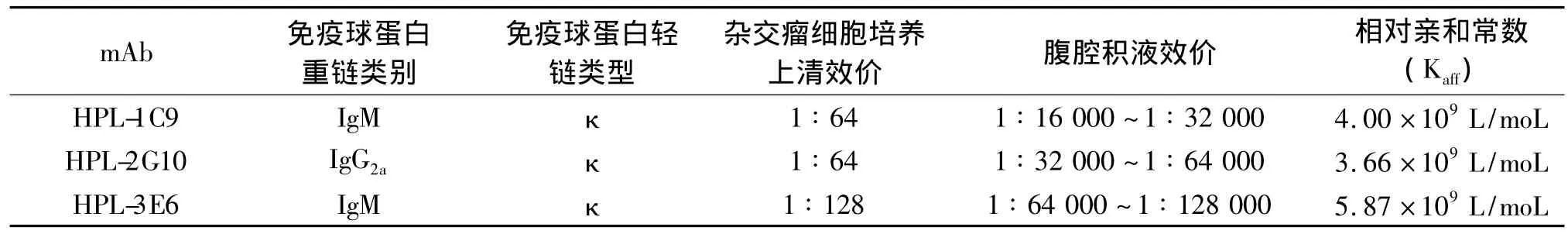
表1 3株单克隆抗体的部分特性Tab 1 Some characterization of three mAbs against CagL
2.6 抗原表位的分析
经相加ELISA法计算得出3株mAb的加成指数,见表 2。HPL-1C9与 HPL-2G10的 AI为72%,HPL-1C9与 HPL-3E6的 AI为 64%,HPL-2G10与HPL-3E6的 AI为52%,均大于50%,表明3株mAb的抗原识别表位各不相似。因此,本实验获得的3株单抗分别属于3种不同的抗原决定簇。
2.7 特异性的鉴定
纯化蛋白、诱导表达后的E.coli BL21(DE3)全菌蛋白、标准菌株H.pylori NCTC 11637及26695的全菌蛋白、H.pylori临床株 M13、Hp-1、Hp-2全菌蛋白的蛋白质印迹法检测结果显示,3株mAb均能与纯化蛋白、诱导后E.coli BL21(DE3)全菌蛋白有特异性结合,在32 000处出现特异性条带(图2);HPL-1C9和HPL-3E6单抗能够与标准株及临床株的全菌蛋白发生特异性结合,在26 000处出现特异性条带(图3),与E.coli BL21(DE3)全菌蛋白对照无特异性结合,但HPL-2G10与标准株及临床株的全菌蛋白未见特异性结合。
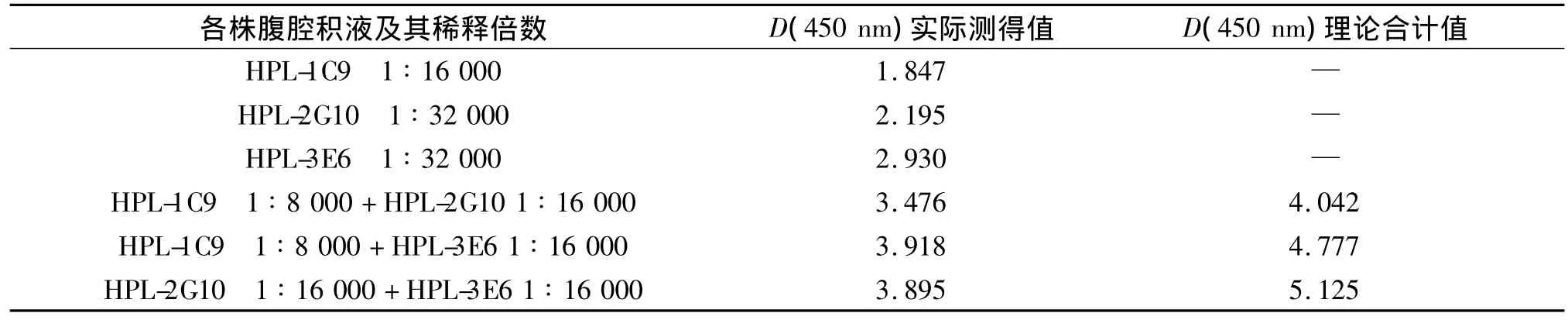
表2 相加ELISA反应结果Tab 2 Absorbance of ELISA additivity test

图2 蛋白质印迹法检测3株mAb与CagL纯化蛋白及诱导后的E.coli BL21(DE3)全菌蛋白Fig 2 Western blotting analysis of three mAbs with the CagL fusion protein and the whole protein extracted from induced E.coli BL21
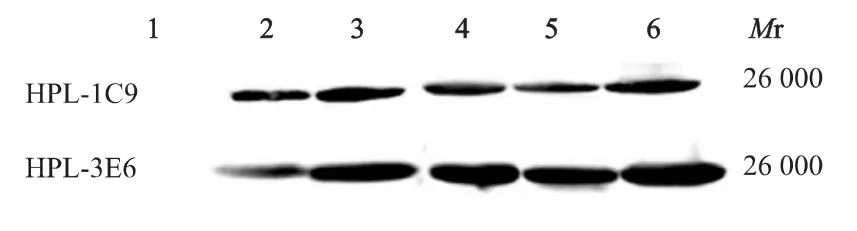
图3 HPL-1C9和HPL-3E6分别与不同H.pylori菌株全菌蛋白的蛋白质印迹Fig 3 Western blotting analysis of mAb of both HPL-1C9(A)and HPL-3E6(B)with the whole protein extracted from different H.pylori strains
2.8 杂交瘤细胞的稳定性
杂交瘤细胞株冻存3个月复苏后体外连续传代,间接ELISA法检测发现细胞培养上清的抗体效价均维持在1∶16左右,表明仍可稳定分泌单克隆抗体。
3 讨论
幽门螺杆菌是一种定植于人胃部的致病菌,全球人口的携带率为50%,其中约10% ~15% 的个体在感染后出现临床症状,且胃黏膜发生不同程度的病理变化,如炎症、溃疡甚至癌变[5]。H.pylori已被证实是慢性萎缩性胃炎、消化道溃疡的主要病因,且与诱生胃腺癌、胃黏膜相关淋巴组织淋巴瘤等的发生密切关联,WHO将其列为Ⅰ类致癌因子[6]。
CagL蛋白是幽门螺杆菌TFSS菌毛结构的表面蛋白,桥联TFSS与靶细胞的特异性黏附,不但能激活整合素依赖的细胞信号通路,还具有与纤维黏连蛋白相似的功能,能直接诱导鼠成纤维细胞形成黏着斑、刺激AGS细胞的扩散。这说明CagL蛋白能够模拟纤维黏连蛋白触发表皮生长因子受体(EGFR)、人表皮生长因子受体3(Her3/ErbB3)及其他相关受体的跨膜信号的异常活化[7]。CagL蛋白与整合素α5β1受体结合后,还能促使去整合素-金属蛋白酶17从α5β1受体上解离下来,从而抑制HKα基因的表达,导致壁细胞无法分泌胃酸[8],感染早期表现为一过性的胃酸分泌减少,随着H.pylori定植面积的扩大及感染时间的延长,黏膜炎症加剧甚至发生癌变。
CagL蛋白分子内除了RGD基序能同宿主细胞联系外,新发现一段有功能的、在空间位置上同RGD基序毗邻的序列——RGD助手序列(RGD helper sequence,RHS)。RHS基序能加强CagL与整合素受体的结合作用,并能与特定的整合素受体结合后启动细胞信号转导通路,因此,推测CagL分子内至少存在两种能与宿主细胞整合素受体结合的基序[9]。
已有实验证实,用体外重组CagL纯化蛋白免疫家兔后获得抗CagL多克隆抗体血清,具有阻断H.pylori对HeLa细胞黏附的作用,并导致促炎因子IL-8的分泌明显减少[10]。另外将H.pylori用不同浓度的CagL多克隆抗体作用后与正常胃黏膜细胞GES-1进行共培养,发现CagA蛋白转运能力受到抑制,且转入胞内的CagA量随抗体量的增加而降低[11]。但CagL抗体中和H.pylori作用的具体机制尚不清楚,推测可能是阻断了CagL同宿主细胞整合素的识别,进而阻碍了TFSS的成熟以及CagA的转运。
本研究将CagL纯化蛋白作为候选抗原制备了鼠源性的抗CagL单克隆抗体,最终获得3株杂交瘤细胞株。鉴定结果表明3株抗体都具有较高的效价以及亲和力,能够特异性结合CagL融合蛋白,其中有两株单抗能够特异性结合标准菌株和临床株的全菌蛋白,而有一株单抗未见特异性结合,其可能的原因在于用可溶性蛋白免疫得到的抗体可能无法识别变性蛋白的线性表位,或原核系统表达的重组蛋白同天然蛋白在构象上存在差异。本研究为进一步了解TFSS的黏附机制及其致病机制,深入探讨CagL抗体的中和作用机制以及抗体对宿主细胞是否具有保护性作用等提供了依据。此外基于CagL抗原性、保守性、表面分布等特征,将抗CagL单克隆抗体作为H.pylori治疗性疫苗以及应用于临床诊断,也有一定的价值。
[1] Kwok T,Zabler D,Urman S,et al.Helicobacter exploits integrin for type IV secretion and kinase activation[J].Nature,2007,449(7164):862 -866.
[2] 李永亮,田美娜,卢曾军,等.应用活体骨髓瘤细胞制备单克隆抗体[J].中国生物工程杂志,2008,28(11):63-66.
[3] Beatty JD,Beatty BG,Vlahos WG.Measurement of monoclonal antibody affinity by non-competitive enzyme immunoassay[J].J Immunol Methods,1987,100(1/2):173-179.
[4] Levieux D,Venien A,Levieux A.Epitopic analysis and quantification of bovine myoglobin with monoclonal antibodies[J].Hybridoma,1995,14(5):435 -442.
[5] Compare D,Rocco A,Nardone G.Risk factors in gastric cancer[J].Eur Rev Med Pharmacol Sci,2010,14(4):302-308.
[6] Kim SS,Ruiz VE,Carroll JD,et al.Helicobacter pylori in the pathogenesis of gastric cancer and gastric lymphoma[J].Cancer Lett,2011,305(2):228 -238.
[7] Tegtmeyer N,Hartig R,Delahay RM,et al.A small fibronectin-mimicking protein from bacteria induces cell spreading and focal adhesion formation[J].J Biol Chem,2010,285(30):23515 -23526.
[8] Saha A,Backert S,Hammond CE,et al.Helicobacter pylori CagL activates ADAM17 to induce repression of the gastric H,K-ATPase alpha subunit[J].Gastroenterology,2010,139(1):239 -248.
[9] Conradi J,Tegtmeyer N,Wozna M,et al.An RGD helper sequence in CagL of Helicobacter pylori assists in interactions with integrins and injection of CagA[J].Front Cell Infect Microbiol,2012,2:70.
[10] 钟情,邹全明,郭刚,等.重组表达幽门螺杆菌致病岛CagL蛋白及其中和抗体初步研究[J].第三军医大学学报,2009,31(2):109-112.
[11] 黄世腾.幽门螺杆菌cag致病岛中cagL基因的鉴定与分析[D].镇江:江苏大学,2010.
