人脂肪间充质干细胞的原代培养及体外成骨成脂诱导分化
2013-05-31闵敏张雪静马红许辉李遇梅
闵敏,张雪静,马红,许辉,李遇梅
(1.江苏大学附属医院皮肤科,江苏 镇江 212001;2.镇江市第二人民医院皮肤科,江苏 镇江 212002)
对于间充质干细胞的研究,最初的对象是骨髓间充质干细胞,并且已经形成了成熟的分离培养方法[1]。但是,近年来,人们逐渐将干细胞的研究重点转向脂肪间充质干细胞(adipose-derived mesenchymal stem cells,ADSCs),因其在组织来源,分离方法等方面显示出优越性[2],现已被广泛应用于科研和临床研究中。人脂肪间充质干细胞是由Zuk等[3]首次从人抽脂手术中分离获得,具有很强的增殖和多向分化能力。在临床研究中,脂肪间充质干细胞在细胞移植及组织工程等方面也有着广泛的应用前景[4]。本实验试图探索高效获得专一性未分化的人脂肪间充质干细胞的方法,并对其生物学特性及分化特性作进一步观察。
1 材料和方法
1.1 临床标本
人脂肪组织来源于10例产科剖宫产手术者的腹部皮下脂肪,年龄23~35岁,平均为30岁,体质量指数22~24 kg/m2。所有产妇健康状况良好,无系统性疾病,术前均签订知情同意书,并经医院伦理委员会通过。
1.2 试剂与仪器
Ⅰ型胶原酶购自美国 Sigma公司。低糖DMEM、高糖 DMEM、胎牛血清购自美国 Gibco公司。噻唑蓝(MTT)购自美国Amersco公司。碘化丙啶(PI)购自美国 BD公司。鼠抗人 CD31-FITC、CD34-PE、CD45-PE、CD29-FITC、CD44-FITC、CD73-FITC购自美国Biosciences公司,鼠抗人CD105-PE、CD166-PE购自美国Biolegend公司。地塞米松、抗坏血酸、β-甘油磷酸钠、吲哚美辛、异丁基甲基黄嘌呤(IBMX)以及胰岛素均购自美国Sigma公司。Trizol购自美国 Invitrogen公司。反转录试剂盒及SYBR-PCR试剂盒购自TaKaRa公司。酶联免疫检测仪为澳大利亚Clinibio公司产品。流式细胞仪为美国BD公司产品。免疫荧光显微镜购自日本Olympus公司。
1.3 实验方法
1.3.1 hADSCs的分离和培养 实验步骤在Zuk等[3]的基础上作了部分调整。无菌条件下获得脂肪组织约15 mL,分离去除脂肪组织表面的结缔组织包膜及血管,剪碎至约1 mm3细小颗粒。加入0.15%Ⅰ型胶原酶于37°C恒温摇床150 r/min消化45 min,期间每隔10 min取出混匀。加入等体积含10%血清低糖DMEM中和Ⅰ型胶原酶活性。200目筛网过滤,去除消化后产生的碎片组织,1 500 r/min离心10 min,去除上层未消化的脂肪组织及油脂,沉淀重悬,PBS洗2遍。用含10%胎牛血清,100 U/mL青霉素,100 μg/mL链霉素的低糖DMEM重悬,以(1~5)×104/cm2接种至六孔板中。放入37°,5%CO2培养箱中培养,48 h后首次换液,之后每3天换液。细胞达80%融合后用0.25%胰酶-0.02%EDTA消化,1∶3传代接种。
1.3.2 细胞生长动力学分析 以第3代、第7代和第10代细胞为标本,制备单细胞悬液,调整密度为4×104个/mL,接种于96孔板。从第2天起,每天固定时间取3孔加入MTT溶液(5 mg/mL)20 μL,置37℃培养箱孵育4 h后吸弃上清液,每孔加入150 μL二甲基亚砜。摇床震荡10 min,用酶联免疫检测仪以490 nm波长检测各孔光密度(D)值。计算均值,以时间为横坐标,光密度值为纵坐标绘制生长曲线。
1.3.3 细胞免疫表型检测 第5代hADSCs胰蛋白酶消化后制成单细胞悬液。将细胞分装于1.5 mL的EP管中,每管100 μL,细胞密度为105/mL,加入荧光标记抗人 CD31-FITC、CD34-PE、CD45-PE、CD29-FITC、CD44-FITC、CD73-FITC、CD105-PE、CD166-PE,以IgG2a–FITC、IgG1-PE为阴性对照。4℃避光孵育30 min,流式细胞仪检测细胞表面抗原。
1.3.4 细胞免疫荧光 用多聚赖氨酸包被玻片,将玻片置于六孔板内,接种细胞。待细胞贴壁后,4%低聚甲醛室温固定30 min,5%牛血清蛋白(BSA)室温封闭 10 min,0.3%TritonX-100 处理 10 min,提高细胞膜的通透性。滴加鼠抗人CD31-FITC、CD34-PE、CD45-PE、CD29-FITC、CD44-FITC、CD73-FITC、CD105-PE、CD166-PE、HLA DR-FITC 共同室温避光孵育30 min,PBS洗涤2遍,DAPI室温染色10 min,PBS洗涤2遍,荧光显微镜观察,拍照。
1.3.5 成脂分化 取第3代hADSCs接种于24孔板,待细胞融合达80%后,改用成脂肪诱导培养基(含高糖 DMEM,10%FBS,1 μmol/L 地塞米松,50 μmol/L 吲哚美辛,0.5 mmol/L IBMX,10 μmol/L 胰岛素)诱导2周,每2天换液1次,对照组加普通培养液。镜下观察细胞形态变化,2周后油红染色鉴定脂滴[5]。
1.3.6 成骨分化 取第3代hADSCs接种于24孔板,待细胞融合达80%后,改用成骨诱导培养基(含高糖 DMEM,10%FBS,1 μmol/L 地塞米松,200 μmol/L 抗坏血酸,10 μmol/L β-甘油磷酸钠[6])诱导4周,每3天换液1次,对照组加普通培养液。镜下观察细胞形态变化,4周后行茜素红S染色鉴定钙结节[7-8]。
1.3.7 RT-PCR检测过氧化物酶体增殖物激活受体γ-2(PPARγ-2)、骨桥蛋白 mRNA的表达 使用Trizol法提取未分化和成脂成骨分化后hADSCs的RNA。将完全RNA作为模板,进行反转录反应。其后按照RT-PCR试剂盒说明书对人骨桥蛋白,PPARγ-2进行扩增。人骨桥蛋白引物序列:上游5'-ACAGGCTGATTCTGGAAGTTCTG-3',下游5'-GGCT TTCGTTGGACTTACTTGG-3';人PPARγ-2引物序列:上游 5'-TGGAATTAGATGACAGCGACTTGG-3',下游5'-CTGGAGCAGCTTGGCAAACA-3'。人 β-肌 动 蛋白:上游5'-TGGCACCCAGCACAATGAA-3',下游5'-CTAAGTCATAGTCCGCCTAGAAGCA-3'。
1.4 统计学分析
(2)分散土筑堤破坏主要是由降雨冲刷、径流淘刷等方式侵蚀堤防土料,利用堤体内部缺陷,形成裂缝,表现为流土冲蚀、管涌、崩岸等破坏型式,进而造成溃坝危害。
2 结果
2.1 hADSCs生长情况
分离培养 hADSC接种于六孔板,48 h后贴壁,换液去除非贴壁细胞;3 d后倒置显微镜下可见细胞形态改变较均一,成纤维细胞样生长。细胞生长有极性,融合后成螺旋状,第1次7~10天可以传代。1∶3传代,5~7天可融合。培养12代以内细胞的形态无明显变化(图1)。
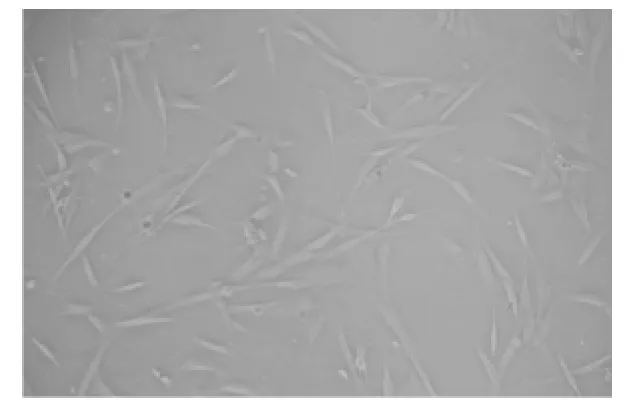
图1 第3代人脂肪间充质干细胞形态(倒置显微镜×100)Fig 1 Cellular morphology of the third generation hADSCs
2.2 细胞生长曲线
生长曲线显示不同代数hADSCs之间的增殖情况无明显差异,在6~7 d时可以达到一个生长高峰(图2),表明体外培养的hADSCs具有强大的增殖能力。

图2 人脂肪间充质干细胞生长曲线Fig 2 Human adipose derived stem cells growth curve
2.3 细胞免疫表型
由于至今尚未发现间充质干细胞特异性的表面标志,通过鉴定多个表面标志物来鉴定hADSCs,包括黏附分子 CD29,CD166,间质标志物 CD73,CD105[9]。结果显示 hADSCs 高表达 CD29、CD73、CD105、CD166,阳性率分别为(95.78 ±2.31)%,(96.70 ± 2.81)%,(99.23 ± 0.29)%,(99.01 ±0.11)%,低表达 CD31、CD34、CD45、HLA-DR,阴性率 分 别 为 (0.29 ±0.15)%,(1.67 ±0.31)%,(0.82 ±0.15)%,(0.35 ±0.18)%(图 3)。
2.4 直接免疫荧光
荧光显微镜观察结果显示,带有FITC-CD29,FITC-CD73标记的细胞显示绿色荧光,带有PE-105,PE-166标记的细胞显示红色荧光(图4)。这与流式细胞检测高表达的结果一致。
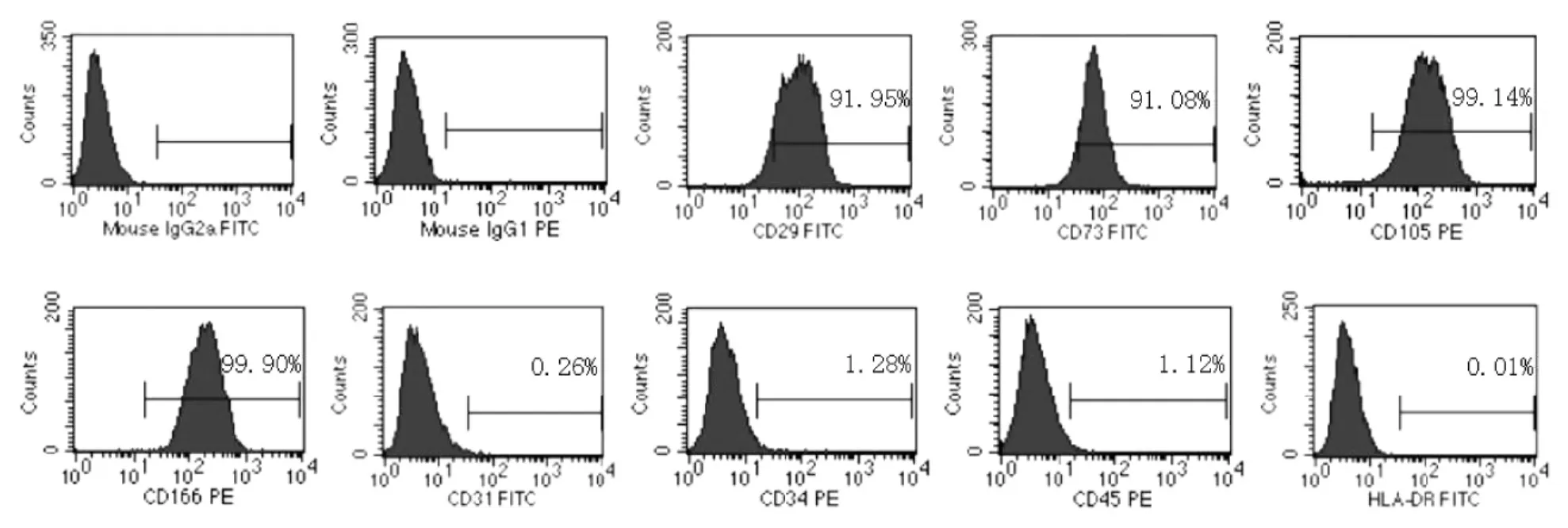
图3 流式细胞术分析人脂肪间充质干细胞免疫表型Fig 3 Flow cytometry analysis of human adipose derived stem cells
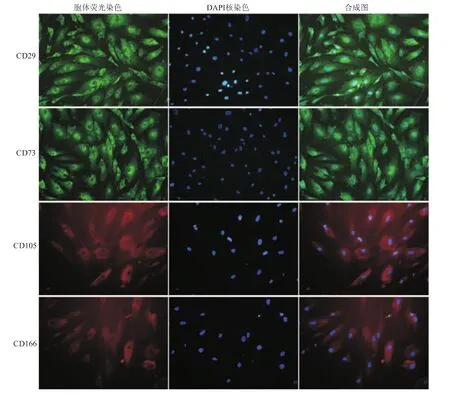
图4 荧光显微镜下的人脂肪间充质干细胞形态(×200)Fig 4 Immunofluorescence images of human adipose derived mesenchymal stem cells
2.5 细胞的分化潜能
2.5.1 成脂诱导分化 对照组细胞形态无明显变化,油红染色未见胞质有明显着色。实验组细胞在成脂诱导剂的作用下,3 d后光镜下可见细胞由长梭形变为类圆形,此后细胞质内开始有透亮的脂滴出现,14 d结束诱导时,成脂细胞明显增多,油红染色大多数脂滴阳性,呈鲜红色。见图5。RT-PCR结果显示,hADSCs成脂诱导1周和2周后与对照组相比,PPARγ-2 mRNA 表达量均明显升高(P <0.01),相较于诱导1周组,诱导2周时,PPARγ-2 mRNA水平亦明显增加(P<0.01)(图6a)。
2.5.2 成骨诱导分化 对照组细胞形态无明显改变,诱导过程中未见明显钙沉积。实验组成骨分化时细胞形态改变明显,7 d后细胞形态开始变圆,可以观察到晶莹类似钙结节的物质出现,4周后行茜素红染色可见红色钙结节。见图7。荧光定量PCR结果显示,与对照组相比,成骨诱导2周和4周后,骨桥蛋白mRNA表达增高(P<0.01)(图6b)。在成骨诱导中发现,在一些骨化中心的周围可见脂滴形成,并逐渐增多,相较成脂分化产生的脂滴,成骨过程中出现的脂滴更大,细胞形态更圆,油红染色阳性,对照组油红染色结果阴性。见图8。RT-PCR结果显示,与对照组相比,诱导4周和诱导2周时PPARγ-2 mRNA表达明显增加(P<0.01),诱导4周组PPARγ-2 mRNA表达比诱导2周时进一步增加(P <0.01)(图6c)。
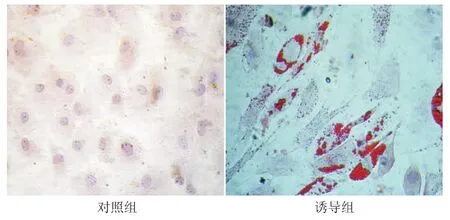
图5 人脂肪间充质干细胞成脂诱导后的形态(油红O染色×200)Fig 5 Cell morphology of human adipose derived mesenchymal stem cells after adipogenic induction(Oil Red O staining×200)
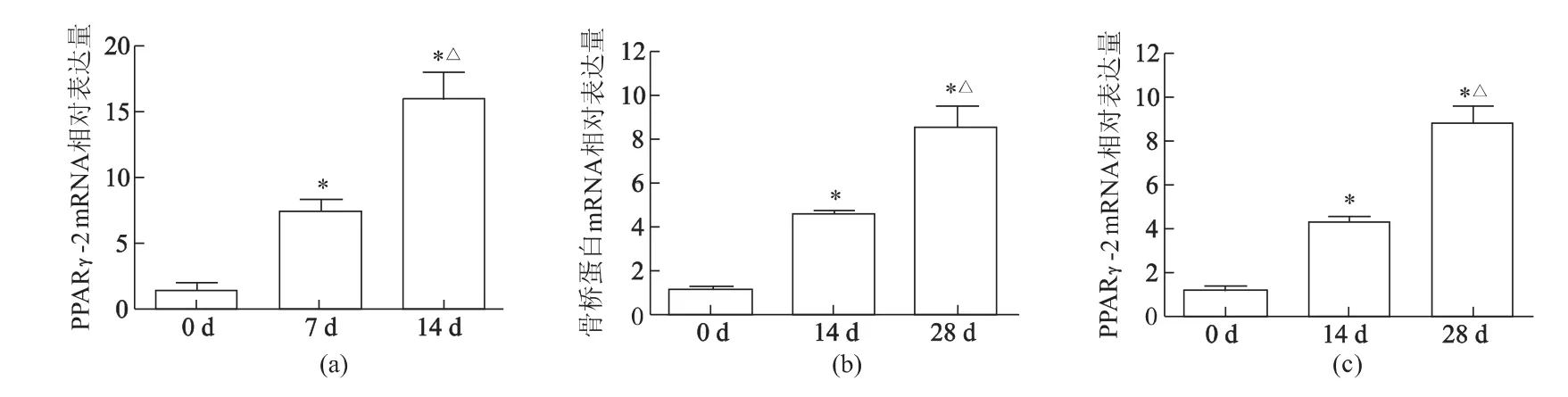
图6 hADSCs在成脂成骨分化过程中基因表达的变化Fig 6 Relative gene expression of human adipose derived mesenchymal stem cells during adipogenic induction and osteogenic induction
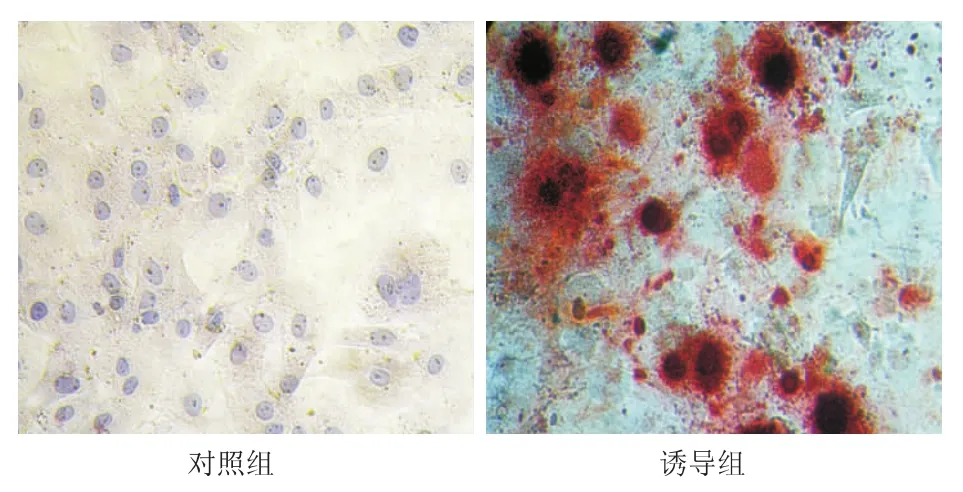
图7 人脂肪间充质干细胞成骨诱导后的形态(茜素红染色×200)Fig 7 Cell morphology of human adipose derived mesenchymal stem cells after osteogenic induction(alizarin red staining×200)
3 讨论
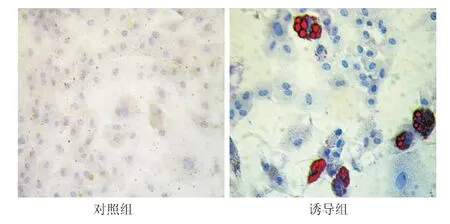
图8 成骨诱导对人脂肪间充质干细胞形态的影响(油红O染色×200)Fig 8 The effect of osteogenic induction on cell morphology of human adipose derived mesenchymal stem cells(Oil Red O staining×200)
种子细胞已经成为组织工程的一个关键因素。近年来,越来越多的报道显示,hADSCs避免了伦理学限制和移植排斥等问题,且在体外具有高扩增及多向分化能力[10]。这符合 2003 年 Gimble[11]提出的干细胞应用于临床所需遵守的规则。因为这些优势,hADSCs具有广泛的应用前景。自从Zuk等首次从脂肪组织中分离出hADSCs以来[3],出现了许多hADSCs分离培养方法,但hADSCs的分离纯化及鉴定一直是一个难题,同时对其的鉴定方法至今尚未充分建立。因此,高效分离培养及鉴定hADSCs方法的建立显得十分有价值。
本实验通过胶原酶消化及贴壁筛选,建立了一种简单高效的分离培养hADSCs的方法。结果显示,适当提高胶原酶浓度有助于纤维结缔组织与脂肪组织的分离,能提高原代细胞的收获数量及纯度。此外,原代培养hADSCs的脂肪来源十分重要。与内脏脂肪相比,皮下脂肪分离获得hADSC的成功率更高。原代培养的hADSCs在体外,直到12代均保持较强的增殖及多向分化能力。
我们通过多种细胞表面标志的测定,获得了纯度较高的hADSCs。这些数据排除了造血细胞、内皮细胞污染的可能。同时,hADSCs低表达HLA-DR,提示hADSCs可以通过主要组织相容性复合体限制性应用于临床[10]。另外,hADSCs的表型在体外经过多次传代并无明显改变,提示hADSCs在体外扩增时具有稳定性。
本研究还显示,hADSCs具有典型的间充质干细胞特性:可向骨细胞、脂肪细胞分化。在成骨分化过程中发现脂滴形成,PPARγ-2 mRNA表达增高,这与Safwani等[12]的近期报道相符。Watters 等[13]在关节炎发病机制的研究中也发现,骨组织再生与脂代谢有关。Boskey等[14]发现,软骨内骨形成开始,其内三酰甘油含量明显增加,故三酰甘油类油脂在矿物化形成过程中可能具有重要的作用。Pfeilschifter等[15]报道,纤维蛋白溶酶激活剂及其抑制剂调节骨组织的形成,而进食脂肪可抑制纤维蛋白溶酶的活性。由此可以推测,在矿物化区域产生的三酰甘油类脂滴可能对纤维蛋白溶酶活性有抑制作用,从而促进hADSCs向成骨细胞分化,参与诱导了体外成骨过程的进行,但其确切机制有待深入研究。
总之,我们建立了一种体外分离培养hADSCs的方法,并对细胞进行了较为全面的鉴定。同时发现,在hADSCs体外成骨分化过程中伴随着成脂的发生,考虑其对成骨具有促进作用。这些结果为hADSCs作为种子细胞被应用于组织工程提供了依据。
[1] Lennon DP,Caplan AI.Isolation of human marrow-derived mesenchymal stem cells[J].Exp Hematol,2006,34(11):1604-1605.
[2] Yoshimura H,Muneta T,Nimura A,et al.Comparison of rat mesenchymal stem cells derived from bone marrow,synovium,periosteum,adipose tissue,and muscle[J].Cell Tissue Res,2007,327(3):449 -462.
[3] Zuk PA,Zhu M,Ashjian P,et al.Human adipose tissue is a source of multipotent stem cells[J].Mol Biol Cell,2002,12(13):4279 -4295.
[4] Barry FP,Murphy JM.Mesenchymal stem cells:clinical applications and biological characterization[J].Int J Biochem Cell Biol,2004,36(4):568 -584.
[5] Strem BM,Hicok KC,Zhu M,et al.Multipotential differentiation of adipose tissue-derived stem cells[J].Keio J Med,2005,54(3):132 -141.
[6] He X,Li YL,Wang XR,et al.Mesenchymal stem cells transduced by PLEGFP-N1 retroviral vector maintain their biological features and differentiation[J].Chin Med J(Engl),2005,118(20):1728 -1734.
[7] Katz AJ,Tholpady A,Tholpady SS,et al.Cell surface and transcriptional characterization of human adipose-derived adherent stromal(hADAS)cells[J].Stem Cells,2005,23(3):412-423.
[8] Zuk PA,Zhu M,Mizuno H,et al.Multilineage cells from human adipose tissue:implications for cell-based therapies[J].Tissue Eng,2001,7(2):211 - 228.
[9] Maddox JR,Liao X,Li F,et al.Effects of culturing on the stability of the putative murine adipose derived stem cells markers[J].Open Stem Cell J,2009,1:54 -61.
[10] Yang XF,He X,He J,et al.High efficient isolation and systematic identification of human adipose-derived mesenchymal stem cells[J].J Biomed Sci,2011,18:59.
[11] Gimble JM.Adipose tissue-derived therapeutics[J].Expert Opin Biol Ther,2003,3(5):705 -713.
[12] Safwani WK,Makpol S,Sathapan S,et al.Alteration of gene expression levels during osteogenic induction of human adipose derived stem cells in long-term culture[J].Cell Tissue Bank,2013,14(2):289 -301.
[13] Watters JW,Cheng C,Pickarski M,et al.Inverse relationship between matrix remodeling and lipid metabolism during osteoarthritis progression in the STR/Ort mouse[J].Arthritis Rheum,2007,56(9):2999 -3009.
[14] Boskey AL,Reddi AH.Changes in lipids during matrix:induced endochondral bone formation[J].Calcif Tissue Int,1983,35(4/5):549 -554.
[15] Pfeilschifter J,Erdmann J,Schmidt W,et al.Differential regulation of plasminogen activator and plasminogen activator inhibitor by osteotropic factors in primary cultures of mature osteoblasts and osteoblast precursors[J].Endocrinology,1990,126(2):703 -711.
