α-硫辛酸对高糖环境下心肌成纤维细胞TGF-β1/Smads信号通路的影响
2013-05-31王国贤刘珊珊李飞李兆刚李瑞芳
王国贤,刘珊珊,李飞,李兆刚,李瑞芳
(辽宁医学院药理教研室,辽宁 锦州 121001)
转化生长因子-β1(transforming growth factor-β1,TGF-β1)是最强有力的致心肌纤维化的细胞因子,正常心脏中TGF-β1含量很低,糖尿病患者在高血糖、氧化应激、炎症等众多因素的刺激下,体内 TGF-β1表达上调,其通过胞内信号分子Smads蛋白转导信号,调控细胞胶原等效应基因表达,诱导心肌成纤维细胞(cardiac fibroblasts,CFb)向肌成纤维细胞分化,刺激胶原、纤维连接蛋白、蛋白多糖等的合成[1-2]。α-硫辛酸(alpha-lipoic acid,α-LA)作为一种强抗氧化剂,能消除氧自由基和超氧基的活性,阻止机体的氧化作用,保护机体细胞。大量研究表明,α-硫辛酸对糖尿病及其并发症有治疗作用,其抗氧化作用已经得到证实[3]。本研究着重探讨α-硫辛酸能否影响高糖环境下心肌成纤维细胞TGF-β1/Smads信号传导途径的表达,进而影响CFb增殖和胶原合成,以进一步探讨这类药物抗心肌纤维化的心脏保护作用。
1 材料与方法
1.1 材料
1.1.1 实验动物 出生2~3 d的清洁级SD乳鼠,由辽宁医学院实验动物中心提供,动物合格证号:SCXK(辽)2003-0007。
1.1.2 药品与试剂 α-硫辛酸纯品由上海现代浦东药厂有限公司提供,溶剂为二甲基亚砜(DMSO),DMSO在细胞培养液中的终体积浓度为0.1%(V/V)。DMEM培养基、血清购自美国Gibco BRL公司;波形蛋白单克隆抗体、即用型SABC免疫组化试剂盒购自博士德公司;MTT试剂购自Sigma公司;ELISAⅠ型胶原试剂盒购自北京博奥森公司。兔抗大鼠TGF-β1、p-Smad2/3、Smad2/3、Smad7和β-肌动蛋白一抗购于Cell Signaling公司,山羊抗兔IgG二抗由辽宁医学院科学实验中心提供。
1.2 方法
1.2.1 CFb的培养和鉴定 无菌条件下开胸,迅速取出心脏,用眼科剪将组织剪成约1 mm×1 mm×1 mm大小的碎块,加入0.08%胰蛋白酶于37℃水浴并在磁力搅拌器上(速率100 r/min)消化细胞,将收集的上清液离心3次,1 000 r/min,10 min,将所得全部细胞置于含10%胎牛血清DMEM培养液的培养瓶中,在37℃,5%CO2培养箱中,采用90 min差速贴壁法去除心肌细胞。待CFb生长接近融合时以1∶2传代。实验采用2~4代CFb。
在倒置显微镜下观察CFb形态;按免疫组化试剂盒说明书,采用SABC法鉴定,所培养的细胞抗波形蛋白抗体阳性、抗α-肌动蛋白单克隆抗体染色阴性,符合成纤维细胞的染色特征,纯度达95%以上。
1.2.2 实验分组和给药 细胞培养24 h后换无血清培养液饥饿24 h,按不同处理分组:正常糖组(加入葡萄糖5.5 mmol/L),高糖组(加入葡萄糖25.5 mmol/L),α-硫辛酸干预组:高糖 +不同浓度α-硫辛酸(100、200、300 μmol/L)。根据预实验确定的刺激浓度,剂量 >300 μmol/L后细胞成活率<95%。
1.2.3 噻唑蓝四氮唑(MTT)比色法检测CFb增殖取对数生长期CFb,0.08%胰蛋白酶消化细胞后,用10%FBS-DMEM培养液调整细胞密度为5×104/mL,接种于 96孔培养板,每孔 200 μL。37℃、5%CO2培养24 h贴壁后,换用无血清的DMEM培养液,继续培养24 h,使CFb处于同步生长休止期。给予α-硫辛酸干预后,再培养48 h,每孔加入15 μL MTT(5 mg/mL),37℃继续培养4 h。终止培养,小心吸弃孔内培养上清液,每孔加入100 μL DMSO,振荡15 min,使结晶物充分溶解,在酶标仪上492 nm处测定各孔的光密度(D)值。
1.2.4 酶联免疫吸附法(ELISA)检测胶原含量细胞37℃、5%CO2培养24 h后,换用无血清的DMEM培养液,继续培养24 h,使CFb处于同步生长休止期。收集培养液上清,并离心。采用双抗体两步夹心ELISA测定CFb中胶原Ⅰ的含量,每组实验设定6个复孔,以空白孔调零,用450 nm波长测量各孔的D值,按照说明书步骤进行操作。
1.2.5 蛋白质印迹检测TGF-β1、p-Smad2/3、Smad2/3、Smad7蛋白含量 37℃、5%CO2培养24 h贴壁后,换用无血清的DMEM培养液,继续培养24 h,使CFb处于同步生长休止期,给予不同浓度的α-硫辛酸刺激48 h后,收集细胞,提取总蛋白并测蛋白浓度。将20 μg蛋白样加入10%的SDS-PAGE凝胶孔中,电泳,转膜,封闭,洗膜,加入1∶1 000稀释的兔抗大鼠 β-肌动蛋白、TGF-β1、p-Smad2/3、Smad2/3、Smad7进行杂交,4℃过夜,用辣根过氧化物酶标记的山羊抗兔IgG杂交,通过ECL化学发光法,将蛋白条带显现于 X胶片上,显影条带经1200Pro型图像扫描仪扫描,CAMIAS008图像分析系统处理。
1.2.6 统计学方法 采用 SPSS 13.0统计软件,计量资料以均数±标准差)表示,多组间比较用单因素方差分析,组间两两比较用 LSD-t法,以P<0.05为差异有统计学意义。
2 结果
2.1 CFb 鉴定
倒置显微镜下观察,培养出的CFb呈梭形或不规则的三角形,胞体较大,胞质淡而几乎透明,中央有卵圆核,胞质向外伸出突起,细胞排列呈放射状,无搏动。生长至汇合状态时发生接触抑制,密集时可形成编织状外观。免疫组织化学染色结果可见细胞中波形蛋白染色呈阳性反应,肌动蛋白免疫组化染色呈阴性反应(细胞质内出现棕黄色颗粒样物质的比例小于10%)。见图1。取5个高倍视野,计数100个细胞中波形蛋白染色阳性细胞所占比例达95%以上。
2.2 α-硫辛酸对高糖环境下CFb增殖的影响
在高糖环境下,细胞给予不同浓度α-硫辛酸刺激24 h后,采用MTT法检测CFb增殖程度。结果表明,与正常糖组比较,高糖组D值显著提高(P<0.01)。加入不同浓度α-硫辛酸后,D值明显低于高糖组,且呈浓度依赖性。见表1。
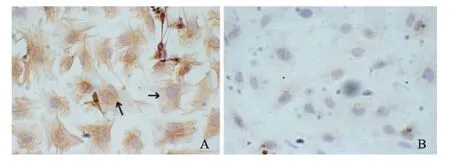
图1 免疫组化染色鉴定CFb(SABC×400)Fig 1 Immunohistochemical study appraisal CFb(SABC×400)
2.3 α-硫辛酸对高糖环境下CFb中Ⅰ型胶原生成的影响
给予不同浓度的α-硫辛酸刺激24 h后,采用ELISA方法检测各组细胞Ⅰ型胶原生成水平。实验显示,与正常糖组相比,高糖组中Ⅰ型胶原的表达量明显增加(P<0.01);加入不同浓度α-硫辛酸后,Ⅰ型胶原的生成水平均明显低于高糖组,差异有统计学意义(P<0.05),且呈浓度依赖性,见表1。
表1 α-硫辛酸对高糖环境下CFb增殖及胶原合成的影响 ,n=6Tab 1 Effect of alpha lipoic acid on CFb proliferation and collagen synthesis in high sugar impact
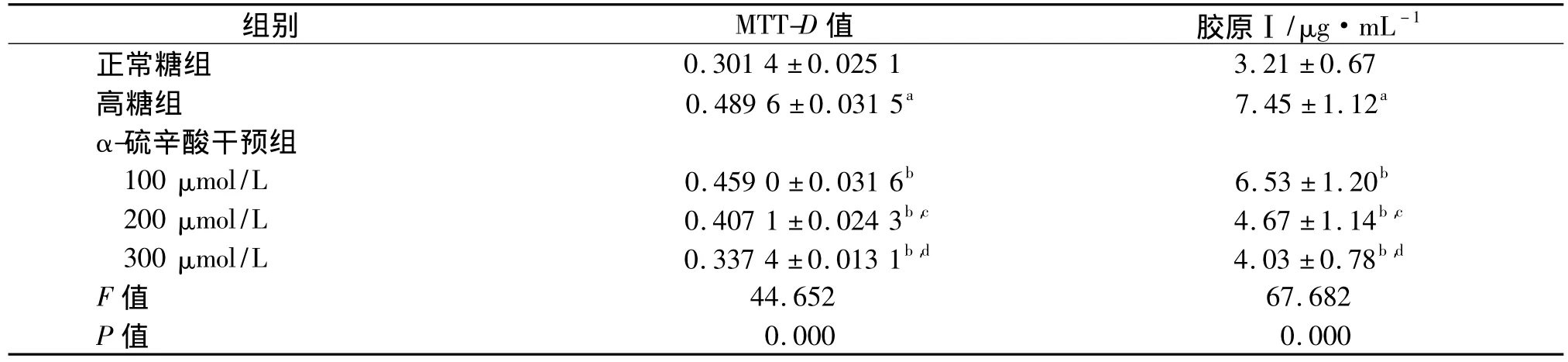
表1 α-硫辛酸对高糖环境下CFb增殖及胶原合成的影响 ,n=6Tab 1 Effect of alpha lipoic acid on CFb proliferation and collagen synthesis in high sugar impact
与正常糖组比较,a:P <0.01;与高糖组比较,b:P <0.05;与100 μmol/L 比较,c:P <0.05;与 200 μmol/L 比较,d:P <0.05
组别 MTT-D值 胶原Ⅰ/μg·mL -1正常糖组0.000 0.000 0.301 4 ±0.025 1 3.21 ±0.67高糖组 0.489 6 ±0.031 5a 7.45 ±1.12a α-硫辛酸干预组100 μmol/L 0.459 0 ±0.031 6b 6.53 ±1.20b 200 μmol/L 0.407 1 ±0.024 3b,c 4.67 ±1.14b,c 300 μmol/L 0.337 4 ±0.013 1b,d 4.03 ±0.78b,d F 值 44.652 67.682 P值
2.4 α-硫辛酸对CFb中TGF-β1、p-Smad2/3、Smad2/3、Smad7蛋白表达的影响
蛋白质印迹结果显示,与正常糖组比较,高糖组心肌成纤维细胞中 TGF-β1、p-Smad2/3、Smad2/3 蛋白表达增加,Smad7蛋白表达减少,P均<0.01;用不同浓度 α-硫辛酸作用 24 h后,细胞中 TGF-β1、p-Smad2/3、Smad2/3蛋白表达显著降低,Smad7蛋白表达升高。见表2、图2。
表2 α-硫辛酸对CFb中 TGF-β、p-Smad2/3、Smad2/3、Smad7蛋白表达的影响,n=6Tab 2 Effect of alpha lipoic acid on protein expression of TGF-β,p-Smad2/3,Smad2/3,Smad7 in the CFb

表2 α-硫辛酸对CFb中 TGF-β、p-Smad2/3、Smad2/3、Smad7蛋白表达的影响,n=6Tab 2 Effect of alpha lipoic acid on protein expression of TGF-β,p-Smad2/3,Smad2/3,Smad7 in the CFb
与正常糖组比较,a:P <0.01;与高糖组比较,b:P <0.05;与100 μmol/L 比较,c:P <0.05;与 200 μmol/L 比较,d:P <0.05
Smad2/3 p-Smad2/3 Smad7正常糖组 0.48 ±0.036 0.46 ±0.023 0.29 ±0.032 0.56 ±0.024组别 TGF-β1高糖组 0.87 ±0.051a 0.76 ±0.034a 0.81 ±0.043a 0.31 ±0.032a α-硫辛酸干预组100 μmol/L 0.81 ±0.034b 0.68 ±0.022b 0.64 ±0.038b 0.36 ±0.043b 200 μmol/L 0.68 ±0.044b,c 0.66 ±0.035b,c 0.52 ±0.021b,c 0.40 ±0.025b,c 300 μmol/L 0.56 ±0.036b,d 0.61 ± 0.043b,d 0.46 ±0.31b,d 0.47 ±0.052b,d F 值 43.184 56.256 62.142 45.154 P值0.000 0.000 0.000 0.000
3 讨论
心肌纤维化又称心脏胶原网络重构,其核心环节是胶原合成增多而降解减少,造成胶原成分在心肌间质过度沉积[4]。心肌间质网络主要是由 I型和Ⅲ型胶原纤维组成,其中I型胶原蛋白占总量的80%以上,糖尿病心肌病时,心肌Ⅰ、Ⅲ型胶原表达增多,各型胶原比例失调、排列紊乱,使心肌纤维增粗,心肌供血障碍,心肌僵硬度增加,心室顺应性下降,最终致心室收缩及舒张功能不全[5]。CFb是诱发心肌间质纤维化的主要细胞,约占心脏非心肌细胞90% ~95%,Ⅰ、Ⅲ型胶原主要由CFb合成分泌,因此它对维持心脏的结构和功能起着不可忽视的作用[6]。
TGF-β1是最强有力的致心肌纤维化的细胞因子,在糖尿病患者中,高血糖诱导的氧化应激可上调TGF-β1表达,进一步诱导CFb增殖,促进胶原合成,抑制胶原降解,加剧心肌纤维化的发生和发展[7]。本研究结果显示,高糖组心肌成纤维细胞TGF-β1蛋白表达水平显著高于正常糖组,说明糖尿病心肌纤维化可能与TGF-β1过度表达有关。经不同浓度α-硫辛酸干预后 TGF-β1表达显著减少,说明 α-硫辛酸可降低糖尿病心肌病中 TGF-β1的表达,从而缓解糖尿病心肌病的发生与发展。
Smad蛋白是作为TGF-β1家族的下游信号分子,是 TGF-β1唯一的底物。有研究显示,糖尿病心肌病大鼠心脏Smad3表达明显增加,而 Smad7表达减少,提示 TGF-β1可能参与了心肌纤维化的形成,并且与 Smad3和 Smad7表达失衡有关[8]。在多种相关因素的刺激下,TGF-β1首先与细胞膜上的TGF-β受体Ⅱ结合,活化后的TGF-β受体I直接磷酸化Smad2和Smad3,并与Smad4形成异源寡聚体复合物,Smad复合物随即转移到细胞核内与特异的DNA结合蛋白结合,调节相应靶基因转录[9]。其中,Smad7为抑制性 Smads蛋白(I-Smads),被认为是TGF-β1信号转导通路上最重要的负性调节因子之一,可与 Smad2、Smad3 竞争性结合 TGF-β1,阻止Smad2、Smad3磷酸化而阻断 TGF-β1信号向下传导[10-11]。实验结果显示,与正常糖组相比,高糖组中p-Smad 2/3蛋白表达增高,而Smad 7蛋白表达减低,提示Smad2/3可能参与了糖尿病心肌病心肌纤维化的发生发展过程,而Smad7通过对 TGF-β1信号转导通路的负反馈调节,使TGF-β1表达减少,从而起到对糖尿病心肌病的保护作用。α-硫辛酸作为一种强抗氧化剂,可清除活性氧自由基,再生谷胱甘肽,广泛用于治疗多种和氧化应激相关的疾病,它在改善糖尿病血管并发症方面的作用备受关注[12]。实验显示,经不同浓度α-硫辛酸干预后,CFb增殖及Ⅰ型胶原含量显著降低,Smad7蛋白表达明显上调,p-Smad 2/3、Smad 2/3表达下调,且有浓度依赖趋势,表明α-硫辛酸可影响 TGF-β1的细胞内信号转导,通过下调 TGF-β1、p-Smad 2/3、mad 2/3 表达、上调 Smad7表达,抑制CFb增殖及胶原生成,减轻心肌纤维化,进而对糖尿病时心肌组织起到保护作用。
[1] Ruiz-Ortega M,Rodriguez-Vita J,Sanchez-Lopez E,et al.TGF-beta signaling in vascular fibrosis[J].Cardiovasc Res,2007,74(2):196 -206.
[2] Ramm GA,Carr SC,Bridle KR,et al.Morphology of live repair following cholestatic live injury:resolution of ductal hyperplasia,matrix deposition and regression of myofibroblasts[J].Liver,2000,20(5):387 -396.
[3] 李春君,张秋梅,于德民.α-硫辛酸减弱线粒体氧化应激保护糖尿病心肌病的机制研究[J].中国糖尿病杂志,2009,9(10):135 -138.
[4] 赵晓燕,赵连友.转化生长因子β1/Smad通路调控糜酶诱导心脏成纤维细胞胶原合成[J].中华高血压杂志,2009,17(8):743 -747.
[5] Bell DS.Diabetic cardiomyopathy[J].Diabetes Care,2003,26(10):2949 -2951.
[6] 张琳,周丽诺,沈稚舟,等.成纤维细胞在糖尿病心肌纤维化病变中的作用[J].复旦学报:医学版,2002,29(5):399 -402.
[7] 张晓敏,何继瑞.TGF-β1/Smads信号通路与糖尿病心肌纤维化[J].医学综述,2012,18(11):1644-1646.
[8] 李龙英,肖谦,高原,等.Smad3,Smad7在糖尿病大鼠心肌组织的表达[J].中国老年学杂志,2009,29(2):132-134.
[9] Tahashi Y,Matsuzaki K,Date M,et al.Differential regulation of TGF-beta signal in hepatic stellate cells between acute and chronic rat liver injury[J].Hepatology,2002,35(1):49-61.
[10] Euler-Taimor G,Heger J.The complex pattern of Smad signaling in the cardiovascular system[J].Cardiovasc Res,2006,69(1):15 -25.
[11] Schneiders D,Heger J,Best P,et al.Smad proteins are involved in apoptosis induction in ventricular cardiomyocytes[J].Cardiovasc Res,2005,67(1):87 - 96.
[12] 康雅萍,王国贤,魏小刚.α-硫辛酸对糖尿病大鼠心肌病保护作用[J].中国公共卫生,2012 ,28(1):48-50.
