Ghrelin在杏仁中央核内对大鼠摄食的调节
2013-05-31朱永香
朱永香 王 倩 王 爽 于 玮 南 瑛 曹 健
(西安医学院生理学教研室,陕西 西安 710021)
Ghrelin是由28个氨基酸残基组成的多肽,具有强烈的促食欲作用。最初发现Ghrelin主要是由胃底泌酸腺的X/A样细胞产生,但后来Cowley等〔1〕报道脑内尤其是下丘脑也能够合成Ghrelin,而其阳性突起在下丘脑以外的脑区也有分布,包括:杏仁中央核(CeA)、终纹床核、内侧杏仁核、杏仁皮质核以及丘脑室旁核等部位。生长激素促分泌素受体(GHS-R)是Ghrelin在中枢神经系统内发挥作用的受体,在中枢神经系统的分布包括下丘脑、脑干以及边缘系统的一些脑区〔2〕。尽管最初并未发现CeA内有GHS-R的存在,但近来有研究用qRT-PCR方法检测到CeA内有GHS-R mRNA存在〔3,4〕。CeA是参与摄食行为调节的核团之一,已有研究证实下丘脑外侧区或室旁核注射Ghrelin激活了CeA内的神经元〔5,6〕。然而,至今并未发现Ghrelin在CeA内对摄食调节作用的研究。本研究应用核团内注射的方法观察了给饱食大鼠CeA内注射Ghrelin对摄食量的影响及对弓状核c-Fos表达的影响;并观察了给隔夜禁食大鼠CeA内注射GHS-R阻断剂D-Lys3-GHRP-6对摄食量的影响,拟探讨外源性及内源性Ghrelin在CeA内对摄食的影响及其可能机制。
1 材料与方法
1.1 动物、试剂及仪器 48只雄性 SD大鼠,体质量220~240 g,由第四军医大学实验动物中心提供,生产许可证:SCXK(陕)2008-002,使用许可证:SYXK(陕)2008-005。大鼠自由摄食饮水,室温22~24℃。多克隆兔抗大鼠c-Fos抗体购自美国Santa Cruz公司,Ghrelin和GHS-R受体阻断剂D-Lys3-GHRP-6均购自美国Sigma公司,SP试剂盒(羊抗兔)及DAB浓缩型试剂盒均购自北京中杉金桥生物技术有限公司。主要仪器有大鼠脑立体定位仪(SN-3)、显微镜(Olympus,BX51)、照相机(Spot Insight,U3.5)及图像分析软件(Image-Pro Plus 6.0)。
1.2 CeA内植入套管 将大鼠腹腔注射水合氯醛(40 mg/kg)麻醉,固定于立体定位仪上,将自制钢套管植入左侧CeA上方1 mm处(根据包新民大鼠脑立体定位图谱:前囟后2.2 mm,向左旁开4.5 mm,硬脑膜下6.5 mm),并用牙科水泥固定。术后恢复8 d,痊愈后实验,状态差者排除实验。
1.3 饱食大鼠CeA内注射Ghrelin后摄食量的观察 将16只术后大鼠随机分为两组,每组8只,自由摄食,分别用微量注射器向CeA内注射(在套管下1.0 mm处持续2 min,停留2 min)生理盐水(对照组)或Ghrelin 0.3 nmol(实验组),分别测量1、2、4 h内大鼠的摄食量。
1.4 饱食大鼠CeA内注射Ghrelin后弓状核内c-Fos表达的观察 将16只手术后大鼠随机分为对照组和实验组,每组8只并自由摄食,分别用微量注射器向CeA内注射生理盐水(对照组)或Ghrelin 0.3 nmol(实验组),2 h后灌流固定,断颅取脑固定后,做冰冻冠状切片,片厚40μm。SP免疫组织化学染色检测弓状核内c-Fos蛋白的表达。细胞核内出现棕黄色颗粒为阳性表达。在400倍光镜下,选取有弓状核的连续5张切片,并选取同一区域拍照,应用IPP6.0软件分析FOS阳性细胞数。
1.5 隔夜禁食大鼠CeA内注射GHS-R阻断剂后摄食量的观察 将16只手术后大鼠随机分为2组,每组8只,隔夜禁食后,分别用微量注射器向CeA内注射生理盐水(对照组)或GHS-R阻断剂D-Lys3-GHRP-6 200 nmol(实验组)后,测量1、2及4 h内大鼠的摄食量。
1.6 套管位置鉴定 实验结束后用20%乌拉坦(1 mg/kg)腹腔注射麻醉,CeA内注入旁胺天蓝0.5μl,灌流固定,开颅取脑,置入10%甲醛中后固定。24 h后做连续冰冻冠状切片,片厚50μm,光镜下参照大鼠脑定位图谱对套管位置进行定位,排除位置不准确的数据。
1.7 统计学分析 采用SPSS18.0统计学软件分析数据,实验数据采用表示,组间比较采用t检验。
表2 隔夜禁食大鼠CeA内注射GHS-R阻断剂后摄食量的变化,mg,n=8)

表2 隔夜禁食大鼠CeA内注射GHS-R阻断剂后摄食量的变化,mg,n=8)
?
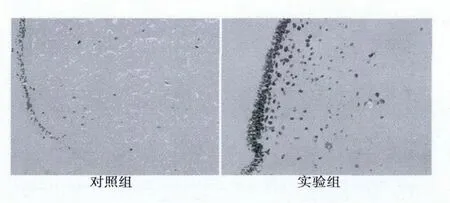
图1 大鼠弓状核内c-Fos免疫组织化学染色结果(SP,×400)
2 结果
2.1 饱食大鼠CeA内注射Ghrelin后摄食量的变化 实验组与对照组比较,1、2、4 h内的摄食量明显增加(P<0.05)。见表1。
表1 CeA内注射Ghrelin后摄食量的变化,mg,n=8)

表1 CeA内注射Ghrelin后摄食量的变化,mg,n=8)
与对照组比较:1)P<0.05;表2同
?
2.2 饱食大鼠CeA内注射Ghrelin后弓状核内c-Fos表达的变化 对照组弓状核内c-Fos免疫反应阳性细胞表达较少,平均值为46.13±9.14,实验组弓状核内c-Fos免疫反应阳性细胞表达较多,平均值为93.88±21.09,与对照组比较差异显著(P<0.05)。见图1。
2.3 隔夜禁食大鼠CeA内注射GHS-R阻断剂后摄食量的变化 实验组与对照组相比,1、2、4 h内的摄食量明显减少(P<0.05)。见表2。
3 讨论
Ghrelin是GHS-R的内源性配体,具有强烈的刺激摄食的作用。尽管胃是血液循环中Ghrelin的主要来源,并且外周注射Ghrelin可以产生强烈的摄食反应。然而,中枢神经系统对Ghrelin的摄食调控发挥着至关重要的作用。给大鼠下丘脑的多个核团内如:弓状核、下丘脑外侧区、下丘脑室旁核以及脑干注射Ghrelin均可发动摄食行为;另外,给中脑腹侧被盖区、伏核、海马以及中缝背核注入Ghrelin同样也出现了刺激摄食的作用〔7,8〕。由于Ghrelin突起及其受体GHS-R在CeA内均有存在〔1,3,4〕,并且 CeA 对摄食具有调控作用,可增加进食量,有理由推测Ghrelin在CeA内可能同样参与了摄食调节作用。
当机体处于饥饿状态时,下丘脑内GHS-R mRNA表达上调,血浆中Ghrelin浓度升高,餐后血浆中Ghrelin水平降低。本研究结果提示Ghrelin在CeA内的生物学效应具有促进摄食的作用。但有研究指出给大鼠杏仁基底外侧核注射Ghrelin却使液体食物的摄入量减少〔9〕,其原因可能是CeA和杏仁基底外侧核在摄食调控中起不同的功能,CeA起正调控作用,可增加进食量;杏仁基底外侧核则起负调控作用,可减少摄食量。然而,也有研究显示杏仁核内注射Ghrelin对常规饲料的摄入无明显影响〔10〕,其原因可能是由于Ghrelin注射进入杏仁核不同的亚核,对摄食产生了或增加或降低的影响,综合以后可能作用相互抵消,从而导致摄食没有明显变化。
弓状核是下丘脑调节摄食的主要部位,腹腔、脑室及下丘脑外侧区注射Ghrelin均能够使弓状核内的神经元激活,表明弓状核在Ghrelin的摄食调控中发挥重要作用。本研究给饱食大鼠CeA内注射Ghrelin导致弓状核内c-Fos表达也增多,其原因可能是Ghrelin注射入CeA后与该核团内GHS-R结合,导致CeA内相应的神经元激活,从而间接激活了与CeA有纤维联系的弓状核。前面提及下丘脑室旁核或外侧区注射Ghrelin能够激活CeA内的神经元〔5,6〕,由此推测在CeA与下丘脑参与摄食调节的一些核团之间可能存在复杂的神经环路,使这些核团相互联系共同参与Ghrelin对摄食的调节作用,但仍需进一步证实CeA与下丘脑参与摄食调控的核团之间存在Ghrelin能神经纤维投射。大量研究证实禁食使机体内Ghrelin水平显著提高,从而产生强烈的摄食驱动作用〔11〕。给禁食大鼠脑室注射GHS-R阻断剂抑制了饥饿大鼠的摄食〔12〕,提示内源性Ghrelin在饥饿引起的摄食中具有重要作用。本研究结果提示内源性Ghrelin在CeA内的信号转导可能与摄食调控有关,尤其是与能量不足导致的摄食行为有关。
1 Cowley MA,Smith RG,Diano S,et al.The distribution and mechanism of action of ghrelin in the CNS demonstrates a novel hypothalamic circuit regulating energy homeostasis〔J〕.Neuron,2003;37(4):649-61.
2 Zigman JM,Jones JE,Lee CE,et al.Expression of ghrelin receptor mRNA in the rat and the mouse brain〔J〕.Journal of Comparative Neurology,2006;494(3):528-48.
3 Landgren S,Engel JA,Hyytia P,et al.Expression of the gene encoding the ghrelin receptor in rats selected for differential alcohol preference〔J〕.Behav Brain Res,2011;221(1):182-8.
4 Cruz MT,Herman MA,Cote DM,et al.Ghrelin increases GABAergic transmission and interacts with ethanol actions in the rat central nucleus of the amygdala〔J〕.Neuropsychopharmacology,2013;38(2):364-75.
5 Olszewski PK,Li D,Grace MK,et al.Neural basis of orexigenic effects of ghrelin acting within lateral hypothalamus〔J〕.Peptides,2003;24(4):597-602.
6 Olszewski PK,Grace MK,Billington CJ,et al.Hypothalamic paraventricular injections of ghrelin:effect on feeding and c-Fos immunoreac-tivity〔J〕.Peptides,2003;24(6):919-23.
7 Egecioglu E,Jerlhag E,Salome N,et al.Ghrelin increases intake of rewarding food in rodents〔J〕.Addict Biol,2010;15(3):304-11.
8 Skibicka KP,Hansson C,Egecioglu E,et al.Role of ghrelin in food reward:impact of ghrelin on sucrose self-administration and mesolimbic dopamine and acetylcholine receptor gene expression〔J〕.Addict Biol,2012;17(1):95-107.
9 Toth K,Laszlo K,Bagi EE,et al.Effects of intraamygdaloid microinjections of acylated-ghrelin on liquid food intake of rats〔J〕.Brain Res Bull,2008;77(2-3):105-11.
10 Carlini VP,Varas MM,Cragnolini AB,et al.Differential role of the hippocampus,amygdala,and dorsal raphe nucleus in regulating feeding,memory,and anxiety-like behavioral responses to ghrelin〔J〕.Biochem Biophys Res Commun,2004;313(3):635-41.
11 Skibicka KP,Dickson SL.Ghrelin and food reward:the story of potential underlying substrates〔J〕.Peptides,2011;32(11):2265-73.
12 Salome N,Haage D,Perrissoud D,et al.Anorexigenic and electrophysiological actions of novel ghrelin receptor(GHS-R1A)antagonists in rats〔J〕.Eur J Pharmacol,2009;612(1-3):167-73.
