液相色谱-串联质谱法测定动物组织中金刚烷胺和金刚乙胺的残留量
2013-05-28陈慧华韦敏珏朱聪英应永飞
陈慧华,韦敏珏,周 炜,朱聪英,应永飞
(浙江省畜产品质量安全检测中心,浙江 杭州 310020)
金刚烷胺(amantadine,AMT)属于三环胺类,又称金刚胺、三环癸胺等,合成于1960年,首先作为抗病毒药使用,主要用于预防亚洲甲型流感病毒的感染,对该型流感接触者保护率为70%,已感染者如能及时用药可减轻症状,且退热作用明显[1-2]。金刚乙胺(rimantadine,RMT)是金刚烷胺类似物,作为抗病毒药对A型流感病毒有预防和治疗作用,主要对A型流感病毒具有活性,且作用强于金刚烷胺,中枢神经副作用小于金刚烷胺[3]。在畜牧养殖上,金刚烷胺类药物主要用于鸡禽流感的预防和早期治疗,以及猪传染性胃肠炎的防治,但是其致精神异常的副反应以及日增的耐药性对畜产品消费者存在较大安全风险[4-5]。美国FDA已明确禁止在畜禽养殖中使用此类药物[6]。我国农业部考虑到金刚烷胺类药物用于动物病毒性疫病不但给动物疫病控制带来不良后果,而且影响国家动物疫病防控政策的实施,在农业部560号公告中已明令禁止金刚烷胺和金刚乙胺等抗病毒药物用于畜禽养殖业[7]。然而,仍有不法分子在养殖环节使用该类药物,最近爆发的“速生鸡”问题更是将这类药物的使用问题推向了风口浪尖,甚至一度造成了消费者的恐慌。
目前,关于该类药物报道较多的是人血浆和药物中金刚烷胺类药物的测定方法,主要包括气相色谱(GC)法[1,3]、液相色谱(LC)法[8-11]、毛细管电泳(CZE)法[12]和液相色谱-串联质谱(LCMS/MS)法[13-16]等。LC-MS/MS法因具有高效分离和集多组分定性、定量于一体等优异性能,成为近年来兽药残留检测方法研究的主要方向[17-18],例如云环等[16]采用 LC-MS/MS法建立了动物源性食品中金刚烷胺的检测方法。本研究将建立金刚烷胺和金刚乙胺的同时检测技术,以有效解决该类药物在鸡肉、鸡肝、猪肉和猪肝等动物源性食品中的检测技术难题,并对样品前处理方法和仪器分析条件进行系统优化。
1 实验部分
1.1 主要仪器
Waters Alliance 2695 液 相 色 谱 仪-Micromass Quattro Micro串联质谱仪:美国 Waters公司产品,配 MassLynx V4.1软件;3k30型冷冻离心机:美国Sigma公司产品;MS3minishaker旋涡混匀器:德国IKA公司产品;XS-205电子天平:瑞士Mettler公司产品;12位水浴型氮吹仪:美国Organomation公司产品;20通道固相萃取装置:美国Waters公司产品。
1.2 主要材料与试剂
盐酸金刚烷胺标准品:购自中国药品生物制品检定所;盐酸金刚乙胺标准品:购自美国药典(USP);乙腈(色谱纯):美国 Merck公司产品;实验用水为Milli-Q超纯水;其它试剂均为分析纯;Oasis MCX 混合阳离子交换柱 (60mg/3mL):美国 Waters公司产品。
取适量标准品,用甲醇溶解后,配制成100mg/L贮备溶液,置于-20℃冰箱中保存。分别吸取适量的贮备溶液(标准溶液),置于同一容量瓶中,用甲醇溶解成1.0mg/L混合标准中间液,置于4℃冰箱中保存。根据需要,吸取适量上述混合标准中间液,添加空白样品洗脱液,氮气吹干后,用V(甲醇)∶V(0.2%甲酸)=10∶90的溶液配制成不同浓度的基质标准系列工作液。
1.3 实验条件
1.3.1 色谱条件 Waters Atlantis dC18色谱柱(150mm×3.0mm×3.0μm),柱温30℃,进样量20μL,流速0.30mL/min,洗脱梯度条件列于表1。
1.3.2 质谱条件 电喷雾离子源(ESI),离子源温度120℃,脱溶剂温度400℃,脱溶剂气和锥孔气均为N2,其中脱溶剂气流速550L/h,锥孔气流速50L/h,光电倍增器电压650V,毛细管电压3.0kV,萃取电压2V。碰撞气为高纯氩气,控制碰撞室压力0.3Pa,多反应监测(MRM)方式。母离子(Q1)/子离子(Q3)离子对均设为单位分辨,各离子对的驻留时间(dwell time)均为100ms,质谱优化条件列于表2。

表1 洗脱梯度条件Table 1 Gradient mobile phase for HPLC
1.4 样品前处理
1.4.1 提取 称取(2±0.02)g绞碎后试样于50mL离心管中,准确加入10mLV(乙腈)∶V(1.0%三氯乙酸)=50∶50的混合溶液进行提取,涡旋混匀2min,置于超声波清洗器中超声提取20min,中间振荡2~3次,取出,以8 000 r/min离心10min,倾出上清液,备用。
1.4.2 净化 取MCX混合阳离子固相萃取柱置于固相萃取装置上,依次用3mL甲醇和3mL水润洗活化,取5mL上清液经MCX柱净化,待近干时再用3mL水和3mL甲醇依次淋洗小柱,挤干后,用5mLV(氨水)∶V(甲醇)=5∶95的溶液洗脱,收集洗脱液,60℃下氮气吹干后,用1mLV(甲醇)∶V(0.2%甲酸)=10∶90的溶液溶解残渣,涡旋30s,经0.22μm滤膜过滤后,上机测定。
表2 MRM监测模式下金刚烷胺和金刚乙胺的质谱优化条件Table 2 MRM optimization conditions of amantadine and rimantadine
2 结果与讨论
2.1 质谱条件的优化
金刚烷胺类药物极性较弱,其烷基部分的结构具有特殊的对称性,难溶于水,因此,临床常使用其水溶的盐酸盐,结构式示于图1。由于该类药物含有氨基,容易得到H+而形成较为稳定的[M+H]+准分子离子,因此选择ESI正离子方式进行监测。
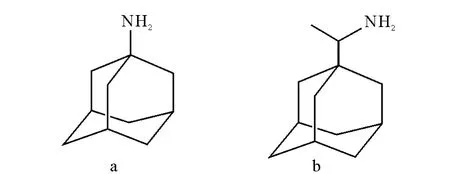
图1 金刚烷胺(a)和金刚乙胺(b)的结构式Fig.1 The structures of amantadine(a)and rimantadine(b)
以V(甲醇)∶V(水)=50∶50的溶液为流动相,采用“T”三通方式,以10μL/min流动注射方式对金刚烷胺和金刚乙胺的质谱条件进行优化,获得药物分子离子诱导产生的特征碎片离子扫描图,确定[M+1]+离子,并优化电离电压、锥孔电压、离子源温度等参数。在此基础上,以子离子扫描方式优化碰撞能量和两对子离子质量数,确定MRM模式监测条件,两种化合物的子离子扫描图示于图2,此时的鉴别点(IPs)能满足欧盟2002/657/EC决议要求[19]。MRM监测模式下,鸡肉基质中金刚烷胺类药物的选择离子监测色谱图示于图3,其添加浓度为10.0 μg/kg。
2.2 液相色谱条件的优化
电喷雾质谱电离是溶液状态电离,因此流动相的组成和配比不但影响目标化合物的色谱行为,还会影响目标化合物的离子化效率,从而影响检测灵敏度,在正离子监测方式下,水相中加入0.2%甲酸溶液有利于化合物的离子化。以目前常用的C18柱作为分离柱,选择 Waters XTerra MS C18柱 (3.0mm×150mm×3.5 μm)、Waters symmetry C18柱(2.1mm×150 mm×3.5μm)和 Waters Atlantis dC18柱(3.0 mm×150mm×3.0μm)研究不同色谱柱的分离效果。实验结果表明,以上3种色谱柱都能将被测药物与杂质较好的分离开,而 Waters Atlantis dC18柱(3.0mm×150mm×3.0μm)的分离效果更佳。
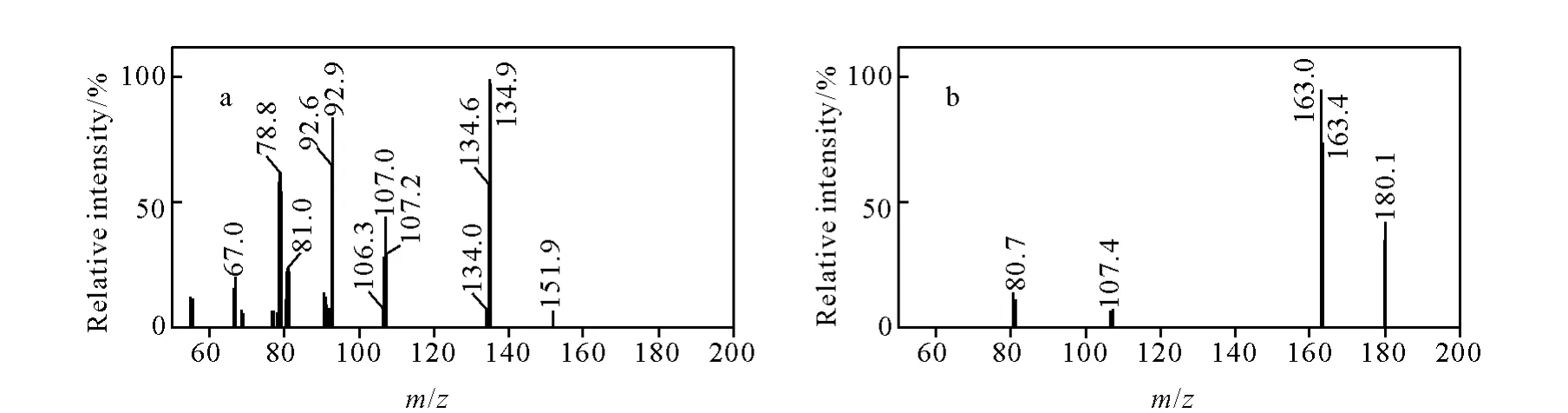
图2 金刚烷胺(a)和金刚乙胺(b)的子离子扫描图Fig.2 Daughter ion scans of amantadine(a)and rimantadine(b)
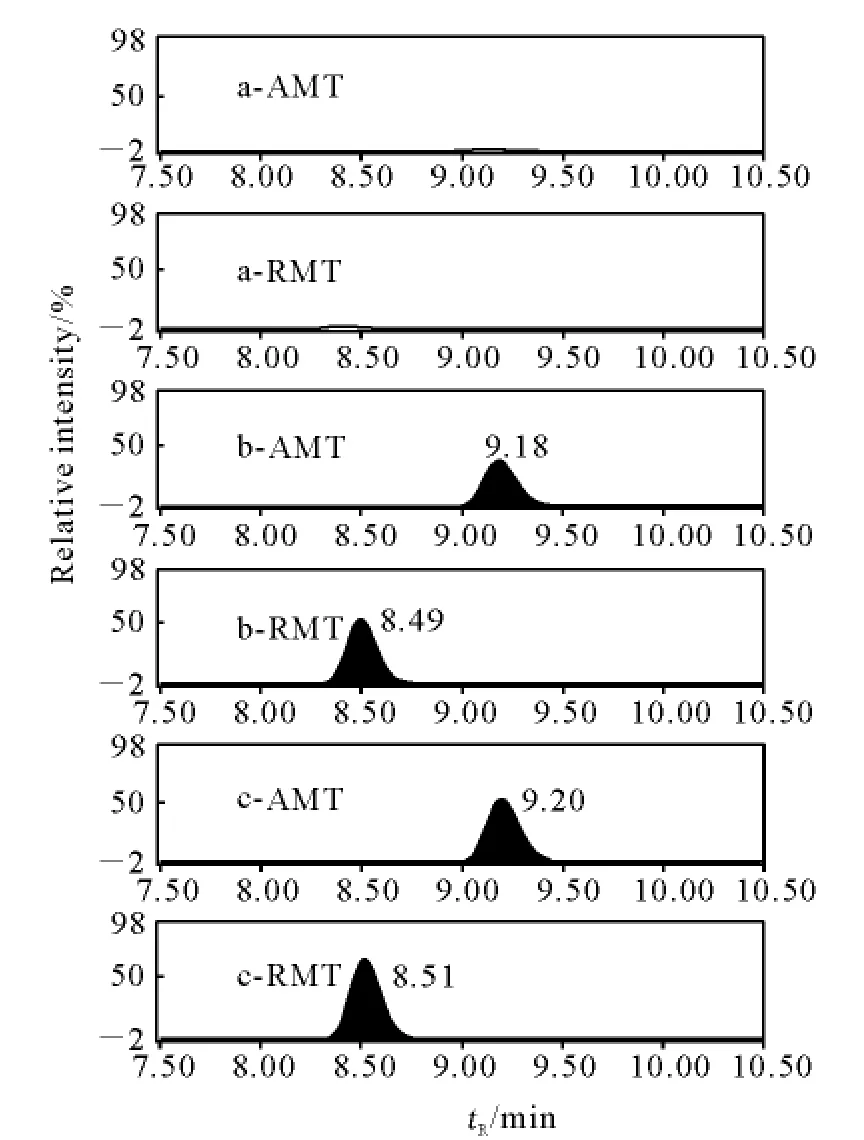
图3 MRM模式下,鸡肉中金刚烷胺和金刚乙胺的选择离子色谱图Fig.3 The selected ion chromatograms of amantadine and rimantadine at spiked chicken muscle in MRM mode
2.3 样品前处理方法的确定
结合金刚烷胺类药物立体对称、末端接氨基的结构,其提取方法可以考虑以甲醇、乙腈以及它们与酸碱溶液配制成一定浓度的混合溶液作为提取剂。本研究参考文献[16],结合1.0%三氯乙酸溶液在调节pH值的基础上还具有沉淀蛋白的作用,选择该溶液与甲醇、乙腈组成适宜浓度的混合溶液作为提取液,比较了不同配比提取液的提取效率,并对提取方法、提取时间等条件进行了研究,确定最佳条件。经过比较发现,采用V(乙腈)∶V(1.0%三氯乙酸)=50∶50的混合溶液作为提取液,对金刚烷胺和金刚乙胺的提取效果总体最佳。
复杂基质中痕量检测进行净化时常采用固相萃取净化方法,由于该类药物含有氨基结构,可以优先考虑采用混合阳离子交换柱进行净化。通过实验比较了 Waters Oasis MCX柱(60mg/3mL)、Agilent Bond Elut Plexa PCX 柱 (60 mg/3mL)和博纳艾杰尔Cleanert PCX(60mg/3mL)3种商品化固相萃取柱,根据各自的性能和厂家提供的方法优化了条件。结果表明,3种小柱作为同时具有反相保留和离子交换行为的净化柱,在净化金刚烷胺和金刚乙胺时具有良好的色谱保留,回收率比较稳定,相对而言Waters Oasis MCX柱效果更佳。因此,选择 Waters Oasis MCX柱作为方法学研究的净化柱。
2.4 方法线性方程和检出限
配制与待测样品相同基质的混合标准系列工作液,使其浓度为0.5、1.0、2.0、5.0、10.0、20.0、100.0μg/L,分别以选定的定量离子峰面积y对浓度x(μg/L)做标准曲线。金刚烷胺类药物在0.5~100.0μg/L浓度范围内呈现良好的线性关系,金刚烷胺、金刚乙胺在鸡肉、鸡肝、猪肉、猪肝基质中的线性方程和相关系数列于表3。采用空白样品中添加目标化合物的方法,按1.4进行处理,以3倍信噪比确定检测限(LOD),以10倍信噪比确定定量限(LOQ),结果列于表3。

表3 金刚烷胺和金刚乙胺的线性方程、相关系数、检测限和定量限Table 3 The linear equations,correlation coefficients(r2),limits of detection(LODs)and limits of quantification(LOQs)of amantadine and rimantadine
2.5 回收率实验
取同一批号的空白鸡肉、鸡肝、猪肉、猪肝样品,加适量混合标准工作液,使加标浓度为1.0~100μg/kg,按1.4方法处理后,按1.3进行仪器分析。每个浓度测定5份样品,求其平均回收率,并计算相对标准偏差,实验结果列于表4。
由表4可知,空白鸡肉、鸡肝、猪肉、猪肝样品中,金刚烷胺类药物的加标浓度为1.0~100 μg/kg时,方法平均回收率在70.7%~92.3%之间,相对标准偏差为1.7%~11.7%,均取得了满意结果,满足了欧盟的有关法规要求[19]。
2.6 样品分析
应用建立的分析方法对48份实验室留存和随机抽取的鸡肉、鸡肝样品进行测定,其中4份样品中检测出金刚烷胺,含量为12.6~90.5 μg/kg;但均未检出金刚乙胺药物残留。
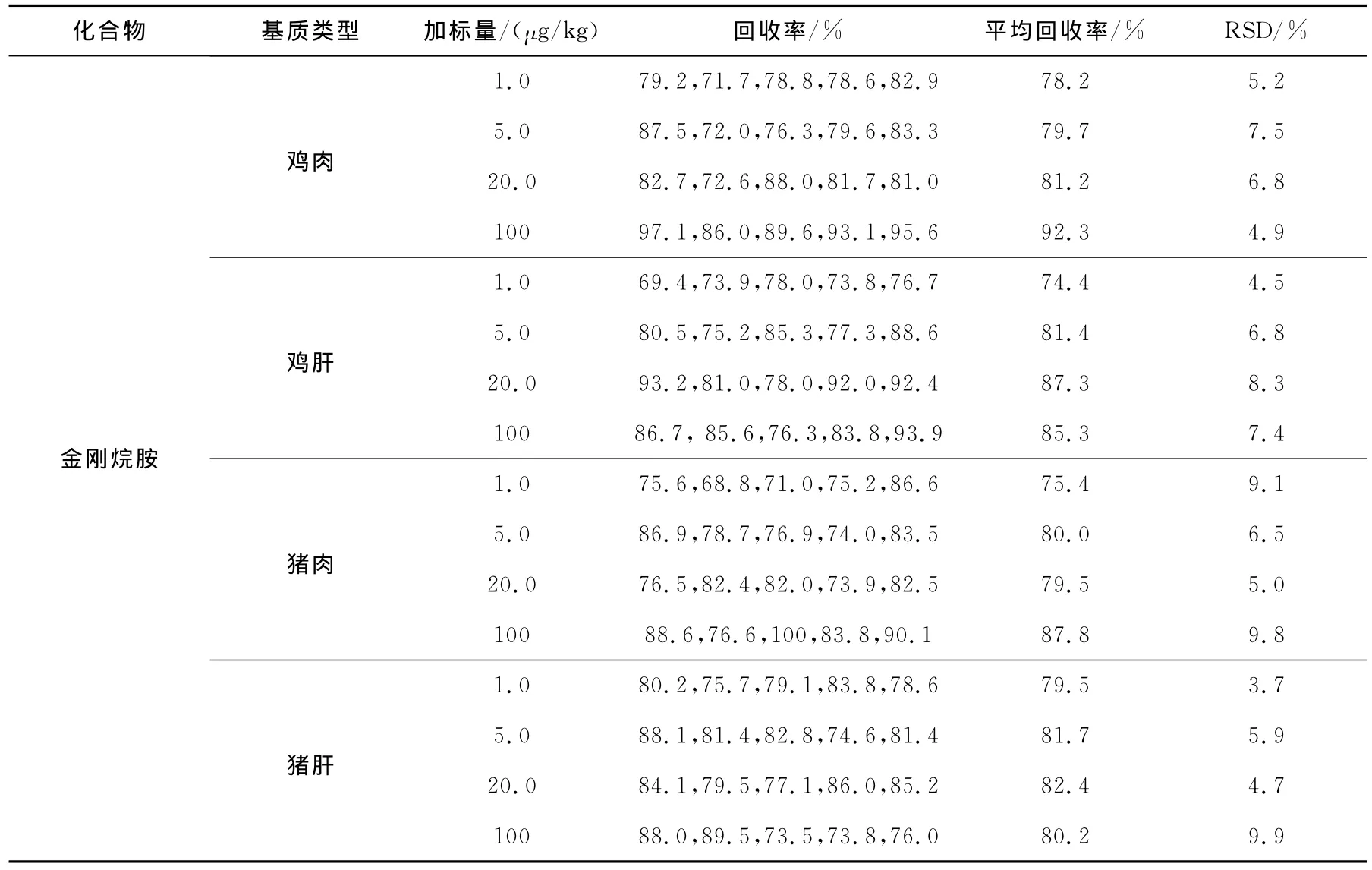
表4 不同基质中回收率实验结果(n=5)Table 4 Results of recovery experiments in different matrix(n=5)
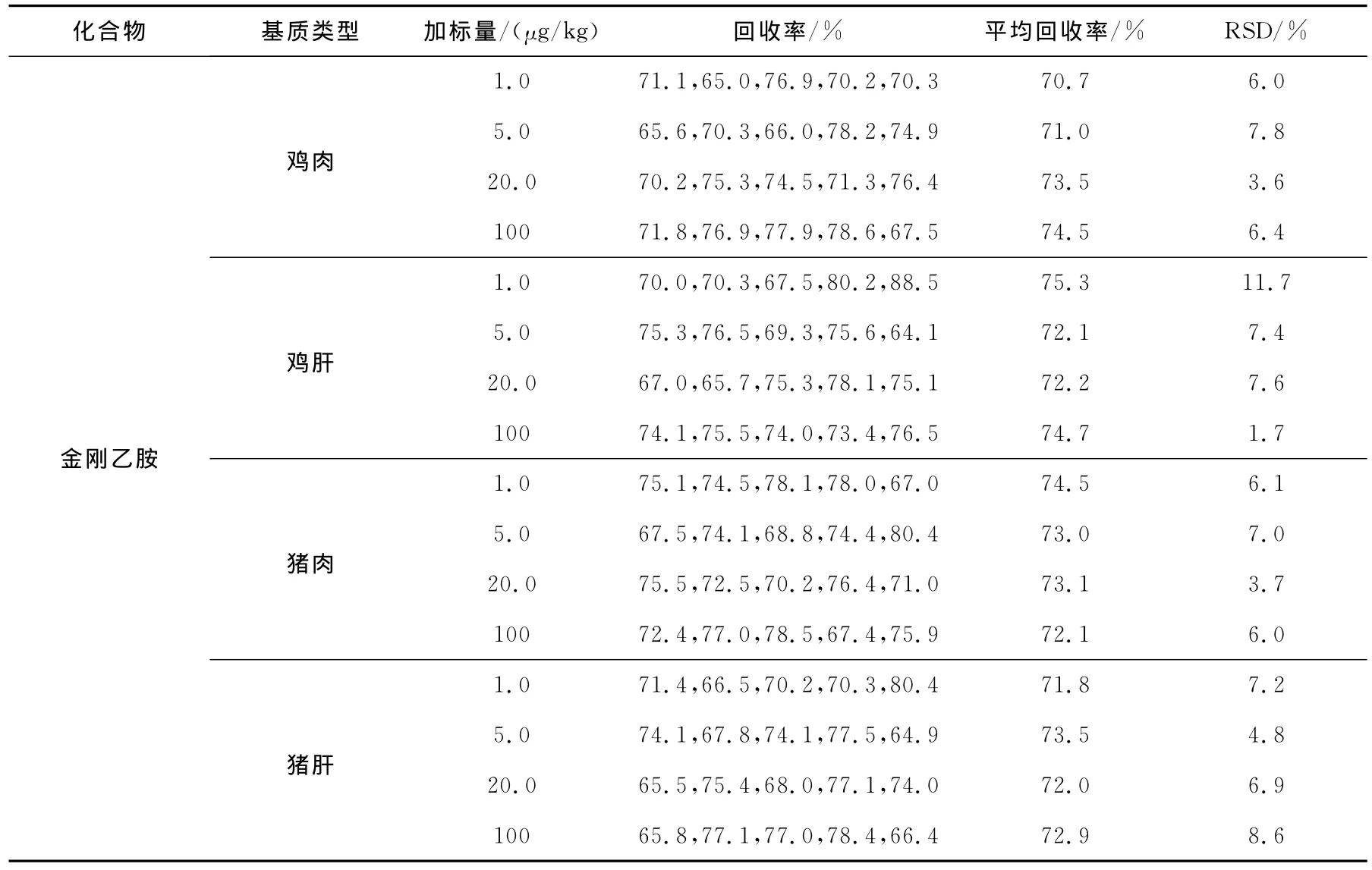
续表
3 结论
本研究建立了液相色谱-串联质谱同时测定动物组织中金刚烷胺和金刚乙胺残留量的方法。在优化提取液pH值及配比、SPE柱类型和过柱条件的基础上,建立了混合阳离子交换柱净化的前处理方法;通过对仪器检测方法的系统研究,确定了液相色谱分离条件和质谱监测最佳条件;在此基础上,建立了操作简便、灵敏度和重复性均较好的LC-MS/MS分析方法。实验结果表明,该方法在鸡肉、鸡肝、猪肉、猪肝等样品中前处理方法易于控制、结果准确、加标回收率稳定、重现性好,适用于动物组织中金刚烷胺和金刚乙胺残留的定性、定量测定,为我国开展相关药物残留检测提供了依据。
[1] ANTOINE S,FRANCOISE P.Gas chromatographic determination of amantadine hydrochloride(symmetrel)in human plasma and urine[J].J Chromatogr B:Biomed Sci and Appl,1980,183(1):33-39.
[2] 李士敏,王 玮.液相色谱-质谱联用法测定大鼠血浆中盐酸金刚烷胺浓度及体内药动学研究[J].药物分析杂志,2007,37(1):66-68.LI Shimin,WANG Wei.LC/MS studies on deter-mination of amantadine hydrochloride in rat plasma and its pharmacokinetics[J].Chinese J Pharma A-nal,2007,37(1):66-68(in Chinese).
[3] 韩加怡,傅红云.毛细管气相色谱法测定复方盐酸金刚乙胺胶囊中的盐酸金刚乙胺[J].色谱,2005,23(6):683.HAN Jiayi,FU Hongyun.Determination of compound rimantadine hydrochloride capsules of rimantadine hydrochloride by capillary gas chromatography[J].Chinese J Chromatogr,2005,23(6):683(in Chinese).
[4] WILLS R J,FAROLINO D A,CHOMA N,et al.Rimantadine pharmacokinetics after single and multiple doses[J].Antimicrobial Agents&Chemotherapy,1987,31(5):826-828.
[5] TOMINACK R L,WILLS R J,GUSTAVSON L E,et al.Multiple-dose pharmacokinetics of rimantadine in elderly adults [J]. Antimicrobial Agents&Chemotherapy,1988,32 (12):1 813-1 819.
[6] U.S.FDA.FDA prohibits use of antiviral drugs in poultry to help keep drugs effective for humans[EB/OL].http://www.fda.gov/NewsEvents/Newsroom/PressAnnouncements/2006/ucm108620.htm.
[7] 中华人民共和国农业部.农业部560号公告 兽药地方标准废止目录[EB/OL].http://www.moa.gov.cn/zwllm/tzgg/gg/200511/t20051117_496523.htm.
[8] 修 虹,黄榕珍,付梅春.HPLC-ELSD法测定复方氨酚烷胺胶囊中盐酸金刚烷胺及对乙酰氨基酚的含量[J].中国药品标准,2006,(1):23-25.XIU Hong,HUANG Rongzhen,FU Meichun.Determination of amantadine hydrochloride and paracetamol in qingke capsules by LC-ELSD[J].Drug Standards of China,2006,(1):23-25(in Chinese).
[9] HIGASHI Y,UEMORI I,FUJII Y.Simultaneous determination of amantadine and rimantadine by HPLC in rat plasma with pre-column derivatization and fluorescence detection for pharmacokinetic studies[J].Biomed Chromatogr,2005,19(9):655-662.
[10] HIGASHI Y,FUJII Y.Simultaneous determination of the binding of amantadine and its analogues to synthetic melanin by liquid chromatography after precolumn derivatization with dansyl chloride[J].J Chromatogr Sci,2005,43(4):213-217.
[11] CUI S J,FENG F,LIU H,et al.New method for high-performance liquid chromatographic determination of amantadine and its analogues in rat plasma[J].J Pharm Biomed Anal,2007,44(5):1 100-1 105.
[12] REVILLA A L,HAMACEK J,LUBAL P,et al.Determination of rimantadine in pharmaceutical preparations by capillary zone electrophoresis with indirect detection or after derivatization[J].Chromatogr,1998,47(7/8):433-439.
[13] TORSTEN A,BRUNHILDE G,AXEL H,et al.Determination of serum amantadine by liquid chromatography-tandem mass spectrometry[J].Clin Chim Acta,2005,359(1/2):125-131.
[14] WANG P,LIANG Y Z,CHEN B M,et al.Quantitative determination of amantadine in human plasma by liquid chromatography – mass spectrometry and the application in a bioequivalence study[J].J Pharm Biomed Anal,2007,43(4):1 519-1 525.
[15] CHAN D,TARBIN J,SHAMAN M,et al.Screening method for the analysis of antiviral drugs in poultry tissues using zwitterionic hydrophilic interaction liquid chromatography/tandem mass spectrometry[J].Anal Chim Acta,2011,700(1/2):194-200.
[16] 云 环,张朝晖,罗生亮,等.固相萃取/LCMS/MS法检测动物源性食品中的金刚烷胺[J].现代仪器,2009,15(6):42-45.YUN Huan,ZHANG Zhaohui,LUO Shengliang,et al.Determination of amantadine residues in food of animal origin by Solid-phase extraction/LC-MS/MS [J]. Modern Instruments,2009,15(6):42-45(in Chinese).
[17] 应永飞,陈慧华,吴平谷.液相色谱-串联质谱在兽药残留分析中的应用[J].分析科学学报,2008,24(3):359-366.YING Yongfei,CHEN Huihua,WU Pinggu.Determination of veterinary drug residues by liquid chromatography and tandem mass spectrometry[J].J Anal Sci,2008,24(3):359-366(in Chinese).
[18] 李俊锁,邱月明,王 超.兽药残留分析[M].上海:上海科学技术出版社,2002.
[19] Commission decision of 12August 2002implementing council directive 96/23/EC,concerning the performance of analytical methods and the interpretation of results(2002/657/EC),2002.
