同位素稀释-固相萃取-超高效液相色谱-串联质谱技术同时测定畜禽肉中四类兽药残留
2013-05-28陈小珍李祖光汪丽娜张晓波
曹 慧,陈小珍,朱 岩,李祖光,汪丽娜,张晓波
(1.浙江省质量检测科学研究院,浙江 杭州 310013;2.浙江大学化学系,浙江 杭州 310028;3.浙江工业大学化学工程与材料学院,浙江 杭州 310014)
兽药在防治细菌等微生物感染性疾病方面起着不可替代的重要作用,主要应用于畜牧业生产、禽类饲养以及渔业养殖。磺胺类、喹诺酮类、硝基咪唑类和青霉素类兽药是常用的抗病菌、抗原虫和抗寄生虫药物,在畜禽养殖业上发挥着重要作用[1]。但不合理使用和滥用兽药以及不遵守休药期等原因致使动物源性食品中兽药残留日趋严重,其产生的危害不容忽视。
目前,关于兽药残留的检测方法主要有微生物法、免疫法[2]、液相色谱法[3-5]、液相色谱-串联质谱法[6-9]和飞 行时间 质谱法[10-11],且集中于单一种类兽药的分析[12],多组分兽药残留的报道很少。由于动物疾病多是混合感染,在临床治疗时往往采用两种或多种不同种类的药物进行联合用药,因此,兽药多残留同时检测是近年研究的新方法[13-16],也是未来的发展趋势。
微生物法和免疫法具有操作简单、快速的优点,但容易产生假阳性。液相色谱法具有分离速度快、分析效率高等优点,由于基质干扰的存在难于准确定性和定量分析。超高效液相色谱-串联质谱(UPLC-MS/MS)是将液相色谱的高分离效能与质谱的高选择性、高灵敏度及丰富的结构信息相结合的分析方法,以其操作简便、准确度高、灵敏度高、选择性强等特点成为兽药残留检测的筛查方法[17-22]。目前,由于兽药在多组分化合物残留和复杂基质条件下进行检测,超高效液相色谱-串联质谱技术的多反应监测模式仍受分辨率和测量精度所限,不可避免产生“假阳性”现象。飞行时间质谱凭借其质量测量精度高的优点,已成为阳性定性确证的有效手段。
本试验采用同位素稀释-固相萃取-超高效液相色谱-串联质谱技术同时测定畜禽肉中磺胺类、喹诺酮类、硝基咪唑类和青霉素类4类兽药残留,并对实际样品进行检测,对筛查出的阳性样品采用液相色谱-离子阱-飞行时间质谱做进一步的确证,避免“假阳性”的发生,以期定性和定量数据更加准确可靠。
1 试验部分
1.1 主要仪器与装置
AcquityTM超高效液相色谱仪和XevoTMTQ-MS质谱仪:美国 Waters公司产品,配有电喷雾电离接口(ESI)及 Masslynx数据处理系统;液相色谱-离子阱-飞行时间串联质谱:日本Shimadzu公司产品;Milli-Q超纯水器:美国Millipore公司产品;高速离心机:美国Thermo公司产品;氮气吹干仪:天津市恒奥科技有限公司产品;涡旋混合器:太仓市华利达实验设备有限公司产品;固相萃取装置:美国Waters公司产品。
1.2 主要材料与试剂
甲醇、乙腈(色谱纯):德国 Merck公司产品;甲酸(色谱纯):美国Tedia公司产品;乙二胺四乙酸二钠盐、磷酸氢二钠、柠檬酸(分析纯):国药集团化学试剂有限公司产品;水为Milli-Q系统纯化水。
磺胺二甲异嘧啶钠(纯度≥99.0%),磺胺醋酰(纯度≥99.5%),磺胺嘧啶(纯度≥99.5%),磺胺噻唑(纯度≥99.5%),磺胺吡啶(纯度≥99.0%),磺胺甲基嘧啶(纯度≥99.2%),甲氧苄胺嘧啶(纯度≥99.5%),磺胺恶唑(纯度≥98.5%),磺胺二甲嘧啶(纯度≥99.0%),磺胺甲噻二唑(纯度≥99.0%),磺胺对甲氧嘧啶(纯度≥98.0%),磺胺甲氧哒嗪(纯度≥99.2%),磺胺-6-甲氧嘧啶钠(纯度≥99.0%),磺胺氯哒嗪(纯度≥99.0%),磺胺邻二甲氧嘧啶(纯度≥99.5%),磺胺甲基异恶唑(纯度≥99.0%),磺胺二甲异恶唑(纯度≥98.0%),苯甲酰磺胺(纯度≥98.8%),磺胺间二甲氧嘧啶(纯度≥99.5%),磺胺喹恶啉(纯度≥98.0%),磺胺苯吡唑(纯度≥99.0%),恩诺沙星(纯度≥98.5%),环丙沙星盐酸盐(纯度≥95.0%),诺氟沙星(纯度≥99.0%),氧氟沙星(纯度≥99.3%),氟甲喹(纯度≥99.4%),恶喹酸(纯度≥98.0%),双氟沙星盐酸盐(纯度≥99.0%),沙拉沙星盐酸盐(纯度≥95.5%),司帕沙星(纯度≥99.9%),氟罗沙星(纯度≥99.0%),马波沙星(纯度≥99.8%),伊诺沙星(纯度≥99.0%),奥比沙星(纯度≥99.7%),吡哌酸(纯度≥99.0%),培氟沙星二水甲磺酸盐(纯度≥99.0%),洛美沙星盐酸盐(纯度≥98.0%),萘啶酸(纯度≥99.5%),甲硝唑(纯度≥99.5%),二甲硝基咪唑(纯度≥99.0%),羟基二甲硝基咪唑(纯度≥99.0%),洛硝哒唑(纯度≥99.0%),异丙硝唑(纯度≥99.0%),羟基异丙硝唑(纯度≥99.0%),羟基甲硝唑(纯度≥99.5%),青霉素G钠盐(纯度≥99.7%),青霉素 V 钾盐(纯度≥99.0%),氨苄西林(纯度≥99.5%),哌拉西林钠盐(纯度≥95.0%),苯唑西林(纯度≥99.8%),萘夫西林钠(纯度≥86.0%),氯唑西林钠水合物(纯度≥99.0%),双氯西林(纯度≥97.0%),恩诺沙星-D5盐酸盐(纯度≥97.0%),磺胺间二甲氧嘧啶-D6(纯度≥99.5%),青霉素 G-D7钠盐(纯度≥99.7%),羟 基 二 甲 硝 基 咪 唑-D3(纯 度 ≥99.0%),二甲硝基咪唑-D3(纯度≥99.0%),羟基异丙硝唑-D3(纯度≥99.5%):以上各标准品购于德国Dr.Ehrenstorfer GmbH公司。
标准溶液的配制:分别准确称取10mg上述标准品(需折算标准品纯度)于10mL容量瓶中,用甲醇定容,配制成1g/L储备液,密封储存于-18℃冰箱中。分别吸取50μL配制好的标准溶液于10mL容量瓶中,用甲醇定容,配制成5mg/L混合标准溶液,用时稀释成一系列浓度的标准溶液,待测。
内标溶液的配制:方法同标准溶液的配制。其中磺胺类药物、喹诺酮类药物、青霉素类药物、甲硝唑羟基甲硝唑和二甲硝基咪唑、羟基二甲硝基咪唑和洛硝哒唑、异丙硝唑和羟基异丙硝唑分别以磺胺间二甲氧嘧啶-D6、恩诺沙星-D5、青霉素G-D7、二甲硝基咪唑-D3、羟基二甲硝基咪唑-D3、羟基异丙硝唑-D3为内标化合物。
Na2EDTA-Mcllvaine溶液的配制:将1 000 mL 0.1mol/L 柠 檬 酸 溶 液 和 625mL 0.2 mol/L磷酸氢二钠溶液混合,调节pH至4.0,配制成Mcllvaine溶液;称取60.5g Na2EDTA于1 625mL Mcllvaine溶液中,混合均匀。
1.3 试验条件
1.3.1 色谱条件 色谱柱:Waters Acquity UPLC BEH C18柱(2.1mm×100mm×1.7 μm);柱温:35℃;样品温度:25℃;进样体积:5μL;流速:0.2mL/min;流动相:乙腈(A),0.1%甲酸水溶液(B);梯度洗脱程序:0~5min、90%B,5~9min、90%~60%B,9~13min、60%B,13~15min、60%~10%B,15~16min、10%B,16~17min,10% ~90%B、17~20min、90%B。
1.3.2 质谱条件 电喷雾离子源(ESI),正离子模式扫描,多反应监测(MRM),毛细管电压2.80kV,离子源温度150℃,脱溶剂气温度500℃,脱溶剂气流量1 000L/h。
1.4 前处理方法
1.4.1 提取 称取(2±0.02)g匀浆试样于50 mL离心管中,准确加入10μL内标混合溶液,避光放置 2min,加入 10mLV(Na2EDTAMcllvaine)∶V(乙腈)=7∶3的混合提取液,涡旋1min,超声提取10min,以12 000r/min离心10min后,取出上清液;再加入10mLV(Na2EDTA-Mcllvaine)∶V(乙腈)=7∶3的混合提取液,重复上述操作,合并提取液,在40℃下氮吹减少6mL左右,待净化。
1.4.2 净 化 分 别 用 3mL 甲 醇、水 和Na2EDTA-Mcllvaine缓冲液活化 MCX(60mg/3mL)柱,将上述提取液上样,用3mL水淋洗,抽至近干后,分别用3.0mL甲醇和5%氨水甲醇溶液洗脱,于45℃下氮吹至干,再加入1mLV(乙腈)∶V(水)=1∶9的溶液溶解,涡旋混合1min,过0.22μm微孔滤膜后,UPLC-MS/MS分析。
2 结果与讨论
2.1 色谱条件的优化
本试验选用 Waters Acquity UPLC BEH C18(2.1mm×100mm×1.7μm)色谱柱分离4类兽药,此色谱柱对各化合物具有较强的保留,各色谱峰峰形较好,并可以得到有效的分离,减少了杂质的干扰。
分别选择甲醇和乙腈作为强洗脱流动相。试验证明:当甲醇作为流动相时,离子化受到不同程度的抑制,峰形变宽,丰度明显降低,灵敏度下降,而乙腈的离子化效率明显优于甲醇,故采用乙腈作为强洗脱流动相。在流动相中加入甲酸能增加各种化合物在ESI+模式下的离子化效率,改善各化合物的峰形。本试验分别配制0.05%、0.1%和0.2%甲酸水溶液作为流动相,结果表明,0.1%甲酸水溶液体系能提供最佳的离子化条件,峰面积信号最强,灵敏度最高。
2.2 质谱条件的优化
在电喷雾质谱、正离子监测模式下,分别对毛细管电压、锥孔电压、碰撞能量和选择离子等进行了充分的优化,选取经碰撞后所得丰度较高的2个子离子作为定量和定性离子,并确定其最佳碰撞能量的电压值。所选择的母离子、子离子和碰撞能量等参数列于表1。

表1 四类兽药的质谱分析条件Table 1 The conditions of ESI-MS/MS analysis four species of drugs
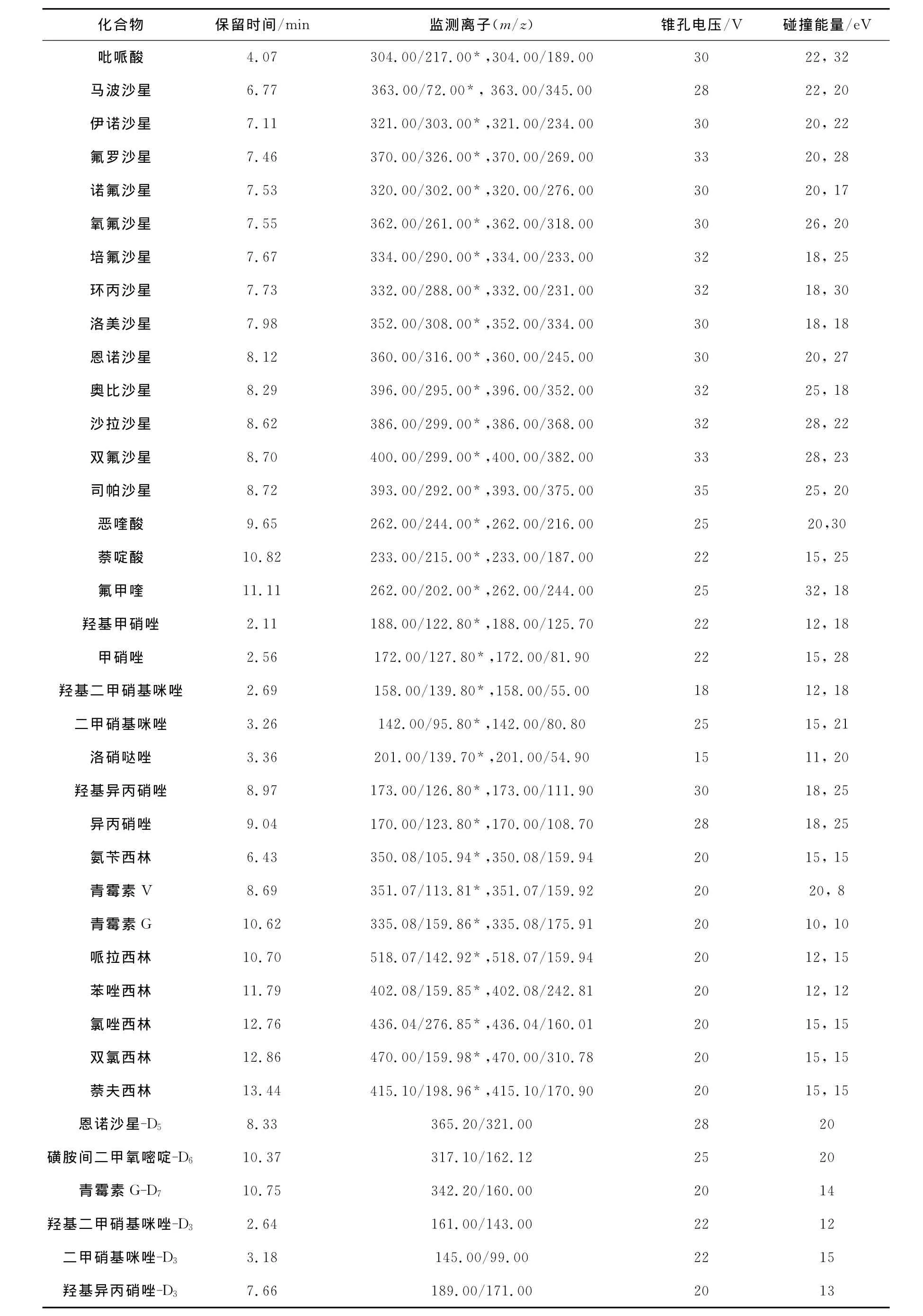
续表
2.3 萃取溶剂的选择
由于4类药物的酸碱性各异,pKa值范围较宽,多易溶于乙腈、甲醇等极性溶剂,试验分别比较了甲醇、乙腈、Na2EDTA-Mcllvaine-乙腈和Na2EDTA-Mcllvaine-甲醇复合提取液的提取效果。由于乙腈具有较强的去除蛋白质的能力,且对于多数药物具有较好的提取效率,因此,乙腈的萃取效果优于甲醇。在乙腈中加入Na2EDTA-Mcllvaine溶液,可以提高部分偏酸性化合物和水溶性化合物的提取效率,当V(Na2EDTA-Mcllvaine)∶V(乙腈)=7∶3时,各类药物具有较好的提取效率,因此,采用V(Na2EDTA-Mcllvaine)∶V(乙腈)=7∶3混合提取液作为本试验的提取溶剂。
2.4 净化条件的选择
净化效果对基质效应具有较大的影响,为了获得较好的净化效果,本试验选用Waters公司的 MAX、MCX、WAX、WCX和 HLB 5种类型固相萃取小柱分别考察净化效果和保留行为,由于MCX固相萃取柱的pKa适用范围为2~10,药物的pKa值范围较宽,本试验采用酸性提取液萃取,促使药物电离,使其吸附到固相萃取柱上,加大化合物的保留,因此,MCX固相萃取小柱对各种药物具有较好的吸附作用,净化效果较好。本试验比较了1%、3%和5%不同浓度氨水-甲醇溶液的洗脱效果,结果发现,采用甲醇和5%氨水-甲醇依次洗脱方式可将固相萃取柱上的药物全部洗脱。
2.5 方法学验证
2.5.1 线性范围、检出限和定量限 配制浓度分别为5、10、50、100、200μg/L的系列标准溶液,以各分析物的峰面积(y)为纵坐标,质量浓度(x)为横坐标绘制标准曲线,线性回归方程及相关系数列于表2。结果表明:各种药物在浓度为5~200μg/L范围内有良好的线性关系,相关系数r均在0.99以上。以3倍信噪比(S/N=3)计算方法的最低检出限,以10倍信噪比(S/N=10)计算方法的最低定量限,其结果列于表2。
2.5.2 精密度 在阴性猪肉样品中添加10、50、100μg/kg 3种不同浓度水平的兽药混合标准溶液,按1.4方法进行预处理,平行操作3次,结果列于表2。各种药物在3种不同浓度下的精密度(RSD)分别为1.03%~8.04%、2.56%~9.94%、1.66%~10.94%。按日内精密度的预处理方法,每天取样1份,连续5天,各种药物的 RSD 分别为 1.08% ~9.86%、2.86% ~10.04%、2.96%~11.04%,重现性较好。
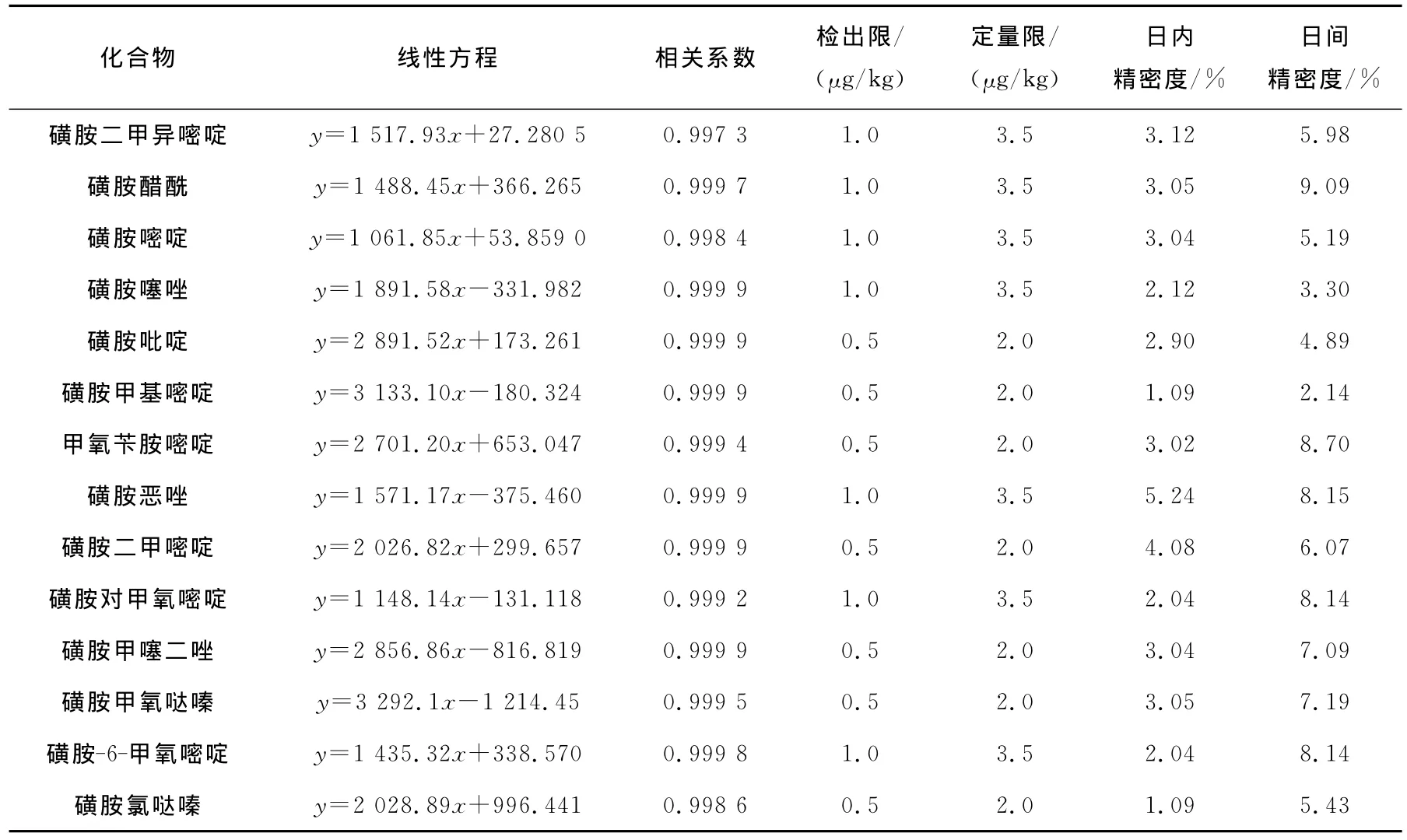
表2 四类兽药的线性方程、相关系数、检出限、定量限和精密度Table 2 Linear equations,correlation coefficients,LOD,LOQ and RSD of four species of drugs

续表
2.5.3 回收率 分别在阴性猪肉、牛肉、羊肉、鸡肉和鸭肉样品中添加10、50、100μg/kg 3种不同浓度水平的混合标准溶液,每个浓度做3个平行,按1.4方法进行预处理,回收率列于表3。结果表明:各种药物的回收率在70.0%~130.9%之间,符合兽药多残留分析的要求。

表3 四类兽药的回收率Table 3 The recoveries of four species of drugs
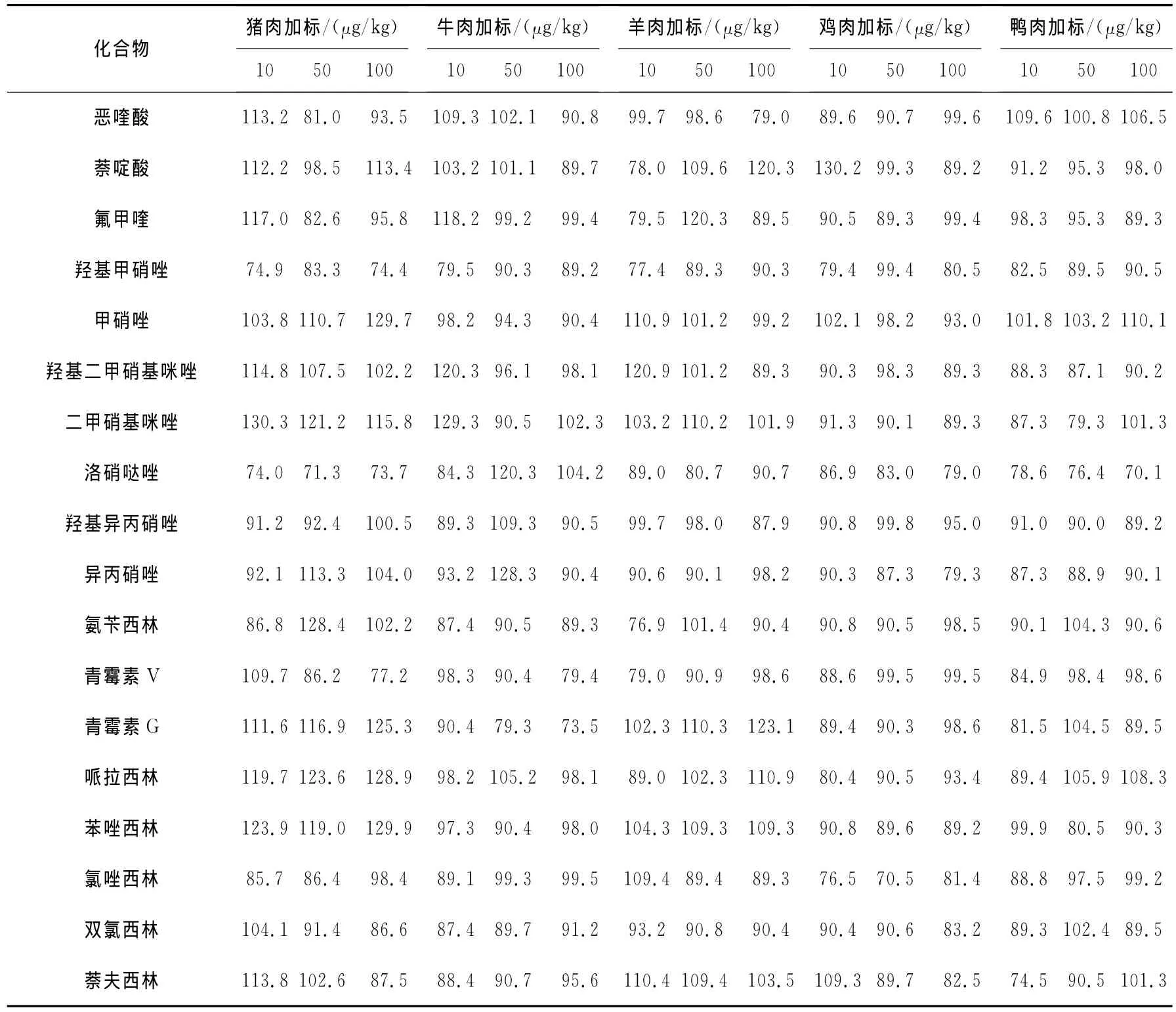
续表
2.6 实际样品测定与阳性定性确证
在本试验条件下,对日常检测的30例畜禽肉进行4类兽药筛查,发现3例阳性样品,其中2例猪肉样品含有磺胺二甲嘧啶,其检测结果分别为79.3μg/kg和250.2μg/kg,1例猪肉样品含有磺胺邻二甲氧嘧啶,其检测结果为97.3 μg/kg。阳性猪肉样品和标准品的多反应监测色谱图示于图1。阳性样品与标准品的保留时间和相对丰度比相吻合。依据国家标准GB/T 20759—2006的前处理方法,对这3例阳性猪肉样品进行检测,磺胺二甲嘧啶为80.0μg/kg和250.1 μg/kg,磺 胺 邻 二 甲 氧 嘧 啶 为 96.2 μg/kg。结果表明:两种方法的检测结果较吻合,说明本方法的前处理技术适用于畜禽肉中4类兽药残留的筛选和检测。
由于多反应监测模式存在一定的限制,为了避免三重四极杆质谱假阳性的产生,本试验采用液相色谱-离子阱-飞行时间串联质谱分别对3例阳性样品进行多级质谱分析,从而做进一步确证。磺胺二甲嘧啶和磺胺邻二甲氧嘧啶两种化合物在离子阱-飞行时间串联质谱上的质谱碎片与三重四极杆质谱中的母离子和子离子完全吻合,磺胺二甲嘧啶标准品和磺胺邻二甲氧嘧啶标准品的三级质谱图分别与阳性样品的三级质谱图相吻合,质量数偏差在误差范围内,说明三重四极杆质谱在一定程度上消除了基质干扰,其多级质谱图示于图2。通过离子阱-飞行时间串联质谱的精确质量数定性,对样品做进一步的确证,可以避免假阳性的产生,保证结果的可靠性。
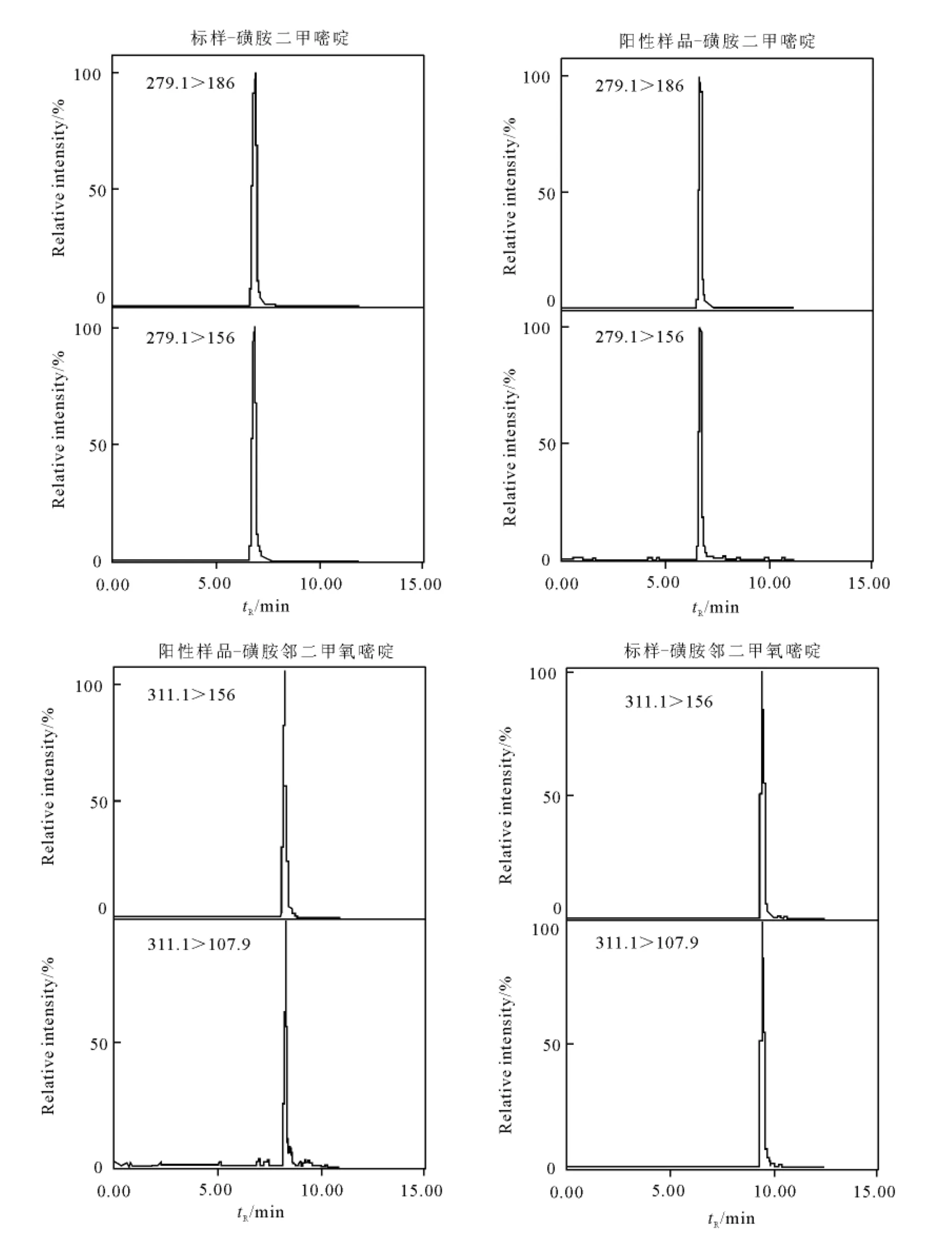
图1 阳性猪肉样品的多反应监测色谱图Fig.1 MRM chromatogram of positive pork sample
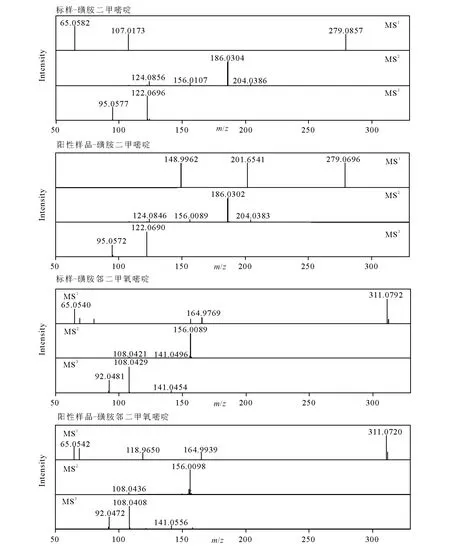
图2 磺胺标准品和阳性猪肉样品的多级质谱图Fig.2 Mass spectrum of standard and positive sample
3 结论
本工作建立了同位素稀释-固相萃取-串联质谱技术快速检测和确证畜禽肉中4类兽药多残留检测的分析方法。该方法具有灵敏度高、前处理方法简单、回收率高且稳定、准确度和精密度高等优点,适用于畜禽肉中多类兽药残留的快速检测和确证。基质效应在兽药残留分析中普遍存在,由于本试验在前处理方法中加入了同位素内标,能有效地去除基质干扰,与国家标准方法相比,定量结果的准确性更高、分析速度更快。此外,本试验采用三重四极杆串联质谱和离子阱-飞行时间串联质谱相结合的定性分析方法,可以有效地消除由仪器检测所产生假阳性,保证了定性和定量结果的可靠性。该方法适用于畜禽肉中多类兽药残留的快速检测和确证。
[1] 王 冉,刘铁铮,王 恬.抗生素在环境中的转归及其生态毒性[J].生态学报,2006,26(1):265-270.WANG Ran,LIU Tiezheng,WANG Tian.The fate of antibiotics in environment and its ecotoxicology:A review [J].Acta Ecologica Sinica,2006,26(1):265-270(in Chinese).
[2] LEE H J,LEE M H,RYU P D,et al.Enzymelinked immunosorbent assay for screening the plasma residues of tetracycline antibiotics in pigs[J].Journal of veterinary medical science,2001,63(5):553-556.
[3] HERMO M P,BARRON D,BARBOSA J.Development of analytical methods for multireside determination of quinolones in pig muscle samples by liquid chromatography with ultraviolet detection,liquid chromatography-mass spectrometry and liquid chromagraphy-tandem mass spectrometry[J].Journal of chromatography A,2006,1 104(1/2):132-139.
[4] 胡献刚,罗 义,周启星,等.固相萃取-高效液相色谱法测定畜牧粪便中13种抗生素药物残留[J].分析化学,2008,36(9):1 162-1 166.HU Xiangang,LUO Yi,ZHOU Qixing,et al.Determination of thirteen antibiotics residues in manure by solid phase extraction and high performance liquid chromatography [J].Chinese Journal of Analytical Chemistry,2008,36(9):1 162-1 166(in Chinese).
[5] 李艳霞,李 帷,张雪莲,等.固相萃取-高效液相色谱法同时检测畜禽粪便中14种兽药抗生素[J].分析化学,2012,40(2):213-217.LI Yanxia,LI Wei,ZHANG Xuelian,et al.Simultaneous determination of fourteen verterinary antibiotics in animal manure using solid phase extraction and liquid chromatography[J].Chinese Journal of Analytical Chemistry,2012,40(2):213-217(in Chinese).
[6] AGUILERA-LUIZ M M,MARTINEZ VIDAL J L M,ROMERO-GONZALEZ R,et al. Multi-residue determination of veterinary drugs in milk by ultrahigh-pressure liquid chromatography-tandem mass spectrometry[J].Journal of chromatography A,2008,1 205(1/2):10-16.
[7] CHIAOCHAO C,KOESUKWIWAT U,YUDTHAVORASIT S,et al.Efficient hydrophilic interaction liquid chromatography-tandem mass spec-trometry for the multiclass analysis of veterinary drugs in chicken muscle[J].Analytica Chimica Acta,2010,682(1/2):117-129.
[8] 杜振霞,孙姝琦.牛肉中三种喹诺酮类兽药残留的 UPLC-MS/MS分析方法[J].质谱学报,2007,28(4):219-223.
DU Zhenxia,SUN Shuqi.Determination of fluoroquinolones veterinary drug residues in bovine muscle by UPLC-MS/MS[J].Journal of Chinese Mass Spectrometry Society,2007,28(4):219-223(in Chinese).
[9] 殷居易,谢东华,陈 杰,等.SPE净化 HPLCAPCI(+)-MS/MS分析肉类食品中硝基咪唑类药物原药及代谢物残留量[J].质谱学报,2009,30(4):193-200.YIN Juyi,XIE Donghua,CHEN Jie,et al.Determination of nitroimidazoles drug residues in meat products by HPLC-APCI(+)-MS/MS[J].Journal of Chinese Mass Spectrometry Society,2009,30(4):193-200(in Chinese).
[10] KAUFMANN A,BUTCHER P,MADEN K,et al.Ultra-performance liquid chromatography coupled to time of flight mass spectrometry (UPLCTOF):A novel tool for multiresidue screening of veterinary drugs in urine[J].Analytica Chimica Acta,2007,586(1/2):13-21.
[11] ORTELLI D,COGNARD E,JAN P,et al.Comprehensive fast multiresidue screening of 150 veterinary drugs in milk by ultra-performance liquid chromatography coupled to time of flight mass spectrometry[J].Journal of chromatography B,2009,877(23):2 363-2 374.
[12] KUKUSAMUDE C,BURAKHAM R,CHAILAPAKUL O,et al.High performance liquid chromatography for the simultaneous analysis of penicillin residues in beef and milk using ionpaired extraction and binary water-acetonitrile mixture[J].Talanta,2012,92(1):38-44.
[13] NIELEN M W F,LASAROMS J J P,ESSERS M
L,et al.Multiresidue analysis of beta-agonists in bovine and porcine urine,feed and hair using liquid chromatography electrospray ionisation tandem mass spectrometry[J].Analytical and Bioanalytical Chemistry,2008,391(1):199-210.
[14] BOGIALLI S,DI CORCIA A.Recent applicati
ons of liquid chromatography-mass spectrometry to residue analysis of antimicrobials in food of animal origin[J]. Analytical and Bioanalytical Chemistry,2009,395(4):947-966.
[15] FERNANDEZ-TORRES R,LOPEZ M A,CONSENRINO MO,et al.Enzymatic-microwave assisted extraction and high-performance liquid chromatography-mass spectrometry for the determination of selected veterinary antibiotics in fish and mussel samples[J].Journal of Pharmaceutical and Biomedical analysis.2011,54(5):1 146-1 156.
[16] 侯建波,谢 文,陈笑梅,等.液相色谱-串联质谱-同位素稀释法同时测定猪肉中54种药物残留[J].质谱学报,2012,33(1):42-54.HOU Jianbo,XIE Wen,CHEN Xiaomei,et al.Simultaneous determination of 54drugs residues in pork by high performance liquid chromatography-tandem mass spectrometry and isotopes dilution technique [J].Journal of Chinese Mass Spectrometry Society,2012,33(1):42-54(in Chinese).
[17] 郭德华,邓晓军,赵善贞,等.固相萃取-高效液相色谱/串联质谱同时检测动物源性食品中76种兽 药 残 留 [J].分 析 化 学,2010,38(3):318-324.GUO Dehua,DENG Xiaojun,ZHAO Shanzhen,et al.Simultaneous determination of 76veterinary drug residues in foodstuffs of animal origin by solid phase extraction-liquid chromatography-tandem mass spectrometry [J].Chinese Journal of Analytical Chemistry,2010,38(3):318-324(in Chinese).
[18] 马丽丽,郭昌胜,胡 伟,等.固相萃取-高效液相色谱-串联质谱法同时测定土壤中氟喹诺酮、四环素和磺胺类抗生素[J].分析化学,2010,38(1):21-26.MA Lili,GUO Changsheng,HU Wei,et al.Simultaneous extraction and determination of eighteen fluoroquinolone,tetracycline and sulfonamide antibiotics from soils using solid-phase extraction and liquid chromatography-tandem mass spectrometry[J].Chinese Journal of Analytical Chemistry,2010,38(1):21-26(in Chinese).
[19] LEPORATI M,CAPRA P,BRIZIO P,et al.Fit-for-purpose in veterinary drug residue analysis:Development and validation of an LC-MS/MS method for the screening of thirty illicit drugs in bovine urine[J].Journal of Separation Science,2012,35(3):400-409.
[20] AGUILERA-LUIZ M M,MARTINEZ VIDAL J L,ROMERO-GONZALEZ R,et al.Multiclass method for fast determination of veterinary drug residues in baby food by ultra-high-performance liquid chromatography-tandem mass spectrometry[J].Food Chemistry,2012,132(4):2 171-2 180.
[21] STUBBINGS G,BIGWOOD T.The development and validation of a multiclass liquid chromatography tandem mass spectrometry (LC-MS/MS)procedure for the determination of veterinary drug residues in animal tissue using a QuEChERS(Quick,Easy,Cheap,Effective,Rugged and Safe)approach[J].Analytica Chimica Acta,2009,637(1/2):68-78.
[22] 张 毅,岳振峰,蓝 芳,等.分散固相萃取净化与液相色谱/串联质谱法测定牛奶中8类禁用药物残留[J].分析化学,2012,40(5):724-729.ZHANG Yi,YUE Zhenfeng,LAN Fang,et al.Determination of 8species of banned drugs in bovine milk by using quechers cleanup approach and liquid chromatography-tandem mass spectrometry[J].Chinese Journal of Analytical Chemistry,2012,40(5):724-729(in Chinese).
