不同浓度雌激素对人源性牙周膜干细胞成骨分化能力的影响
2013-05-25杭州市红十字会医院口腔科杭州310003
夏 冰 杭州市红十字会医院口腔科 杭州 310003
·实验研究·
不同浓度雌激素对人源性牙周膜干细胞成骨分化能力的影响
夏 冰 杭州市红十字会医院口腔科 杭州 310003
目的:对比研究不同浓度的雌激素对人源性牙周膜干细胞成骨分化的影响。方法:采用DMEM完全培养基将人牙周膜干细胞制成单细胞悬液,分别加入浓度为0、10×10-10、10×10-9、10×10-8、10×10-7、10×10-6、10×10-5mol/L的雌激素,以未加入雌激素的成骨诱导液组(普通DMEM培养基中加入10mM β-甘油磷酸钠、50μM维生素C及10nM地塞米松)作为阴性对照。培养后实时定量PCR方法分别检测成骨早中晚期关键指标Runx2、ALP和OCN mRNA表达。结果:浓度为10×10-10、10× 10-9、10×10-8、10×10-7、10×10-6、10×10-5mol/L的雌激素对人源性的牙周膜干细胞培养均无毒性;不同浓度组间差异无统计学意义(P>0.05);在成骨诱导7、14、21天时,Runx2、ALP及OCN mRNA表达在10×10-7组最高(P<0.05~0.01)。在不同浓度雌激素组中成骨相关基因的表达均高于阴性对照组(P<0.05)。结论:当雌激素浓度<10×10-7mol/L时,雌激素能够以剂量依赖的方式促进人牙周膜干细胞成骨分化过程中成骨相关基因的表达。当雌激素浓度>10×10-7mol/L时,雌激素浓度的增加并未促进成骨相关基因的表达。
牙周膜干细胞 成骨分化 雌激素
雌激素是骨骼系统中最为重要的调节因子,在调控女性骨骼新陈代谢方面发挥重要作用[1],绝经期妇女由于雌激素的缺乏容易导致骨质疏松等疾病。牙槽骨是人类骨组织中代谢最为活跃的部位之一,极易受雌激素水平的影响,从而引发牙周疾病,进而危害人类的口颌系统及身心健康。牙周膜干细胞是一类取自于牙周膜的间充质来源的成体干细胞,由于其在特定的条件下可以分化为成牙骨质细胞、成骨细胞、成纤维细胞、脂肪细胞和成胶原细胞等,在维持牙周组织的稳态,维护牙槽骨的新陈代谢过程中发挥重要作用[2]。本研究就不同浓度的雌激素对人源性牙周膜干细胞成骨分化的影响进行了初步探讨,报道如下。
1 实验材料
1.1 人源性牙周膜干细胞来源 由第四军医大学牙体牙髓科严妍博士惠赠[3]。
1.2 试剂及仪器 DMEM完全培养基(Gibico,美国),二氧化碳恒温培养箱(美国,Thermo公司),相差倒置显微镜及照相系统(日本,Olympus公司),MTT(Sigma,美国),DMSO(Sigma,美国),β-甘油磷酸钠(Sigma,美国),维生素C(Sigma,美国),地塞米松(Sigma,美国),Trizal(Invitrogen,美国),反转录试剂盒(全式金,中国),紫外分光光度计(Eppendorf,德国),全自动酶标仪(美国,Rayto公司),UDG染料(全式金,中国),本实验所采用的引物由上海生物工程技术有限公司合成。
2 实验方法
2.1 人源性牙周膜干细胞取材及培养 采用含有10%(体积分数)胎牛血清(Gibico,美国)的DMEM完全培养基在37℃、含5%CO2、相对湿度为90%的培养箱中培养。倒置显微镜下观察牙周膜干细胞的生长情况,待细胞铺满瓶底大约90%时,采用0.25%的胰酶消化后,将消化的人牙周膜干细胞以1:3的比例进行传代培养。取第四代细胞进行实验。
2.2 不同浓度雌激素对人源性牙周膜干细胞的毒性实验 DMEM完全培养基将人牙周膜干细胞制成单细胞悬液,以每孔8×103个细胞的密度接种于96孔板中,每孔体积约200μL。培养基中分别加入浓度为0、10×10-10、10×10-9、10×10-8、10×10-7、10×10-6、10×10-5mol/L的雌激素分别培养48、96h后弃培养基,每孔中加入100μL MTT溶液,37℃温箱孵育6h后终止培养,弃上清液。每孔加入150μL DMSO,震荡使结晶物充分溶解后,酶标仪检测。
2.3 不同浓度雌激素对人源性牙周膜干细胞成骨的分化诱导 将细胞悬液以每皿3×103个细胞的密度接种于6 cm培养皿中,成骨诱导液中分别加入浓度为10×10-10、10×10-9、10×10-8、10×10-7、10×10-6、10×10-5mol/L的雌激素。以未加入雌激素的成骨诱导液组(普通DMEM培养基中加入10mM β-甘油磷酸钠、50μM维生素C及10nM地塞米松)作为阴性对照。每3天换1次液。分别培养7、14、21天。
2.4 实时定量PCR方法检测成骨不同阶段的关键指标Runx2、ALP和OCN的mRNA表达 于7、14、21天分别收取细胞,以Trizal提取细胞总RNA,用紫外分光光度计检测其含量和纯度,按反转录试剂盒的说明书将提取的RNA反转录成cDNA,将其以1: 10倍稀释待用。PCR反应引物(由上海生物工程技术有限公司合成):18S:上游5’-CAGCCACCCGAGATTGAGCA-3’,下游5’-TAGTAGCGACGGGCGGTGTG-3’;Runx2:上游5’-TGGTTACTGTCATGGCGGGTA-3’,下游5’-TCTCAGATCGTTGAACCTTGCTA-3’;ALP:上游5’-GGGACTGGTACTCAGACAACG-3’,下游5’-GTAGGCGATGTCCTTACAGCC-3’;OCN:上游5’-GGCGCTACCTGTATCAATGG-3’,下游5’-GTGGTCAGCCAACTCGTCA-3’。总反应体系20μL,其中模板cDNA 2μL,上游引物0.5μL,下游引物0.5μL,反应液10μL,ddH2O 8μL,反应条件为:50℃2min,95℃2min,95℃15s,60℃1min,循环40次。以18S为内参。以上实验采用不同的原代标本重复3次取均值。
2.5 统计学方法 应用SPSS17.0软件进行方差分析,以P<0.05为有差异统计学意义。
3 实验结果
3.1 人牙周膜干细胞的特性 倒置显微镜下观察,牙周膜干细胞多呈长梭形,有1~2个突起。细胞核为卵圆形,位于细胞质的中央。形态与成纤维样细胞类似。少数细胞形态为不规则的多角形、纺锤状或椭圆形,体积较小,胞体丰满。传代后细胞生长良好。
3.2 不同浓度雌激素的细胞毒性实验 雌激素能够调控小鼠骨髓间充质干细胞的增殖与分化[4],所以首先本实验采用MTT的方法检测不同浓度的雌激素对人源性牙周膜干细胞的细胞毒性,实验中所采用的浓度为10×10-10、10×10-9、10×10-8、10×10-7、10×10-6、10×10-5mol/L的雌激素对人源性的牙周膜干细胞培养均无毒性。不同浓度组间差异无统计学意义(P>0.05),见图1。
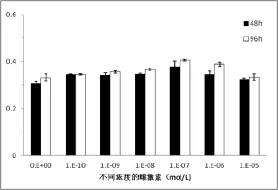
图1 不同浓度雌激素处理人牙周膜干细胞48h、96h后细胞活性
3.3 不同浓度雌激素对人源性牙周膜干细胞成骨相关基因表达的影响 实时定量PCR结果显示,成骨诱导第7、14、21天,标志着成骨不同阶段的关键指标Runx2、ALP及OCN的基因表达水平相对于DMEM对照组显著上升。在成骨诱导7、14、21天时,成骨相关基因Runx2、ALP及OCN的基因水平表达在10×10-7组表达量最高(aP<0.05,bcP<0.01)。在不同浓度雌激素组中成骨相关基因的表达均高于阴性对照组(P<0.05)。见图2。
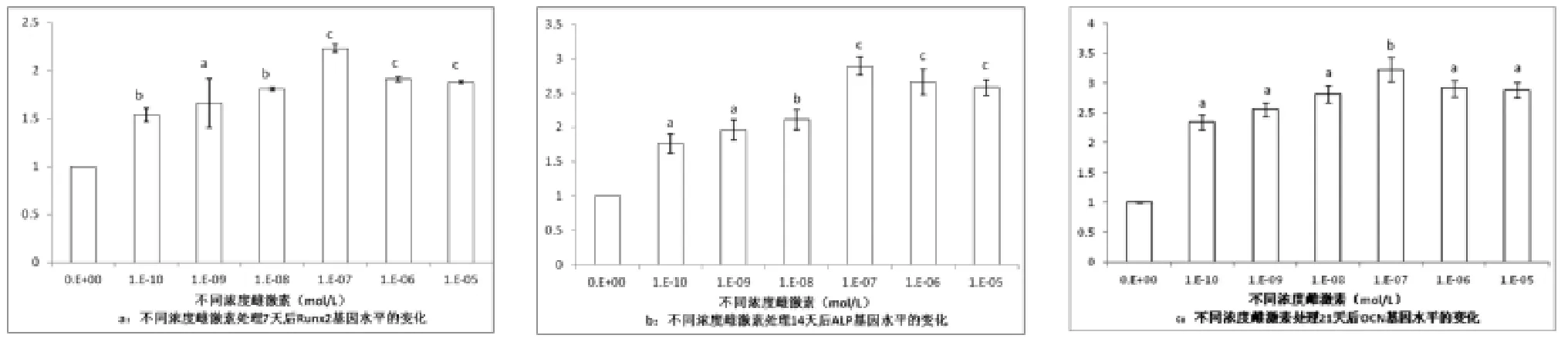
图2 不同浓度雌激素处理牙周膜干细胞7、14、21天后,Runx2、ALP及OCN mRNA表达,与0mol/L组比较,aP<0.05,b、cP<0.01
4 讨论
牙周病是一类发生于牙槽骨的炎症性骨吸收疾病,是造成牙齿松动、牙列缺失及缺损的主要原因,影响了世界上大约20%人口的口颌系统健康[5]。严重的牙周炎症得不到有效控制,会造成牙槽骨及根尖周组织的不可逆性损害,从而危害人类的口颌系统乃至身心健康。牙周膜干细胞是一类来自于牙周膜的成体干细胞,它不同于胚胎干细胞等涉及到伦理等敏感问题,同时却具有类似于胚胎干细胞的多向分化潜能,在牙槽骨及牙周组织的再生修复过程中显示了巨大的潜力[6]。
由于牙周膜干细胞能够同时表达ERα和ERβ受体,所以它被广泛认为属于雌激素的一个靶器官。在大鼠的卵巢切除模型中,雌激素能够通过与雌激素受体相互作用促进鼠源性牙周膜干细胞的成骨分化[7]。此外,雌激素还能够通过剂量依赖效应促进小鼠骨髓间充质干细胞的成骨分化[4]。除却雌激素外,许多类雌激素功能的黄酮类物质,例如染料木碱(一类黄酮类类雌激素物质)、柚皮素的衍生物(naringenin-6-C-glucoside(NCG))、TAK78等同样能够模仿雌激素的生理功能促进成骨细胞的成骨向分化[8-10]。本研究发现,10×10-10~10×10-5mol/L浓度的雌激素对人牙周膜干细胞无毒性。成骨诱导过程中外源性雌激素的加入能够上调成骨相关指标Runx2、ALP和OCNmRNA的表达。
牙周膜干细胞向成骨细胞的分化过程受一系列的转录调控因子控制。其中Runx2是调控成骨分化过程中最关键的调控因子,它对成骨细胞的分化、成熟和骨的形成有着决定的作用[11]。Runx2不仅是成骨分化过程中最先表达的转录因子,它还能够调控转录因子osterix以及骨形成相关基因,如I型胶原酶、ALP、骨涎蛋白、骨形成蛋白、OCN等的表达[11-13]。除此之外,ALP和OCN等骨形成相关基因在骨基质的矿化、成熟方面也发挥了重要作用[14]。为了研究不同浓度雌激素对人牙周膜干细胞成骨分化能力的影响,本研究选取检测不同时间点Runx2、ALP和OCN的变化。发现Runx2的表达量在第7天达到峰值,ALP和OCN分别在第14天和第21天达到峰值。
本研究发现,当浓度<10×10-7mol/L时,雌激素能够以剂量依赖的方式促进人牙周膜干细胞成骨分化过程中成骨相关基因的表达。当浓度>10×10-7mol/L时,雌激素浓度的增加并未促进成骨相关基因的表达。朱晓斐等[4]研究发现雌激素能够通过剂量依赖效应促进小鼠骨髓间充质干细胞的成骨分化,本研究结果与之基本一致。在后期的研究中,我们将进一步对雌激素促进人牙周干细胞的成骨分化机制进行探讨,为临床中由于雌激素缺乏引起的牙周疾病的治疗提供理论依据。
[1]Khosla S,Melton LJ 3rd,Riggs BL.The unitary model for estrogen deficiency and the pathogenesis of osteoporosis:is a revision needed[J].Bone Miner Res,2011,26(3):441.
[2]Seo BM,Miura M,Batouli S,et al.Investigation of multipotent postnatal stem cells from human periodontal ligament.[J].Lancet,2004,364(9429):149-155.
[3]Yan Y,Zeng W,Song S,et al.Vitamin C induces periodontal ligment progenitor cell differentiation via activation of ERK pathway mediated by PELP1[J].Protein Cell,2013,4(8):620-627.
[4]朱晓斐,毛飏,金岩,等.雌激素剂量依赖性促进小鼠骨髓间充质干细胞的成骨分化[J].中国组织工程研究,2012,16(19):3433-3437.
[5]Petersen PE,Bourgeois D,Ogawa H,et al.The global burden of oral diseases and risks to oral health[J].Bull World HealthOrgan,2005,83(9):661-669.
[6]Mao JJ,Giannobile WV,Helms JA,et al.Craniofacial tissue engineering by stem cells[J].Dent Res,2006,85(11):966.
[7]Zhang B,Li Y,Zhou Q,et al.Estrogen deficiency leads to impaired osteogenic differentiation of periodontal ligament stem cells in rats[J].Tohoku J Exp Med,2011,223(3):177-186.
[8]Heim M,Frank O,Kampmann G,et al.The phytoestrogen genistein enhances osteogenesis and represses adipogenic differentiation of human primary bone marrow stromal cells[J].Endocrinology,2004,145(2):848-859.
[9]Swarnkar G,Sharan K,Siddiqui JA,et al.A naturally occurring naringenin derivative exerts potent bone anabolic effects by mimicking oestrogen action on osteoblasts[J].Br J Pharmacol,2012,165(5):1526-1542.
[10]Bellesini LS,Beloti MM,Crippa GE,et al.The effect of TAK-778 on gene expression of osteoblastic cells is mediated through estrogen receptor[J].Exp Biol Med(Maywood),2009,234(2):190-199.
[11]Xiao G,Jiang D,Ge C,et al.Cooperative interactions between activating transcription factor 4 and Runx2/Cbfa1 stimulate osteoblast-specific osteocalcin gene expression[J].Biol Chem,2005,280(35):30689-30696.
[12]Gordon JA,Tye CE,Sampaio AV,et al.Bone sialoprotein expression enhances osteoblast differentiation and matrix mineralization in vitro[J].Bone,2007,41(3):462-473.
[13]Hinoi E,Fujimori S,Wang L,et al.Nrf2 negatively regulates osteoblast differentiation via interfering with Runx2-dependent transcriptional activation[J].Biol Chem,2006,281(26):18015-18024.
[14]Orimo H,Shimada T.The role of tissue-nonspecific alkaline phosphatase in the phosphate-induced activation of alkaline phosphatase and mineralization in SaOS-2 human osteoblast-like cells[J].Mol Cell Biochem,2008,315(1-2):51-60.
Effect of Estrogen on Osteogenic Differentiation of Human Periodontal Ligament stem cells
XIA Bing.Hangzhou Red Cross Hospital,Hangzhou(310003),China
Objective:To compare the effect of estrogen with different concentrations on osteogenic differentiation of human periodontal ligament stem cells.Methods:Human periodontal ligament stem cell suspension was prepared with DMEM complete medium and then were cocultured with 0,10×10-10,10×10-9,10×10-8,10×10-7,10×10-6,and 10× 10-5mol/L of estrogen.Real-time quantitative PCR was used to detect the expression of osteogenic key indicators like Runx2,ALP,and OCN mRNA after coculture.Results:No toxic effect on human periodontal ligament stem cells was found in 10×10-10,10×10-9,10×10-8,10×10-7,10×10-6,and 10×10-5mol/L estrogen groups and no statistically significant difference was noted among these groups(P>0.05).On day 7,14,and 21 during osteogenic differentiation,the expression of Runx2,ALP,and OCN mRNA were the highest in 10×10-7estrogen group(P<0.05~0.01)and were higher in all estrogen groups compared with the negative control group(0 estrogen group,P<0.05).Conclusion:Estrogen can promote bone-related gene expressions during osteogenic differentiation of human periodontal ligament stem cells in a dose-dependent manner when its concentration was not more than 10×10-7mol/L.When estrogen levels were more than 10×10-7mol/L,the effect was not seen.
periodontal ligament stem cells osteogenic differentiation estrogen
2013-07-30
