呋喃唑酮人工抗原的制备与鉴定
2013-05-21徐丽广宋珊珊胡拥明黄佳佳胥传来
徐丽广, 匡 华, 宋珊珊, 胡拥明, 黄佳佳, 胥传来
(江南大学 食品学院,江苏 无锡 214122)
硝基呋喃类药物(nitrofurans)主要是指呋喃唑酮(furazolidone)、呋喃它酮(furmtadone)、呋喃西林(nitrofurazone)、呋喃妥因(nitrofurantoin)等含有硝基的人工合成抗菌药物,硝基呋喃有非常好的抗菌作用,对大多数格兰阳性菌、格兰阴性菌、某些真菌和原虫有杀灭作用,且不易产生耐药性、价格低廉,被广泛用于治疗和预防由埃希菌和沙门菌引起的哺乳动物消化道疾病,也被做为饲料添加剂来预防家禽的肠道传染病[1-7]。
然而,近年来越来越多的研究表明,硝基杂环类化合物具有细胞诱变性、动物致癌毒[8-14]。科学家已经证实,硝基呋喃及其代谢物具有诱导基因突变的慢性毒性,可引起实验动物的发生癌变和基因突变。出于安全性考虑,美国、欧盟等国家和地区要求该类药物不得用于畜牧养殖中[15-18]。欧盟对该类药物不得检出。我国农业部2002文件也要求在动物源食品中不得检出硝基呋喃类药物。作者通过考察硝基呋喃类药物的母核结构,以乙醇肼和碳酸二甲酯为原料,合成了完全抗原,并采用呋喃唑酮在动物体内的稳定代谢物3-氨基-2-恶唑烷酮(AOZ)的特异性抗体对抗原的性能进行了鉴定。
1 材料与方法
1.1 材料与试剂
牛血清蛋白(BSA),卵清蛋白(OVA):上海伯奥生物科技有限公司产品;N,N-二环己基碳二亚胺(DCC)和 N-羟基丁二酰亚胺(NHS):百灵威化学技术有限公司产品;乙醇肼和1-(3-二甲氨基丙基)-3-乙基碳二亚胺(EDC):上海晶纯试剂有限公司产品;碳酸二甲酯,甲醇钠和对醛基苯甲酸:上海达瑞精细化学品有限公司产品;其他试剂包括磷酸氢二钠 (AR), 磷酸二氢钠 (AR),N,N-二甲基甲酰胺DMF(AR)等:国药集团化学试剂有限公司产品;呋喃唑酮多克隆抗体:作者所在实验室自制。
1.2 仪器与设备
酸度计:购自梅特勒-托得多(上海)仪器公司产品;纯水仪:美国 mini-Q公司产品;UV-2802PC可见光度计:尤尼柯 (上海)仪器有限公司产品;DHG-9070A型电热恒温鼓风干燥箱:上海精宏实验设备有限公司产品;RE-52AA旋转蒸发器:上海亚荣生化仪器厂产品;90-2型定时恒温磁力搅拌器和WH-2微型旋涡混合仪:上海沪西分析仪器厂产品;LCQDECA型高效液相色谱-质谱联用仪:美国非尼根公司(Finnigan company)产品;DF-1型集热式磁力搅拌水浴锅:金坛荣华仪器有限公司产品;MuLtiskan Mks酶标仪和可调试移液器:美国热电公司 (Thermo Lab systems)产品;ZD-9556水平摇床:太仓科教器材厂产品;Costar96孔8×12可拆酶标板:上海吉泰生物科技有限公司产品。
1.3 半抗原合成
1.3.1 3-氨基-2-恶唑烷酮(AOZ)的合成 以碳酸二甲酯和乙醇肼为原料,合成AOZ。在有蒸馏装置的圆底烧瓶中加入甲醇3.78 mL,甲醇钠(30%)5.82 mL,乙醇肼6.00 mL充分搅拌20 min,加入碳酸二甲酯1.155 mL。60℃保温1 h,缓慢搅拌升温至75℃。缓慢蒸出甲醇,当甲醇蒸馏完毕,结束反应,得到AOZ成液。冷却至室温,加入无水乙醇41 mL,于4℃冰箱静置,得到白色固体,离心后加无水乙醇重结晶3次得到AOZ。反应过程见图1。
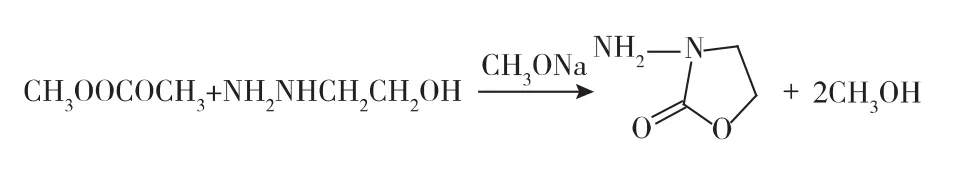
图1 AOZ的合成路线Fig.1 Synthesis of AOZ
1.3.2 对醛基苯甲酸衍生物(CPAOZ)的合成 取对醛基苯甲酸0.65 g,加入纯水10 mL,再加入3 mL 1 mol/L HCl;磁力搅拌下,在体系中缓慢滴加DMF,直至对醛基苯甲酸完全溶解,测定pH约为4.0左右;磁力搅拌下,加入1.3 g AOZ,溶解后,60℃下回流反应过夜,产生白色固体;将产物离心,弃上清液,将白色固体置于滤纸(放在漏斗中)上,用纯水洗涤3次,氮气吹干,得到半抗原CPAOZ,合成路线见图2。
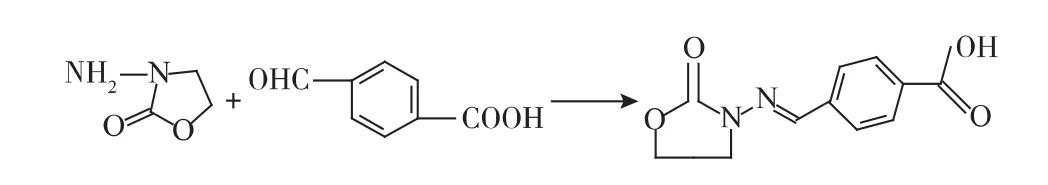
图2 CPAOZ的合成路线Fig.2 Synthesis of CPAOZ
1.4 完全抗原制备
按照文献[19-20]方法,分别采用碳二亚胺法(EDC活化)、二环己基碳二亚胺(DCC活化法)以及混合酸酐法(MA)将CPAOZ分别与载体蛋白BSA,OVA偶联,制备完全抗原。采用紫外扫描仪对完全抗原进行鉴定。采用Bradford法和Lowry法对偶联物进行偶联物蛋白质质量浓度的测定。用紫外扫描仪,得到CPAOZ的最大吸收波长,在CPAOZ的最大吸收波长下分别测已知质量浓度的偶联物和载体蛋白质的吸光值,并将CPAOZ、完全抗原、载体蛋白的质量浓度根据其相对分子质量转换为摩尔浓度,根据式(1)计算各自的摩尔消光系数:

其中,A为吸光度,c为摩尔浓度。
根据摩尔消光系数计算完全抗原中半抗原和载体蛋白的偶联比,见式2:

1.5 酶联免疫检测(ELISA)方法的建立
将上述3种方法制备的完全抗原做为包被抗原,采用ELISA方法进行验证。通过系列稀释抗原和抗体,采用方阵法确定最佳稀释比例。以呋喃唑酮为抑制物,建立各自的ELISA抑制曲线,计算半数抑制率(IC50),比较各个抗原与抗体的匹配性。
2 结果与分析
2.1AOZ和CPAOZ的质谱鉴定
AOZ的合成是本试验的关键。将重结晶后的产物溶解在含有50%甲醇的水溶液中进行质谱扫描,结果见图3(a)。AOZ的相对分子质量为102,在正离子模式下,可以看到明显的分子离子峰(M+1)m/z 103,证明合成成功。同样地,衍生后产物CPAOZ的相对分子质量为208,在正离子模式下的分子离子峰(M+1)m/z 209。 从图3(b)中可以看到明显的m/z 209分子离子峰。 综上,本方法成功地制备了呋喃唑酮的稳定代谢物AOZ和半抗原CPAOZ。
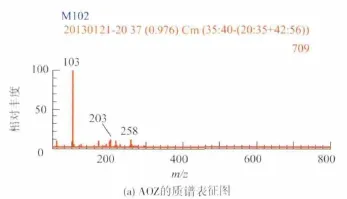
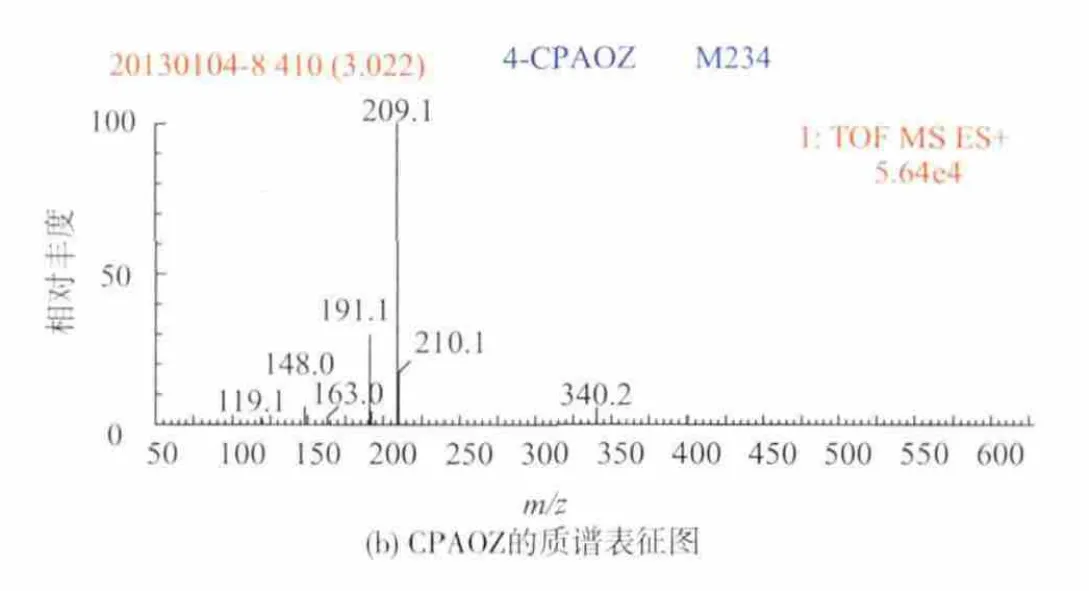
图3 AOZ和CPAOZ的质谱表征Fig.3 Characterization using mass spectrum for AOZ and CPAOZ
2.2 完全抗原的紫外光谱鉴定
以载体蛋白OVA的偶联物为例进行分析,图4是采用EDC法制备的完全抗原鉴定图谱。其中,OVA最大吸收波长为216 nm,吸收值A为1.378,半抗原的最大吸收波长为210 nm,偶联物CPAOZOVA最大吸收波长为221 nm。偶联后,紫外吸收峰发生了明显的红移,证明了半抗原CPAOZ与载体蛋白OVA偶联成功。考马斯亮蓝染色法计算偶联物中OVA的质量浓度为5 mg/mL,根据公式(1)和(2),得到产物的偶联比为8。同样地,对DCC法制备的完全抗原进行紫外光谱鉴定,计算得偶联比为12;混合酸酐法(MA)制备的完全抗原偶联比为17。
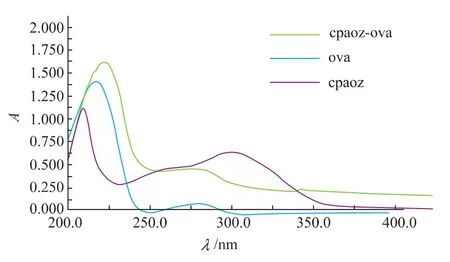
图4 CPAOZ、OVA和CPAOZ-OVA的紫外扫描图Fig.4UV spectrum of CPAOZ,OVA and CPAOZ-OVA
AOZ是呋喃唑酮抗菌素的残留标示物,相对分子质量只有102,结构简单,不具备免疫原性。为了保护其主要抗原决定簇,采用对醛基苯甲酸在其结构上引入了一个苯环,一方面保护了AOZ的抗原决定簇,另一方面也使得其抗原决定簇在免疫反应中得到充分暴露,被抗体识别。
2.3 ELISA测试结果
根据ELISA检测的要求,一般选择吸光值在1.5~1.8时的抗原抗体稀释质量浓度做为最适工作浓度。采用方阵滴定法确定了包被抗原和抗体的最适工作浓度。对于EDC法合成抗原最佳稀释质量浓度为0.09 ng/mL,抗体的稀释质量浓度为0.04 μg/mL。以DCC法制备的抗原为包被原,优化后包被抗原的最佳稀释质量浓度为0.56 μg/mL,抗体稀释质量浓度为0.63 μg/mL。采用混合酸酐法(MA法)制备的抗原为包被原,则抗原的最佳稀释质量浓度为0.02 μg/mL,抗体稀释质量浓度为 1.25 μg/mL。
分别在最佳抗原和抗体的稀释浓度下以呋喃唑酮抗菌素体内代谢物AOZ和CPAOZ建立抑制曲线,计算了各个曲线的半数抑制率,结果见表1。
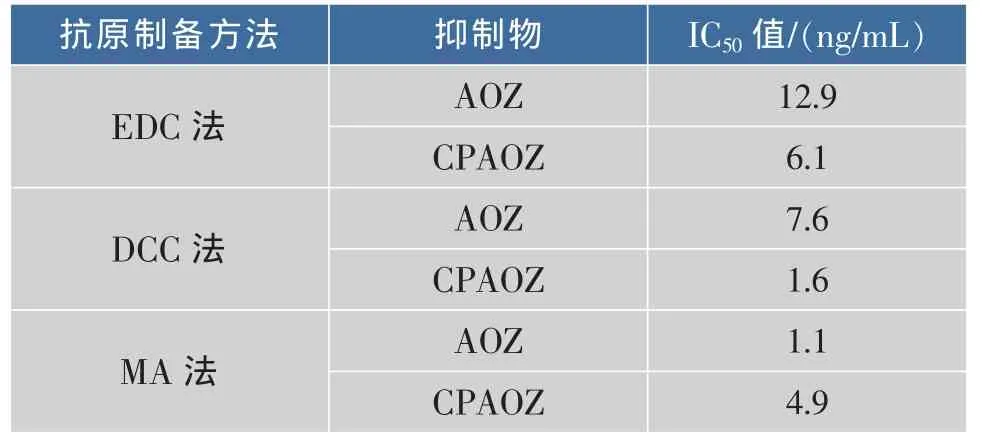
表1 基于不同包被抗原的ELISA半数抑制率Table 1 IC50values for various coating antigens
从表1可知,在本试验条件下,采用混合酸酐(MA)法制备的包被原与抗体配对,对 AOZ进行测定获得了最低的半数抑制率IC50值,即1.1 ng/mL,而采用EDC法和DCC法时的结果为12.9 ng/mL和7.6 ng/mL,是MA法的7~10倍。然而,对于CPAOZ的最低半数抑制率为1.6 ng/mL,来自于DCC法抗原做为包被时的结果。半数抑制率(IC50)值是影响ELISA方法的关键参数,决定了方法的灵敏度和特异性。本研究结果表明,即使针对于同一株抗体,不同的抗原制备方法表现出不同的性能,这和其主要抗原决定簇的暴露程度有关。
3 结语
本研究采用了3种完全抗原的制备方法(EDC法,DCC法和MA法),制备了呋喃唑酮的代谢物AOZ衍生物CPAOZ的完全抗原。紫外光谱鉴定表明了3种方法偶联载体蛋白均获得了成功,偶联比率分别为8、12、17。与AOZ抗体的配对试验结果表明,采用MA法制备的完全抗原做为包被原时,半数抑制率(IC50)值最低,为1.1 ng/mL,表明在酶免疫分析中,此抗原可以较好地将AOZ的特征抗原决定簇暴露给抗体,这为进一步开发AOZ的抗体提供了思路。
[1]李书国,李雪梅,陈辉,等.动物性食品安全和 HACCP[J].食品科学,2003,24(8):217-220.LI Shu-guo,LI Xue-mei,CHEN Hui,et al.The animal food safety and HACCP[J].Food Science,2003,24 (8):217-220.(in Chinese)
[2]佟恒敏,李艳华,韩建春.我国动物性食品中兽药残留的现状及危害[J].黑龙江畜牧兽医,2003,11:61-62.TONG Heng-min,LI Yan-hua,HAN Jian-chun.The current status and hazard of veterinary drug residues in animal products in China[J].Heilongjiang Journal of Animal Science and Veterinary Medicine,2003,11:61-62.(in Chinese)
[3]徐维海,林黎明,朱校斌.HPLC/MS法对呋喃唑酮及其代谢物AOZ在罗非鱼体内残留研究[J].上海水产大学学报,2005,34(8):23-25.XU Wei-hai,LIN Li-ming,ZHU Xiao-bin.The research of residues of furazolidone and its metabolite in tilapias by HPLC/MS[J].Journal of Shanghai Fisheries University,2005,34(8):23-25.(in Chinese)
[4]许春兰,刘小根,王士长.酶联技术在水产产品中呋喃唑酮代谢物AOZ的检测的应用[J].食品研究与开发,2007,3-4:25-27.XU Chun-lai,LIU Xiao-gen,WANG Shi-chang.The application of ELISA for detection AOZ in fishery products[J].Food Research and Development,2007,3-4:25-27.(in Chinese)
[5]李贵贤,李绍白.DMC羰基化合成呋喃唑酮工艺路线的研究[J].石化技术与应用,2002,20(4):233-235.LI Gui-xian,LI Shao-bai.Study on process for synthesizing furazolidone by carbonylation of dimethyl carbonate[J].Petrochemical Technology&Application,2002,20(4):233-235.(in Chinese)
[6]葛宝坤,王云凤,贺信.高效液相色谱法测定鸡肉、水产品中呋喃西林和呋喃唑酮残留量的研究 [J].中国卫生检验杂志,2002,12(6):661-662.GE Bao-kun,WANG Yun-feng,HE Xin.The method study on determination the pesticide of furacilin and furazolidonum in chicken fish shrimp by the SPE-HPLC[J].Chinese Journal of Health Laboratory Technology,2002,12 (6):661-662.(in Chinese)
[7]宋阳威.呋喃类药物检验检疫现状及对策[J].中国动物检疫,2003,20(3):37.SONG Yan-wei.The status and strategy for quarantine and detection of furacilins[J].China Journal of Animal Quarantine,2003,20(3):37.(in Chinese)
[8]周立靖,刘志祥.检测饲料中呋喃唑酮的几点经验[J].饲料工业,2003,24(1):46.ZHOU Li-jing,LIU Zhi-xiang.Several experiments on detection of furazolidone in feeds[J].Feed Industry,2003,24(1):46.(in Chinese)
[9]于慧娟,蔡友琼,毕士川,等.高效液相色谱法测定水产品中呋喃唑酮的残留量[J].色谱2005,23(1):114-115.YU Hui-juan,CAI You-qiong,BI Shi-chuan,et al.Determination of furazolidone residue in aquatic products by high performance liquid chromatography[J].Chinese Journal of Chromatography,2005,23(1):114-115.(in Chinese)
[10]陈笑梅,鲍晓霞.HPLC法测定鳗鱼、猪肉和对虾中的痢特灵残留[J].分析测试学报,1994,13(3):78-80.CHEN Xiao-mei,BAO Xiao-xia.Rapid Determination of furazolidone residue in eel,prawn and pork by HPLC[J].Journal of Instrumental Analysis,1994,13(3):78-80.(in Chinese)
[11]五庆伟,刘雪英.呋喃唑酮的不良反应及防治[J].中国医院药学杂志,2000,20(3):183-184.WU Qing-wei,LIU Xue-ying.Untowad effect and prevention of furazolidone[J].Chinese Journal of Hospital Pharmacy,2000,20(3):183-184.(in Chinese)
[12]郭桢,连瑾,吴淑君.动物源性食品中呋喃唑酮及代谢物的检测[J].广东农业科学,2005,5:57-59.GUO Zhen,LIAN Jin,WU Shu-jun.Detection of frazolidone and its metabolites in foodstuff originated from animals[J].Guangdong Agricultural Sciences,2005,5:57-59.(in Chinese)
[13]陈兆波.农产品质量安全分子生物检测的研究现状和发展趋势[J].食品生物技术学报,2009,28(4)444-450.CHEN Zhao-bo.Molecular detection of the quality and safety of agricultural produces:advances and trends[J].Journal of Food Science and Biotechnology,2009,28(4)444-450.(in Chinese)
[14]Auro A,Sumano H,Ocampo L.Evaluation of the carcinogenic effects off furazolidone and its metabolites in two fish species[J].Journal of Pharmacogenomics,2004,4(1):24-28.
[15]Alibh.Pharmacological,the rapeutic and toxicological properties of furazolidone:some recent research[J].Veterinary Research Communications,1999,23:343-360.
[16]Mccracken R J,Mccoy M A,Kennedy D G.Furazolidone residues in pigs:criterria to distinguish between treatment and contsmination[J].Food Additives and Contaminants,2000,17(1):75-82.
[17]Mccracken R J,Spence D E,Floyd S D.Evaluation of the residues offurazolidoneanditsmentabolite,3-amino-2-oxazolidinone(AOZ),in eggs[J].Food Additives and Contaminants,2001,18(11):954-959.
[18]Keeffe M,Conneely A,Cooper K M,et al.Nitrofuran antibiotic residues in pork[J].Anal Chim Acta,2004,520:125-131.
[19]甘金华,邓薇,李进平,等.强力霉素人工抗原的合成和抗体的制备[J].食品与生物技术学报,2011,30(2):316-320.GAN Jin-hua,DENG Wei,LI Jin-ping,et al.Artificial antigen synthesis and antibody preparation of doxycycline[J].Journal of Food Science and Biotechnology,2011,30(2):316-320.(in Chinese)
[20]孙海新,凌红丽,张玉兰,等.特布他林人工抗原的合成和抗体的制备[J].食品与生物技术学报,2009,28(3):371-376.SUN Hai-xin,LING Hong-li,ZHANG Yu-lan,et al.Synthesis of terbutalin artificial antigen and preparation of anti-terbutalin antibody[J].Journal of Food Science and Biotechnology,2009,28(3):371-376.(in Chinese)
