不同食品基质中单核细胞增生李斯特氏菌核酸提取方法的比较
2013-05-21祝长青郭云昌郭桂萍刘秀梅付瑞燕
周 阳 , 祝长青 , 郭云昌 , 郭桂萍 , 蒋 原 , 刘秀梅 , 付瑞燕 *
(1.安徽农业大学 茶与食品科技学院,安徽 合肥 230000;2.安徽省食品安全分析与检测省级实验室,安徽 合肥230000;3.江苏出入境检验检疫局,江苏 南京 210001;4.国家食品安全风险评估中心,北京 100022)
从20世纪90年代起,单核细胞增生李斯特氏菌(Listeria monocytogenes,LM)就被世界卫生组织列出的最重要食源性病原菌之一[1-2]。该菌多存在于土壤、人和动物的粪便中,极易污染食品并引起人和动物的李斯特菌病,临床上多表现为人和动物脑膜炎、败血症、流产等症状,妊娠期妇女、新生儿及免疫功能低下者均为易感人群[3]。该病发病率低,但临床死亡率高。近年来,多次发生由单核细胞增生李斯特氏菌引起的食源性疾病的暴发并造成部分患者的死亡,引起世界各国高度关注[4-5]。
随着现代食品工业的发展和人民群众生活质量的提高,无论是生产企业中生产流程的监测和终产品的质量控制,还是政府部门对食品安全的监管,都迫切需要快速的食源性致病菌检测方法以满足食品检验的时效性。目前,单核细胞增生李斯特氏菌的检验仍以传统培养法为主,操作繁琐,耗时长,不能实现快速筛检[6]。当食品中单核细胞增生李斯特氏菌数目很少时,传统培养法还可能出现假阴性结果。而分子生物学检测技术的快速发展为食源性致病菌的快速鉴定提供了可能,常规聚合酶链反应(Polymerase Chain Reaction,PCR)方法、实时荧光PCR(real-time PCR)方法、多重PCR等相继建立并得到更多的应用和推广[7]。DNA模板的质量是影响分子生物学检测技术的准确性和重复性的重要因素,而样品DNA模板的质量又与食品基质类型以及核酸提取方法密切相关。因此作者以单核细胞增生李斯特氏菌为研究对象,选取肉类、海产品、奶制品、果蔬类4种典型食品基质,利用4种原理不同的提取方法进行核酸提取,通过实时荧光PCR法进行实际的评估,确定出灵敏度高、稳定性好的通用方法。
1 材料与方法
1.1 仪器与试剂
1.1.1 实验菌株 单核细胞增生李斯特氏菌标准菌株CMCC 54004:菌株由江苏出入境检验检疫局购买并保存,菌株来源中国医学细菌菌种保藏管理中心。
1.1.2 培养基及耗材 单核细胞增生李斯特氏菌增菌肉汤LB1/LB2:北京陆桥;胰蛋白胨大豆琼脂:TSA,美国OXOID;胰蛋白胨大豆营养肉汤:TSB,美国OXOID;PALCAM琼脂:美国OXOID;李斯特显色培养基:法国科玛嘉;1.5 mL和15 mL的无菌离心管;带滤网的匀质袋;一次性10 mL和2 mL移液管等。
1.1.3 试剂 溶菌酶10 mg/mL;蛋白酶K 20 mg/mL;TE 溶液:10 mmol/L Tris-HCl (pH 8.0),1 mmol/L EDTA(pH 8.0),高压灭菌;异丙醇、75%乙醇、无水乙醇、50 mmol/L EDTA溶液;细菌基因组DNA提取试剂盒(离心柱):天根公司 Cat.#DP302;Promega 沉降法试剂盒:Wizard○RGenomic DNA Purification Kit,Cat.#A1125;Promega 磁珠吸附法试剂盒:Wizard○RMagnetic DNA Purification Systerm For Food,Cat.#FF3750;Chelex-100 提取液:5%Chelex-100,0.5%NP40,TE配制,pH 8~9;单核细胞增生李斯特氏菌荧光PCR检测试剂盒:上海辉睿生物科技有限公司,Cat.#BD-I-303。
1.1.4 仪器 恒温振荡金属浴:博日MB-102;高速离心机:Thermo Scientific Biofuge Stratos;实时荧光PCR扩增仪:Roche LightCycler 480Ⅱ;电动移液器。1.1.5 试验样品 从超市中购买新鲜试验样品盐水鸭、三文鱼、鲜牛奶、水果蔬菜色拉各两份,每份100 g。
1.2 实验方法
1.2.1 阴性试验样品的确认 按照国家食品安全标准GB 4789.30-2010[8]对检测样品进行增菌,然后利用实时荧光PCR方法对增菌液进行快速筛选,同时涂布PALCAM琼脂和李斯特显色培养基平板进行菌落分离,对阴性试验样品进行确认,用于后期实验。
1.2.2 阴性样品增菌培养以及标准菌株增菌液的准备 将阴性样品用LB1增菌液进行增菌,(30±1)℃培养24 h。从LB1增菌后的菌液吸取1 mL至盛有 100 mL LB2增菌液的锥形瓶中,(30±1)℃培养24 h;同时,用胰蛋白胨大豆营养肉汤对标准菌株CMCC 54004进行增菌,(37±1)℃培养 24 h。
1.2.3 细菌梯度稀释液的制备 从 (37±1)℃培养24 h的标准菌株增菌液中吸取1 mL进行10倍稀释(增菌液在稀释前应注意用振荡器将菌悬液充分振匀)。吸取100 μL 10-5~10-7梯度稀释菌液(涂布前必须将其充分混匀),均匀涂布胰蛋白大豆琼脂(TSA琼脂),每个梯度涂布三块平板,(37±1)℃培养24 h后计数取平均值。
1.2.4 样品(阴性增菌液)布菌 在1.5 mL的离心管中加入900 μL样品增菌液和100 μL标准菌株增菌液(分装前样品增菌液和标准菌株增菌液均需充分混匀),振荡离心(12 000 g离心 10 min),弃上清液,沉淀可-20℃保存备用。
1.2.5 核酸提取 实验中沉降法选取Promega沉降法试剂盒,操作步骤按照产品说明书执行;磁珠法选取Promega磁珠吸附法试剂盒,操作步骤按照产品说明书执行;离心柱法选取天根公司的“细菌基因组DNA提取试剂盒(离心柱)”,操作步骤按照产品说明书执行;裂解法选取Chelex-100法[9]操作步骤:向沉淀中加入100 μL Chelex-100提取液,56℃孵育10 min,100℃水浴5 min,冰上冷却,12 000 g离心2 min,取上清液用于检测。
1.2.6 实时荧光PCR反应 选用单核细胞增生李斯特氏菌实时荧光PCR检测试剂盒对提取的核酸进行评估。总反应体系25 μL:包括12.5 μL单增李斯特PCR反应液Ⅰ,4 μL单增李斯特PCR反应液Ⅱ,3.5 μL 灭菌蒸馏水,5.0 μL DNA 模板。 反应程序为:95℃预变性10 min,1个循环;95℃变性10 s,58℃复性45 s,收集荧光信号,50个循环;40℃冷却40 s,1个循环。将3次平行试验反应结束后的Ct值取平均值,然后进行分析。
1.2.7 4种方法在纯菌核酸提取效果的比较 如上1.2.2、1.2.3所述,再次对标准菌株进行增菌,24 h后制备细菌梯度稀释液,平板计数。将100 μL的各稀释度的增菌液分装至1.5 mL的无菌离心管中,12 000 g离心10 min后弃上清液,然后用4种方法提取核酸,应用实时荧光PCR进行检测。
2 结果与分析
2.1 标准菌株平板计数结果
第一次平板计数结果:100 μL纯菌菌液经107倍稀释后的平板计数平均值为145,所对应细菌数量级为102;经106倍稀释后的平板计数平均值为1 394,所对应细菌数量级为103。4种方法在纯菌核酸提取效果比较实验中的平板计数结果:100 μL纯菌菌液经106倍稀释后的平板计数平均值为56,所对应细菌数量级为101;经105倍稀释后的平板计数平均值为548,所对应细菌数量级为102。
2.2 实时荧光RT-PCR反应结果
2.2.1 盐水鸭基质中四种核酸提取方法的比较由图1可以看出,PCR反应的阴性、阳性对照正常,扩增曲线典型。 由表1可知,细菌数量级在105时,Promega沉降法、Promega磁珠法、天根离心株法以及Chelex的3次平行试验的平均Ct值分别为33.62、36.55、38.80、0。试验结果显示,在盐水鸭干扰基质中,Promega沉降法灵敏度最好;Promega磁珠法也有较好的灵敏度;天根离心柱法次之;而Chelex-100法灵敏度很差,不能排除干扰基质的影响,不适合该基质中单核细胞增生李斯特氏菌核酸提取。

图1 盐水鸭基质中RT-PCR扩增曲线Fig.1 Real-time PCR amplification curve in salted duck matrix
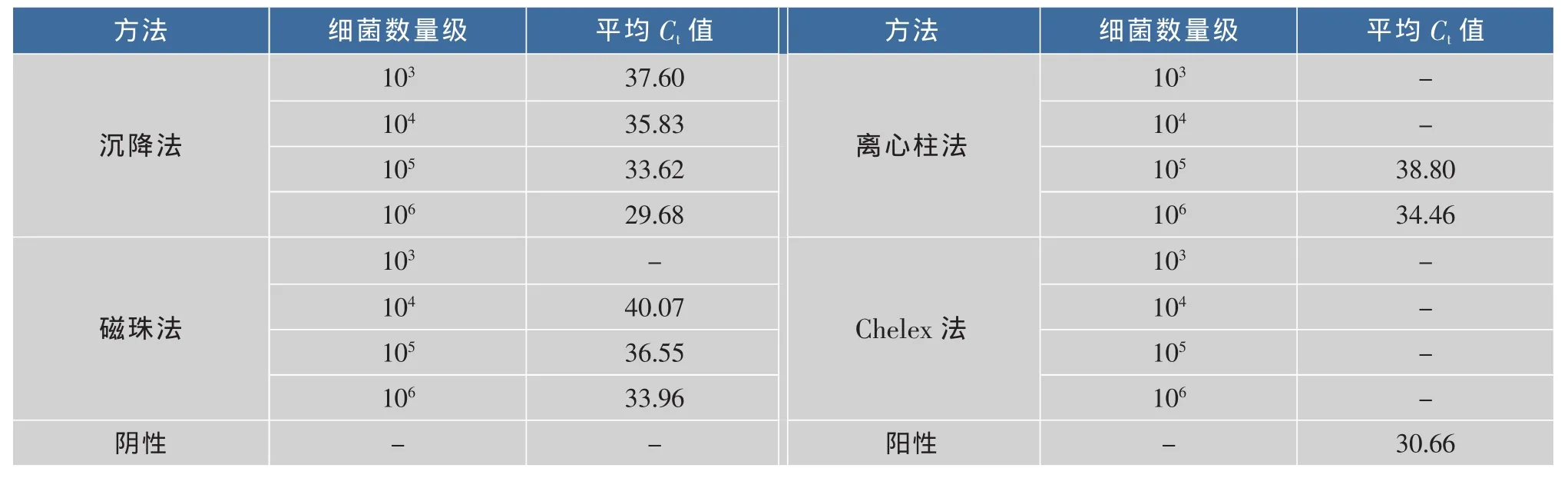
表1 盐水鸭基质四种核酸提取方法Ct值Table 1 Ctvalue of four nucleic acid extraction method in salted duck matrix
2.2.2 三文鱼基质中4种核酸提取方法的比较由图2可以看出,PCR反应的阴性、阳性对照正常,扩增曲线典型。由表2可知,细菌数量级在105时,Promega沉降法、Promega磁珠法、天根离心株法以及Chelex的3次平行试验的平均 Ct值分别为34.40、36.95、38.45、0。试验结果显示,在三文鱼干扰基质中,Promega沉降法具有较高的灵敏度;天根离心柱法稳定性好,灵敏度高;Promega磁珠法灵敏度尚可,但稳定性不好;而Chelex-100法灵敏度差,抗干扰基质影响的能力弱。
2.2.3 牛奶基质中4种核酸提取方法的比较 由图3可以看出,PCR反应的阴性、阳性对照正常,扩增曲线典型。由表3可知,细菌数量级在105时,Promega沉降法、Promega磁珠法、天根离心株法以及Chelex的3次平行试验的平均 Ct值分别为40.44、42.72、38.64、0。 试验结果显示,Promega 沉降法与Promega磁珠法的灵敏度和稳定性明显不如天根离心柱法。虽然Chelex-100法在细菌数量级为106时是阳性,但从扩增曲线可见受到牛奶基质的干扰很强。
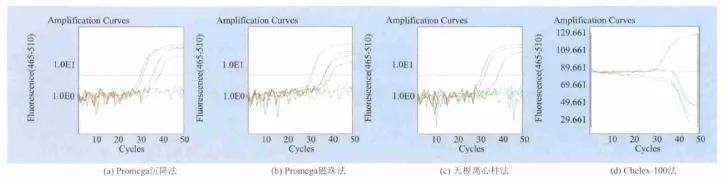
图2 三文鱼基质中RT-PCR扩增曲线Fig.2 Real-time PCR amplification curve in salmon matrix
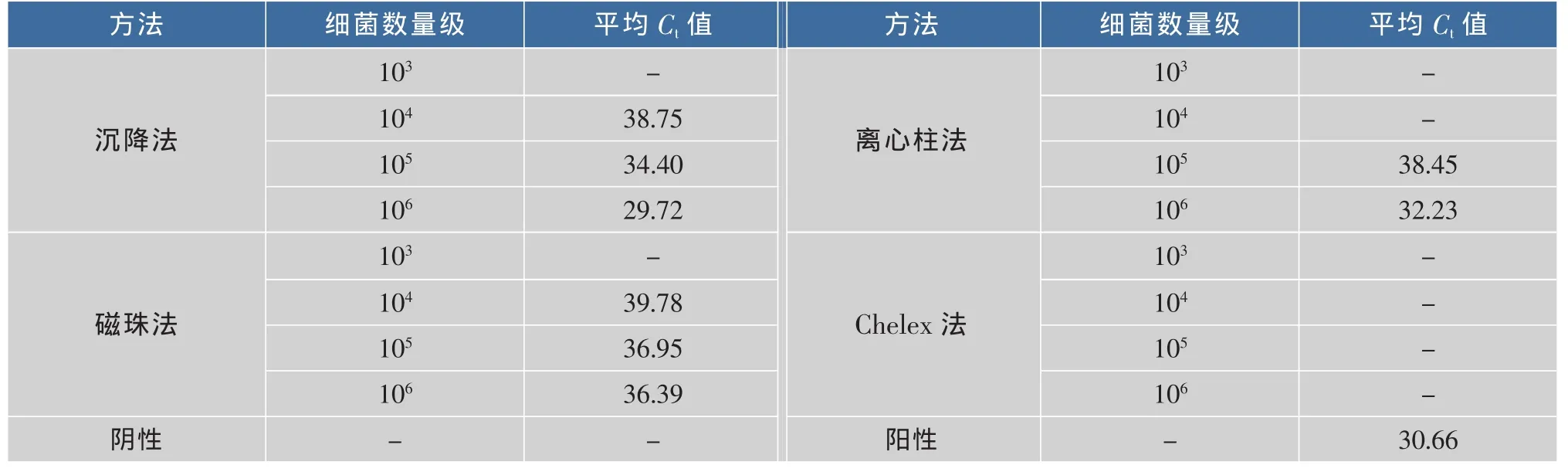
表2 三文鱼基质四种核酸提取方法Ct值Table 2 Ctvalue of four nucleic acid extraction method in salmon matrix
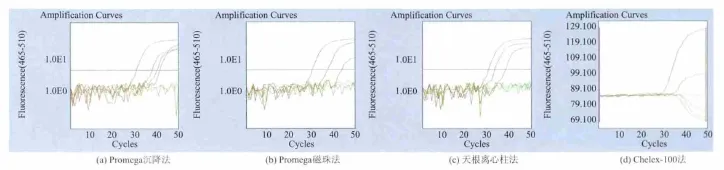
图3 牛奶基质中RT-PCR扩增曲线Fig.3 RT-PCR amplification curve in milk matrix
表3 牛奶基质4种核酸提取方法Ct值Table 3 Ctvalue of four nucleic acid extraction method in milk matrix
2.2.4 水果蔬菜色拉基质中4种核酸提取方法的比较 由图4可以看出,PCR反应的阴性、阳性对照正常,扩增曲线典型。由表4可知,细菌数量级在105时,Promega沉降法、Promega磁珠法、天根离心株法以及Chelex的3次平行试验的平均Ct值分别为 32.66、0、37.01、0。 试验结果显示 Promega沉降法具有较高的灵敏度,稳定性好;天根离心柱法稳定性好,灵敏度高;Promega磁珠法灵敏度尚可,但稳定性不好;Chelex-100法受到基质干扰的程度较大。
图4 水果蔬菜色拉基质中RT-PCR扩增曲线Fig.4 Real-time PCR amplification curve in fruit and vegetables salad matrix
表4 水果蔬菜色拉基质四种核酸提取方法Ct值Table 4 Ctvalue of four nucleic acid extraction method in fruit and vegetables salad matrix
2.2.5 纯菌增菌液中四种核酸提取方法的比较由图5可以看出,PCR反应的阴性、阳性对照正常,扩增曲线典型。由表5可知,Chelex-100法对纯菌核酸提取的效果最好,灵敏度、稳定性都很好,天根离心柱法次之,Promega磁珠法和沉降法均不如前两种方法。结果证实Chelex-100法非常适合纯菌增菌液或单菌落核酸的快速提取,但是不适合在复杂食品基质的增菌液中应用。
图5 纯菌液核酸RT-PCR扩增曲线Fig.5 Real-time PCR amplification curve in pure bacteria liquid
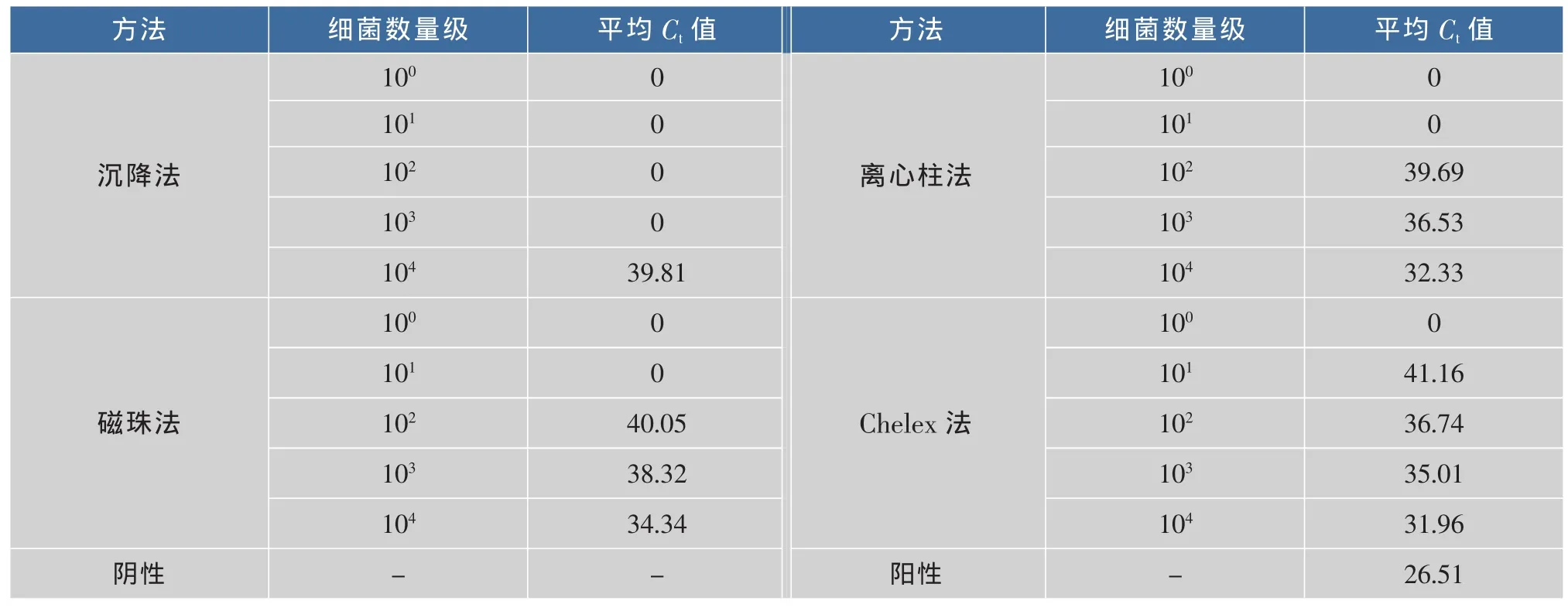
表5 纯菌增菌液四种核酸提取方法Ct值Table 5 Ctvalue of four nucleic acid extraction method in pure bacteria liquid
3 结语
我国居民的饮食结构中,即食食品所占比例越来越多,包括肉类、奶制品、水产品、水果蔬菜等,并且成为了单核细胞增生李斯特氏菌的重要感染源。此外,该菌在4℃条件下也可生长繁殖,是冷藏食品威胁人类健康的主要病原菌。随着我国冷藏食品消费量的增多,单核细胞增生李斯特氏菌的潜在危险性也越来越突出,因此单核细胞增生李斯特氏菌的检测工作显得尤为重要。
食源性致病菌的检测中,食品种类的多样性对检测结果的影响是需要着重考虑的重要问题之一。不同类型食品的组成成份差异较大,如肉类中含有较多的蛋白质、脂肪、无机盐和维生素,鱼肉含有大量优质蛋白质,不饱和脂肪酸及丰富的维生素A和维生素D,奶制品中含有较多脂肪、磷脂、蛋白质、乳糖、无机盐,青菜中含有膳食纤维和多种维生素,这些食品的组份会不同程度的影响单增李斯特氏菌核酸提取效果,此外食品在处理和加工过程中所添加的部分成份对核酸提取过程也会产生影响。由于食品组份的不同,会对检测过程中单增李斯特氏菌的核酸提取以及实时荧光PCR检测也会产生不同程度的影响,因此需对不同食品选择合适的核酸提取方法,尽量减小食品基质中复杂成份对检测的影响,保证检测结果的可靠性。
实验中选取4种不同的核酸提取方法,其原理各不相同。离心柱法多采用可以特异性结合DNA的离心吸附柱和特殊的缓冲液系统提取细菌核酸,可以高效、专一吸附DNA,最大限度的去除蛋白质及细胞中其他有机化合物;磁珠法具有独特分离作用的磁珠和缓冲液系统,能够特异性吸附核酸,当条件改变时又可以释放核酸,吸附后的漂洗过程还可将溶液中的PCR抑制物洗去;沉降法常采用细胞裂解液和相关酶类裂解细菌,用酚或氯仿去除脂类分子、多糖和蛋白质等杂质以及包含DNA水相中的核酸酶,用乙醇等沉降DNA并去除盐及残留的氯仿等成份;Chelex-100是一种由苯乙烯、二乙烯共聚体组成化学螯合树脂,对高价金属离子有很高的亲合力和螯合作用,在低离子强度、碱性及煮沸条件下,可以使细胞膜破裂,蛋白质发生变性,促进DNA游离。
本次试验为了将4类核酸提取方法进行较好比较,直接将不同食品基质的增菌液与不同浓度单核细胞增生李斯特氏菌标准菌株菌液混合均匀,然后进行核酸提取方法的比较,使问题进一步具体化、形象化,便于比较。研究表明:不同食品基质对核酸提取方法提取效果的干扰程度差异性不同,如果在提取过程中不能有效的去除就会影响实时荧光PCR方法的准确性,导致一些假阴性结果的出现。肉类基质比较复杂,油脂及蛋白类物质较多,核酸提取的难度较大,离心柱法、沉降法和磁珠法的灵敏度较高,核酸提取效果较好,并且离心柱法的稳定性明显高于沉降法和磁珠法,抗干扰能力强;海产品和水果蔬菜色拉基质中干扰因素相对较少,离心柱法和沉降法比较适合;对于奶制品基质,离心柱法能较好的排除大量蛋白类成份的影响,保证检测的准确性。此外,从操作方面考虑,沉降法和磁珠法操作比较繁琐,对操作人员的要求较高,可能会因某些步骤的操作不当而造成核酸的大量损耗,影响核酸提取效率以及检测结果的准确性。离心柱法操作简单,对实验人员的技术与操作经验要求不高,易于掌握,虽然在核酸提取过程中也存在部分损耗,但提取效率相对较高。Chelex-100法操作步骤简单,减少了DNA的损失和污染的机会,但是抗基质干扰的能力很差,检测结果极易受到基质的影响,不能有效去除PCR反应的干扰因子,对复杂食品基质中核酸提取效果差,仅适用于纯菌的核酸提取。
[1]Oevermann A,Zurbriggen A,Vandevelde M.Rhombencephalitis caused by Listeria monocytogenes in humans and ruminants:a zoonosis on the rise[J].Interdisciplinary Perspect Infect on Infectious Diseases,2010,11(5):142-168.
[2]Freitag N C,Port G C,Miner M D.Listerial monocytogenes from saprophyte to intracellular pathogen[J].Nature Reviews Microbiology,2010,7(9):623-637.
[3]Jackson K A,Iwamoto M,Swerdlow D.Pregnancy-associated listeriosis[J].Epidemiol Infect,2010,17:1-7.
[4]Centers for Disease Control and Prevention (CDC).Outbreak of Listeria monocytogenes infections associated with pasteurized milk from a local dairy-Massachusetts[J].Morbidity and Mortality Weekly Report,2008,57(40):1097-1100.
[5]Gilmour M W,Graham M,Domselaar G V,et al.High-throughput genome sequencing of two Listeria monocytogenes clinical isolates during a large foodborn outbreak[J].BMC Genomics,2010,11(1):120-135.
[6]王娜,陶妍.水产品三种致病菌多重PCR检测方法的建立[J].食品与生物技术学报,2009,28(3):397-402.WANG Na,TAO Yan.Establishment of a multiplex PCR for detection of three types of pathogen in aquatic foods[J].Journal of Food Science and Biotechnology,2009,28(3):397-402.(in Chinese)
[7]徐晓可,吴清平,张菊梅,等.食品中金黄色葡萄球菌多重PCR检测方法的研究[J].食品与生物技术学报,2011,30(1):84-89.XU Xiao-ke,WU Qing-ping,ZHANG Ju-mei,et al.Studies on detection of Staphylococus aureus in foods by multiplex PCR[J].Journal of Food Science and Biotechnology,2011,30(1):84-89.(in Chinese)
[8]GB 4789.30-2010中华人民共和国食品安全国家标准.食品微生物学检验-单核细胞增生李斯特氏菌检验[S].
[9]Kahankova J,Spanova A.Extraction of PCR-ready DNA from Staphylococcus aureus bacteriophages using carboxyl functionalized magnetic Nonporous microspheres[J].J Chromatogr B Analyt Technol Biomed Life Sci,2009,877(7):599-602.
