急性高容量血液稀释联合自体血回收对患者回输自体血红细胞膜钙泵活性的影响!
2013-05-16李建华胡惠英吴坛光
李建华, 李 斌, 胡惠英, 程 磊, 吴坛光
解放军161医院麻醉科,武汉430010
急性高容量血液稀释(acute hypervolemic hemodilution,AHH)和自体血液回收均是血液保护的有效措施。目前,有关联合应用AHH和自体血回收对红细胞功能影响的研究较少,本研究通过观察AHH联合自体血回收对回输自体血前后红细胞内钙离子浓度及膜钙泵活性的影响,探讨其对红细胞功能的影响。
1 资料与方法
1.1 一般资料
研究通过本医院伦理委员会批准,并与患者签署知情同意书。选择复杂骨科手术预计出血量超过800 mL患者40例,ASA分级Ⅱ级,性别不限,年龄30~65岁。研究对象排除肝肾功能不全、凝血功能异常、血液系统疾病、糖尿病、服用钙离子拮抗剂等患者。采用随机数字表法随机分为2组:A组用6%羟乙基淀粉130/0.4氯化钠注射液行术前AHH联合术中自体血回输;B组单用术中自体血回输。
1.2 麻醉方法
全部患者均采用气管插管静脉全麻。患者入室后建立静脉通路,输注复方乳酸钠林格氏液,行右颈内静脉穿刺置管,用于持续动脉血压监测和血样采集。麻醉前30min肌肉注射阿托品0.01mg/kg,全麻诱导采用咪唑安定1~2mg、丙泊酚1~2mg/kg、芬太尼2~3 μg/kg、维库溴铵0.8~1.2mg/kg,快速气管内插管后接麻醉机,行机械呼吸,调节潮气量和呼吸频率,维持呼气末二氧化碳分压(PET CO2)在30~35mmHg。全麻维持采用丙泊酚和瑞芬太尼静脉输注,以维持合适的麻醉深度和循环稳定。手术期间输乳酸林格氏液和万汶(2∶1)进行补液,调整速度及用量,使中心静脉压维持在5~12cmH2O。
1.3 血液回收方法
术中应用美国Cell saver 5+(2005)血细胞回输仪(美国血液技术公司)行血液回输。手术开始前,连接安装各种管道系统和储血过滤器、血液回收罐,2支肝素(12.5kU/支)加入500mL生理盐水配制抗凝液,预充肝素盐水至储血罐25mL刻度处,控制抗凝液滴速(肝素盐水和术中收集血液的比例为1∶5~7),调整负压为-200mmHg。采用自动模式回收,回收血液在4~6h内回输体内。
1.4 采样
分别于麻醉前(T1)、手术开始前血液稀释后(T2)、洗涤前(T3)(血细胞回输仪收集至储血罐内血液),洗涤后(T4)(血细胞回输仪洗涤过滤后收集至输血袋内红细胞悬液)各采血2mL。所有标本均以肝素钠(10U/L)抗凝,置于离心管中4℃保存。
1.5 红细胞内钙离子浓度的检测
采用合成指示计法中单波长激发指示剂法测定红细胞内游离钙离子浓度[1]。所用试剂为第3代荧光指示剂钙离子探针 Fluo-3-AM(50013,Biotium,美国)、钙离子载体4Br-A23187(BIO-RAD公司)。检测时将肝素抗凝血于4℃下750g离心5min后分离并提取红细胞,4℃ PBS离心洗涤(750g,5 min)3遍后重悬成浓度为5×109/L的红细胞悬液,加入Fluo-3-AM 在37℃避光孵育30min,PBS漂洗2遍以除去细胞外多余的Fluo-3-AM。上荧光分光光度计(SMIHADZURF,日本)检测荧光强度(F),激发波长为490nm,发射波长为526nm。加入终浓度为5μmol/L的钙离子载体4Br-A23187孵育10min,检测最大荧光强度(Fmax)。用含有钙离子螯合剂EGTA的PBS漂洗2遍后检测最小荧光强度(Fmin)。用以下公式计算出红细胞内钙离子浓度:钙离子浓度=Kd×[(F-Fmin)/(Fmax-F)],Kd=450nmol/L
1.6 红细胞膜钙泵活性测定
由于红细胞Ca2+-Mg2+-ATP酶在合适的离子浓度、温度、pH条件下均能水解ATP产生无机磷(Pi),故可由Pi量来反映ATP酶的活性。用改良的Fiske-Subbarow法测定释放Pi量[2]。酶活性单位以μmol Pi·gHb-1·2h-1表示。
1.7 统计分析
采用SPSS 12.0统计学软件进行分析,计量资料以均数±标准差(±s)表示,组内和组间比较采用t检验或方差分析。以P<0.05为差异有统计学意义。
2 结果
2.1 红细胞内钙离子浓度
两组自体血收集洗涤前后(T3、T4)与术前(T1)比较,红细胞膜 Ca2+浓度明显增加(P<0.05);与B组比较,A组于T3、T4时间点红细胞膜Ca2+浓度明显下降(P<0.05),见表1。
表1 两组患者各检测时点红细胞内Ca2+浓度比较(n=20,±s,nmol/L)Table 1 Comparison of intracellular calcium concentration of ery throcytes in the two groups(n=20,±s,nmol/L)
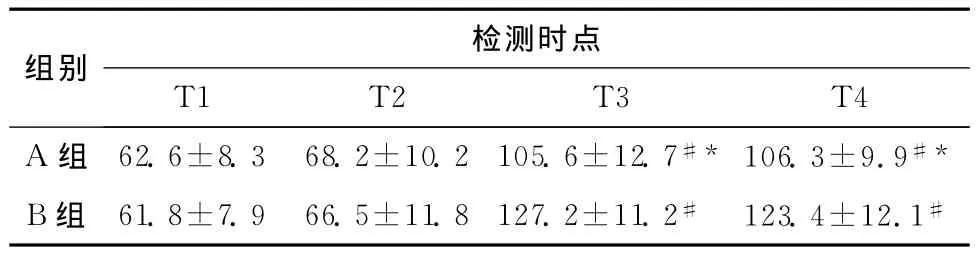
表1 两组患者各检测时点红细胞内Ca2+浓度比较(n=20,±s,nmol/L)Table 1 Comparison of intracellular calcium concentration of ery throcytes in the two groups(n=20,±s,nmol/L)
与B组比较,*P<0.05;与同组T1比较,#P<0.05
检测时点组别T1 T2 T3 T4 A组 62.6±8.3 68.2±10.2 105.6±12.7#* 106.3±9.9#*B组 61.8±7.9 66.5±11.8 127.2±11.2# 123.4±12.1#
2.2 红细胞膜钙泵活性
两组自体血收集洗涤前后(T3、T4)与术前(T1)比较红细胞膜Ca2+-Mg2+-ATP酶活性均明显下降(P<0.05);与B组比较,A组于T3、T4时间点红细胞膜Ca2+-Mg2+-ATP酶活性明显升高(P<0.05),见表2。
表2 两组患者红细胞膜Ca2+-Mg2+-ATP酶活性比较(n=20,±s,μmol Pi·gHb-1·2h-1)Table 2 Comparison of Ca2+-Mg2+-ATPase activity of erythrocyte membranes in the two groups(n=20,±s,μmol Pi·gHb-1·2h-1)
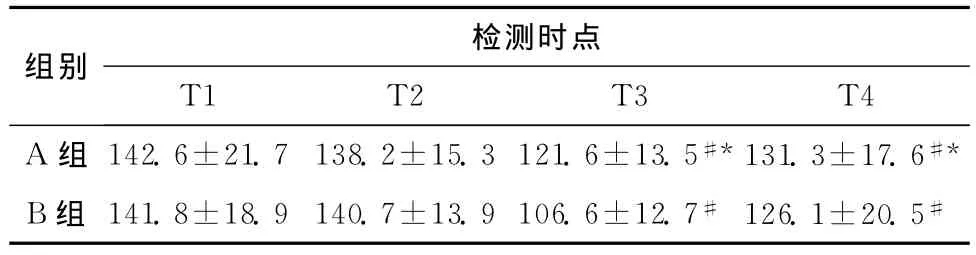
表2 两组患者红细胞膜Ca2+-Mg2+-ATP酶活性比较(n=20,±s,μmol Pi·gHb-1·2h-1)Table 2 Comparison of Ca2+-Mg2+-ATPase activity of erythrocyte membranes in the two groups(n=20,±s,μmol Pi·gHb-1·2h-1)
与B组比较,*P<0.05;与T1比较,#P<0.05
检测时点组别T1 T2 T3 T4 A组 142.6±21.7 138.2±15.3 121.6±13.5#*131.3±17.6#*B组 141.8±18.9 140.7±13.9 106.6±12.7# 126.1±20.5#
3 讨论
近年来随着自体血回输仪装备的改进和发展,自体血回收技术已成为血液保护重要措施之一[3]。尽管回收的红细胞携氧能力和库存的异体血相同,回收红细胞成活率与异体红细胞相当[4],但是由于手术中负压吸引以及血细胞回输仪对血液的过滤、离心、清洗等处理对红细胞造成一定破坏,使得人们对单独使用自体血回收技术能否减少异体输血用量的认识存在较大分歧[4-5]。有研究表明回收组回输了自体血,但异体输血量仍明显多于对照组[6]。因此如何减轻红细胞物理损伤,改善微循环灌注,减少红细胞丢失,对于维持患者循环稳定,节约用血有重要临床意义。
AHH是在麻醉后通过加深麻醉使血管容量得到一定的扩张,并同步快速输注相当于20%自身血容量的胶体液使血液稀释,是减少手术出血时红细胞丢失的重要方法之一[6-7]。既往研究表明行AHH至Hct下降至20%能更好地降低血浆黏滞度,改善组织灌注,有利于氧的输送,且对血流动力学和凝血功能无明显影响[8-9]。然而新近研究表明血液过度稀释会导致血浆Cl-增加,Ca2+下降,血浆C反应蛋白水平增加,使老年患者心脏负荷增加[10-11]。因此采用适度AHH联合其他血液保护技术对AHH的推广应用有重要意义。以往研究多局限于单独应用一种技术对患者血流动力学、凝血功能、内环境稳定性的影响,而对联合使用自体血回输和AHH对血液保护作用及其机制的研究国内外鲜见报道。本研究通过观察AHH联合自体血回收对回输自体血前后红细胞内钙离子浓度及膜钙泵活性的变化,为临床安全用血、有效减少异体输血提供依据。
正常成熟红细胞无核,呈双凹圆盘状,直径为7~9μm,具有良好的变形能力和抗剪切应力,通过直径仅有3μm的毛细血管为组织供氧。由于手术创面的组织表面及空气与手术野红细胞相接触可造成应力损伤,使血液回收机洗涤过的红细胞呈肿胀状态,可能导致红细胞流变性障碍。红细胞膜的流动性依赖细胞内正常的Ca2+平衡。在细胞膜钙泵的作用下,细胞内Ca2+浓度大约保持在20~120 nmol/L,要比细胞外Ca2+浓度低5万倍。人体红细胞内Ca2+增加通过激活Ca2+激活的钾通道迅速增加K+离子的通透,引起细胞膜的超极化。大量研究表明细胞内Ca2+增多是引起红细胞膜骨架结构异常和红细胞老化的主要原因之一,有学者已建立了成熟红细胞中Ca2+内流与细胞凋亡之间的关系模型[12]。Ca2+内流可以结合并激活钙蛋白酶,此酶可降解细胞骨架蛋白(如带2.1、4.1蛋白、收缩蛋白等),Ca2+也可激活谷氨酰胺酶,谷氨酰胺酶可与细胞骨架交联,引起细胞骨架可塑性和细胞变形性下降。因此红细胞内Ca2+增加参与了红细胞流变性障碍的产生。
本研究结果表明,两组患者自体血回收及洗涤回输至体内的红细胞内钙离子浓度均明显增加,而红细胞膜 Ca2+-Mg2+-ATP酶活性均明显下降,可能导致红细胞流变性障碍,这是回收机收集的红细胞回输体内后仍需输注较多异体血的原因之一。两组患者于T2时点比较无显著差异,表明血液稀释对红细胞内Ca2+浓度及Ca2+-Mg2+-ATP酶活性无明显影响,通过联合AHH技术在一定程度上改善细胞内Ca2+增多,可能与血液稀释后红细胞聚集性下降,因而在相同负压下破坏减少有关。而且联合AHH技术能减少手术中红细胞丢失,对于减少异体血用量、维持有效循环稳定及患者的术后恢复有重要临床意义。
[1] 石玉玲,习松.Fluo-3荧光微量法测定人红细胞胞浆内游离钙离子浓度[J].检验医学,2005,20(3):290-291.
[2] 毛亚伦,刘东海 .红细胞内钙离子浓度及膜钙泵活性的测定[J].现代实用医学,2001,13(8):414-417.
[3] Dragan S,Kulej M,Krawczyk A,et al.Methods of reducing allogeneic blood demand in orthopedic surgery[J].Ortop Traumatol Rehabil,2012,14(3):199-214.
[4] Williamson K R,Taswell H F.Intraoperative blood salvage:A review[J].Transfusion,1991,31(8):662-668.
[5] Kumar N,Chen Y,Nath C,et al.What is the role of autologous blood transfusion in major spine surgery?[J].Am J Orthop(Belle Mead NJ),2012,41(6):E89-E95.
[6] Gause P R,Siska P A,Westrick E R,et al.Efficacy of intraoperative cell saver in decreasing postoperative blood transfusions in instrumented posterior lumbar fusion patients[J].Spine,2008,33(5):571-575.
[7] 骆喜宝,刘志贵,林高翔,等 .急性高容量血液稀释联合氨甲环酸对血流动力学及血气、电解质的影响[J].实用医学杂志,2011,27(15):2733-2735.
[8] Saricaoglu F,Akinci S B,Celiker V,et al.The effect of acute normovolemic hemodilution and acute hypervolemic hemodilution on coagulation and allogeneic transfusion[J].Saudi Med J,2005,26(5):792-798.
[9] 庄伟强,张小霓,林财珠 .急性高容量血液稀释对血液保护作用的研究进展[J].医学综述,2011,17(21):3311-3314.
[10] 刘慧慧,彭雪梅,林永新,等 .急性高容量血液稀释对脊柱手术患者超敏C反应蛋白的影响[J].南方医科大学学报,2011,31(6):1063-1065.
[11] 李前辉,王玲,吴青华,等 .术前急性高容量血液稀释对患者内稳态的影响[J].实用医药杂志,2010,27(1):21-24.
[12] Lang F,Lang K S,Lang P A,et al.Mechanisms and significance of eryptosis[J].Antioxid Redox Signal,2006,8(7/8):1183-1192.
