红花羊蹄甲花色素的提取及其稳定性研究
2013-05-15蒋林斌梁榕珊
李 容,蒋林斌,覃 涛,梁榕珊
(1.右江民族医学院药学系,广西百色533000;2.广西大学化学化工学院,广西南宁530004)
色素分为天然色素和人工合成色素。天然色素相对合成色素具有以下优点:安全性高、无毒副作用、色调和气味自然,有人体必需的营养成分,具有生理和保健功能[1]。因此,天然色素越来越受到人们的重视,开发和利用天然色素已成为趋势。
豆科(Leguminosae)羊蹄甲属(Bauhinia)植物在全世界约有600种,我国约有40种,主要分布在南方[2]。红花羊蹄甲(Bauhinia blakeana Dunn.)又名洋紫荆、艳紫荆,为羊蹄甲属中比较常见的品种,常用作观赏花木。红花羊蹄甲花期长、花量大、花色艳、花味香,但长期以来仅供观赏后任其自生自灭,未加利用,非常可惜。红花羊蹄甲花中含有丰富的天然红色素,该色素水溶性好,色值高,具有较大的研究和开发价值[3]。目前,从红花羊蹄甲花中提取色素的研究非常少,其色素稳定性方面的研究并未见报道。本文研究了红花羊蹄甲花色素的提取工艺和稳定性,旨在为该花卉资源的可持续利用提供参考。
1 材料与方法
1.1 材料与仪器
红花羊蹄甲花瓣 采自百色市右江区街道两旁,将花瓣阴干,粉碎后置干燥避光处备用;盐酸、乙醇、丙酮、乙酸乙酯、氢氧化钠、氯化钾、氯化钠、氯化镁、硫酸锌、硫酸铜、氯化钙、绿化铝、氯化铁、亚硫酸钠、过氧化氢、葡萄糖、蔗糖、柠檬酸、苯甲酸钠 均为国产分析纯。
TU-1800型紫外可见分光光度计 北京普析通用仪器有限公司;pHS-3C型pH计 上海雷磁仪器厂;FD-1A-50型真空冷冻干燥机 上海比朗仪器有限公司;3-18K型离心机 SIGMA公司;RE-52AA型旋转蒸发仪 上海安亭实验仪器有限公司;KQ500DB型数控超声波清洗器 昆山市超声仪器有限公司;FA1104型电子分析天平 上海天平仪器厂;FZ102型植物粉碎机 上海锐丰仪器仪表有限公司;HHS-21-4型电热式恒温水浴锅 江苏金坛宏凯仪器厂;SHB-Ⅲ型循环水式多用真空泵 郑州长城科工贸有限公司。
1.2 实验方法
1.2.1 工艺流程 鲜羊蹄甲花→自然风干→粉碎→加入溶剂超声波提取→抽滤→离心(取少量测吸光度)→减压浓缩→低温真空干燥→色素固体。
1.2.2 提取溶剂的选择 称取7份2g羊蹄甲花,各加入95%乙醇溶液、75%乙醇溶液、0.2mol/L盐酸溶液、酸性乙醇溶液(乙醇体积分数为75%,pH=1)、丙酮、乙酸乙酯、蒸馏水各100mL作提取剂。室温浸提5h,抽滤得色素原液,观察色素溶液颜色,以溶剂为空白,测色素液在可见光区的最大吸收波长及吸光度值。
1.2.3 最大吸收波长的确定 取5份羊蹄甲花1g,各加入不同浓度的盐酸100mL作提取剂,室温浸提2h,抽滤得色素原液,以溶剂为空白,在400~700nm范围内扫描吸收光谱。
1.2.4 单因素实验 考察盐酸浓度、固液比、超声功率、超声时间对提取效果的影响。色素的提取效果用最大吸收波长处的吸光度值来表示[4]。称取5份1g羊蹄甲花,各加入不同浓度的盐酸50mL,在超声波功率90W下提取20min,抽滤,取滤液5mL(1∶10滤液)定容至50mL,测吸光度;称取5份1g羊蹄甲花,各加入浓度为0.3mol/L的盐酸35、50、65、80、95mL,在超声功率90W的条件下提取20min,抽滤,定容,测吸光度;称取5份1g羊蹄甲花,各加入浓度为0.3mol/L的盐酸65mL,改变超声功率,提取20min,抽滤,定容,测吸光度;称取5份1g羊蹄甲花,加入浓度为0.3mol/L的盐酸65mL,在超声功率为90W的条件下提取不同时间,抽滤,定容,测吸光度。
1.2.5 正交实验 根据单因素实验结果,设置因素水平范围,进行L9(34)正交实验,确定最佳提取工艺条件,因素水平设置见表1。

表1 因素水平表Table 1 Factors and levels of orthogonal experiment
1.2.6 色素的稳定性研究 配制一定浓度的色素溶液,在不同的条件下测定其吸光度值的变化,考察pH、温度、光照、金属离子、氧化剂和还原剂、食品添加剂等对色素稳定性的影响[5]。
2 结果与分析
2.1 最佳提取溶剂的确定
羊蹄甲花粉末经不同溶剂浸提后结果见表2,由表2可知红花羊蹄甲红色素在极性较大的溶剂中溶解性较好,在极性较小的乙酸乙酯中几乎不溶,说明羊蹄甲花红色素为水溶性色素。从色素液颜色及吸光度值分析,盐酸液和酸性乙醇液都是较好的提取溶剂,综合考虑溶剂残留及生产成本等问题,故选择盐酸作为红花羊蹄甲红色素的提取剂。
2.2 红花羊蹄甲色素的最大吸收波长
羊蹄甲花色素的最大吸收波长受pH影响较大,考察pH对最大吸收波长的影响,实验结果如图1所示。由图1可知,pH<4.5时色素的最大吸收波长在(520±1)nm内,且吸光强度较大;当pH为6时最大吸收波长明显红移,吸光强度减小,这表明色素结构随pH减小而改变。由于本实验在测吸光度时均在<6的条件下进行,故选定520nm作为测定波长。
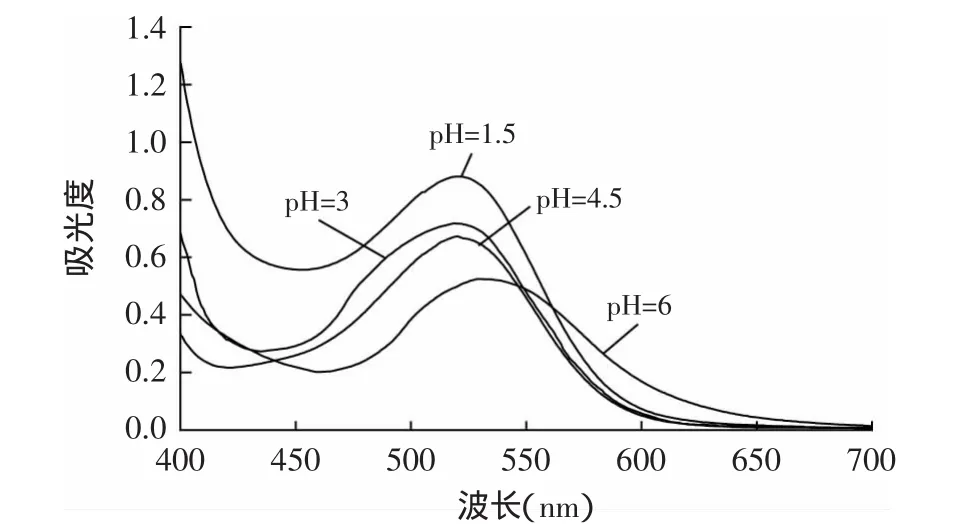
图1 羊蹄甲花红色素吸收光谱Fig.1 Absorption spectrum of pigment from Bauhinia blakeana Dunn flower
2.3 超声波辅助提取洋紫荆色素的单因素实验

图2 盐酸浓度对提取效果的影响Fig.2 Effect of hydrochloric acid concentration on extraction

表2 提取溶剂的选择Table 2 Effect of different solvents on pigment extraction
2.3.1 盐酸浓度对色素提取效果的影响 从图2可知,吸光度随盐酸浓度先增大而后缓慢减小,浓度0.3mol/L时达最大,其可能的原因是,大部分花中的色素都是花色苷类,pH对花色苷类物质结构影响很大,花色苷在酸性条件下较稳定,但也可能导致花色苷降解[6],因此选择提取溶剂的最佳浓度为0.3mol/L。
2.3.2 固液比对色素提取效果的影响 从图3可知,在固液比大于1∶65时,随着固液比的减小,色素的吸光度值增大,但小于1∶65后吸光度增加缓慢。这表明红色素在料液比1∶65的条件下已基本溶出。固液比太大,羊蹄甲花粉末与提取溶剂不能充分接触,使色素不能全部溶出;固液比太小浪费溶剂,给后期浓缩也带来一定困难[7],因此,选择1∶65作为最佳条件。
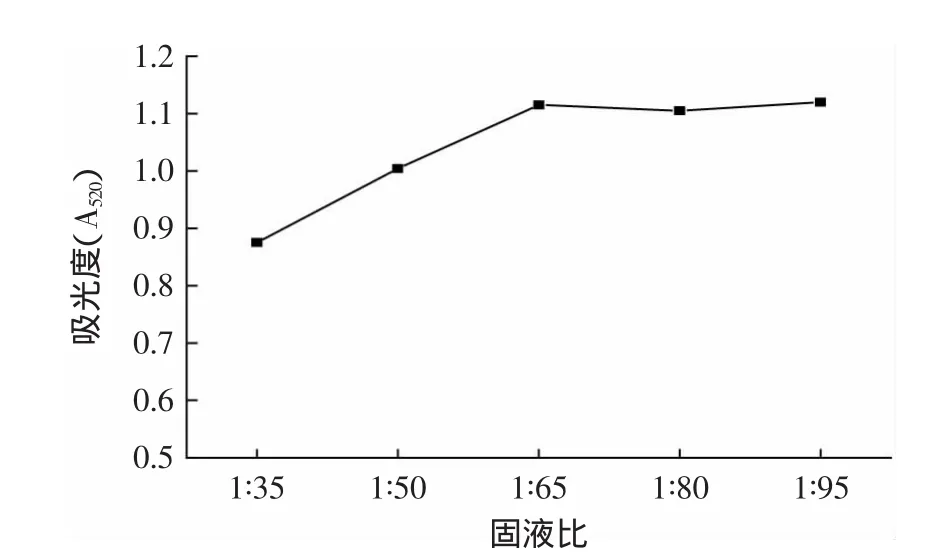
图3 固液比对色素提取效果的影响Fig.3 Effect of solid to liquid ratio on extraction
2.3.3 超声波功率对色素提取效果的影响 从图4可知,吸光度先随超声功率的增加而增大,超过120W后又降低。超声功率增大,加大了破壁程度,有利于色素溶出,但超声功率达到一定值后吸光度值开始下降,这可能是因为超声波具有较强的机械切力作用,作用强度过大可能改变色素的结构[8]。综合考虑选择90W作为最佳提取功率。
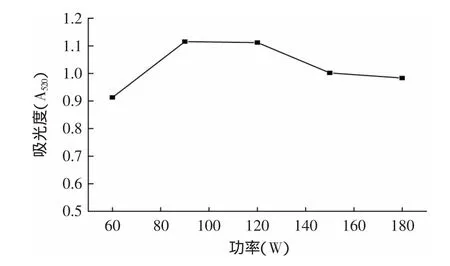
图4 超声功率对色素提取效果的影响Fig.4 Effect of ultrasonic power on extraction
2.3.4 超声波时间对色素提取效果的影响 由图5可知,吸光度随提取时间的增加而增大,到30min达最大值,而后又呈下降趋势。超声作用时间长热效应使局部温度过高,可能会使色素不稳定,大部分色素中含有酚羟基,易被氧化而脱色[9]。因此,较合适的超声时间为30min。
2.4 正交实验
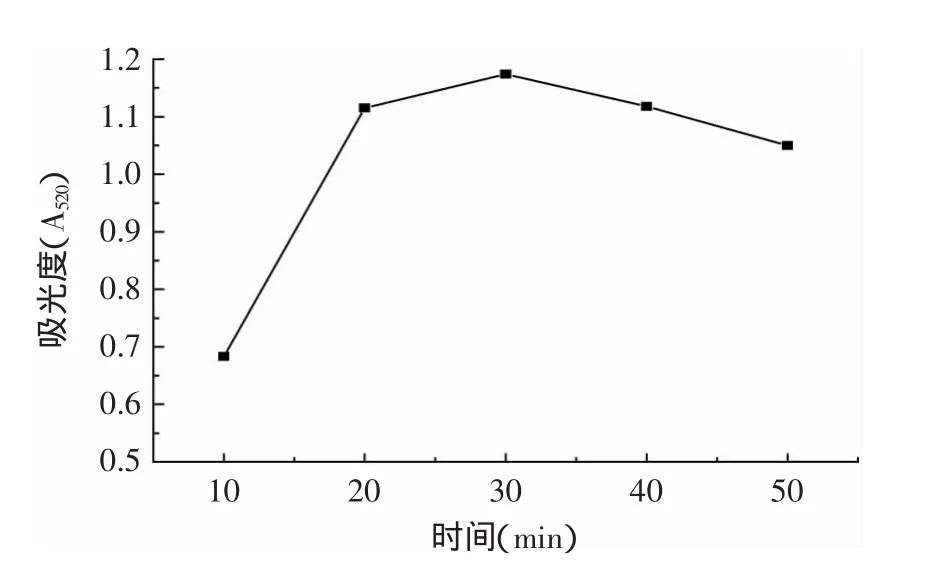
图5 超声时间对色素提取效果的影响Fig.5 Effect of extraction time on extraction
以盐酸为提取溶剂,采用超声波辅助提取羊蹄甲花红色素,影响红色素提取的主要因素是超声波功率、固液比、提取溶剂浓度、浸提时间,几种因素相互影响,因此进行L9(34)正交实验。根据单因素实验结果,设置因素水平范围,确定最佳提取工艺条件,正交实验结果见表3。
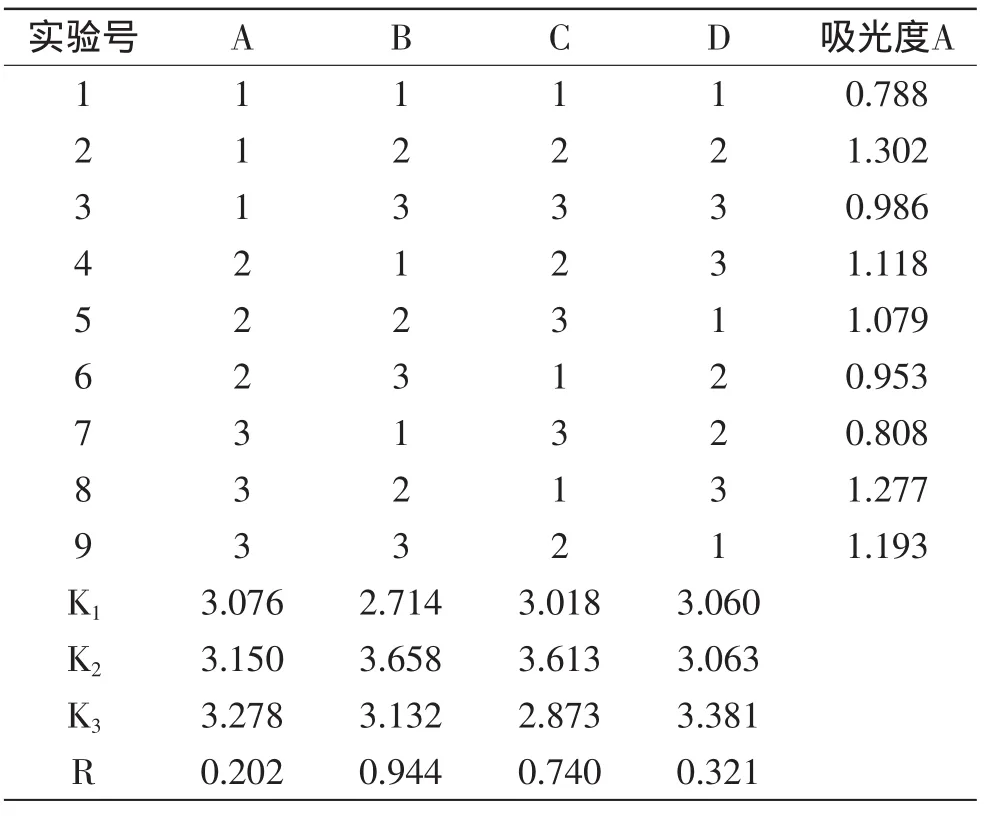
表3 正交实验结果Table 3 Result of orthogonal experiment
从表3分析可知,各因素对红色素提取的影响因素顺序为B>C>D>A,即超声功率>盐酸浓度>提取时间>液料比;最优水平是A3B2C2D3,即超声波提取红花羊蹄甲花色素的最佳工艺为:液料比1∶80,超声功率120W,盐酸浓度0.3mol/L,提取时间40min。在最优水平的条件下进行了3次验证性实验,测得色素液的吸光度值分别为1.415、1.403、1.420,平均值为1.407,高于正交表中的实验号2的实验结果;RSD为0.80%,说明最佳工艺条件具有良好的重现性。
2.5 色素稳定性研究
2.5.1 pH对色素稳定性的影响 用HCl和NaOH溶液调节色素溶液的pH,观察色素颜色变化,实验结果见表4。从表4可看出,羊蹄甲花红色素在酸性条件下色素颜色变化不大,较稳定。在碱性条件下色素溶液颜色已经发生改变,因此在提取和应用中宜采用酸性条件。pH对天然色素的影响主要是使天然色素的结构或组成发生变化,从而使其颜色发生变化[10]。
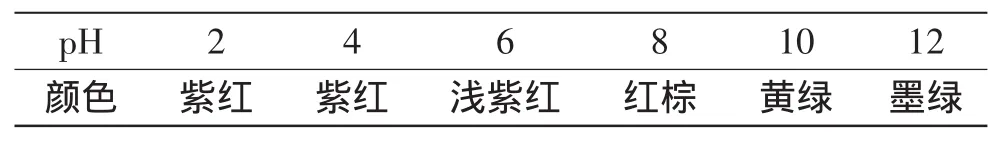
表4 pH对色素颜色的影响Table 4 Effect of different pH conditions on the stability of the pigment

表5 金属离子对色素稳定性的影响Table 5 Effect of metal ions on the stability of the pigment

表6 氧化还原剂对色素稳定性的影响Table 6 Effect of oxidant/reductant on the stability of the pigment
2.5.2 温度对色素稳定性的影响 取多份色素溶液,分别置于20、40、60、80、100℃的温度下加热4h,在最大吸收波长下测定吸光度值所示,实验结果见图6。从图6可知,羊蹄甲花色素在温度为20℃和40℃条件下,吸光度随加时间的延长基本没有变化,在60、80、100℃吸光度随时间的延长呈下降趋势,但在60℃条件下下降幅度不大,由此可见当温度超过80℃后温度对色素影响较大。这可能是该色素在加热过程中发生氧化反应,导致的共价键断裂以及在此基础上的进一步反应引起的[11]。因此在制备和存储羊蹄甲花色素时应尽量在低温条件下进行。
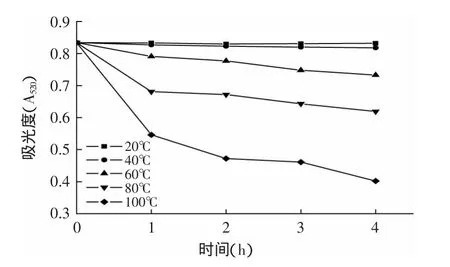
图6 不同温度对色素稳定性的影响Fig.6 Effect of different temperatures on the stability of the pigment
2.5.3 光照对色素稳定性的影响 将相同浓度的色素溶液分别置于室外自然光、室内自然光、避光的环境下放置7h,测定吸光度值,实验结果见图7。从图7可知,羊蹄甲花色素在室内自然光、避光的条件下,吸光度值几乎没有变化,在室外自然光下随时间的延长吸光度有所下降,但7h下降的幅度不超过5%,说明羊蹄甲花色素有较好的光稳定性。
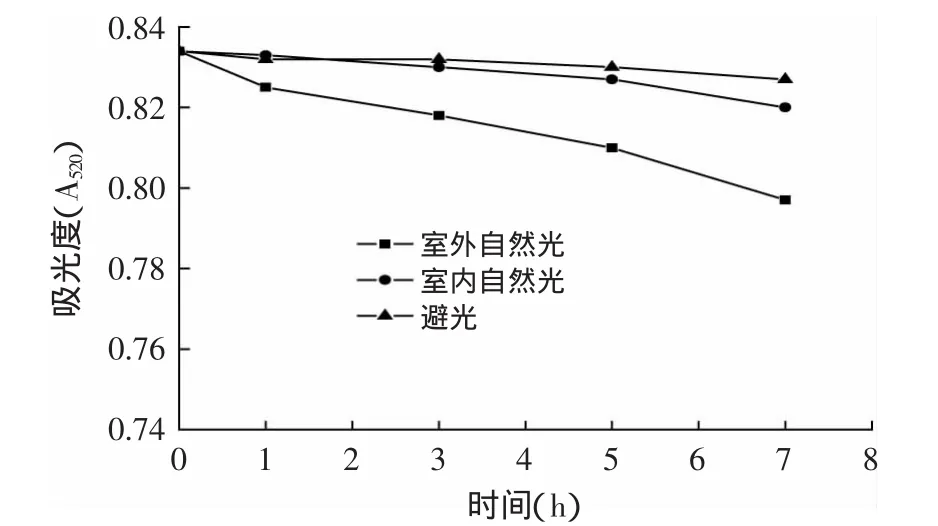
图7 光照对色素稳定性的影响Fig.7 Effect of different lights conditions on the stability of the pigment
2.5.4 金属离子对色素稳定性的影响 配制含有K+、Na+、Ca2+、Zn2+、Cu2+、Mg2+、Al3+、Fe3+浓度为100mg/L的色素溶液及空白色素溶液,避光放置,分别在1、24h测定溶液吸光度,观察溶液的颜色,实验结果见表5。从表5可知,加入K+、Na+、Ca2+离子使色素吸光度值略有增大,对羊蹄甲花色素有一定的增色、护色作用[12]。加入Zn2+、Cu2+、Mg2+、Al3+、Fe3+使色素吸光度值减小,甚至观察到加入Fe3+离子的色素液变为棕色,表明这些离子对色素的稳定性影响较大,其原因可能是离子会与色素反应,使色素退色或生成其他颜色的物质[13]。因此在制备和存储羊蹄甲花色素时应尽量避免与Zn2+、Cu2+、Mg2+、Al3+、Fe3+接触。
2.5.5 氧化剂、还原剂对色素稳定性的影响 配制含亚硫酸钠、双氧水不同浓度的色素溶液及空白色素溶液,测定溶液吸光度,观察溶液的颜色,实验结果见表6。从表6可知,加入氧化剂和还原剂后,色素的吸光度值在较短的时间内下降很大,颜色也消退,氧化剂和还原剂浓度越大影响越明显。因此,氧化剂和还原剂对色素的稳定性影响很大,在使用过程应避免加入氧化剂和还原剂。
2.5.6 食品添加剂对色素稳定性的影响 配制含5%葡萄糖、5%蔗糖、1%柠檬酸、1%苯甲酸钠的色素溶液及空白色素溶液,避光放置5h,测吸光度值的变化,实验结果见表7。从表7可知,加入葡萄糖、蔗糖、柠檬酸后吸光度值相比对照组有所提高,能增加色素的稳定性;加入苯甲酸钠后吸光度值比对照组略有降低,但降低幅度不是很大,添加适量的苯甲酸钠基本不影响色素的稳定性。
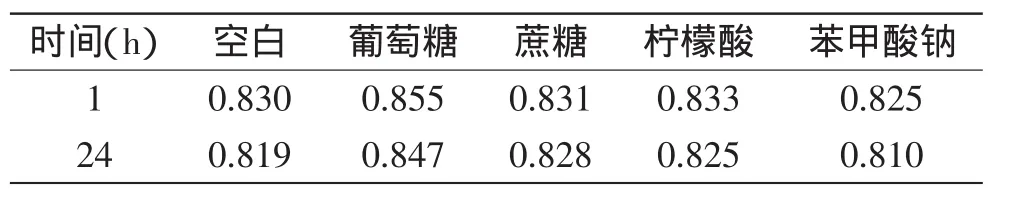
表7 食品添加剂对色素稳定性的影响Table 7 Effect of food additives on the stability of the pigment
3 结论
红花羊蹄甲花期较长、花量大、色值高,资源极其丰富,是一种很有开发前景的食用色素品种。采用超声波辅助提取花色素,最佳的工艺条件为:液料比1∶80,超声功率120W,盐酸浓度0.3mol/L,提取时间40min。超声波法具有工艺简单,对环境污染低,成本低等优点。但本实验的工艺条件主要适用于实验室,中试和大规模生产工艺条件还有待于进一步研究。
提取得到的红花羊蹄甲花色素外观呈紫红色,水溶性良好。通过羊蹄甲花色素的稳定性实验可知,色素在酸性、低温、光照条件下稳定,K+、Na+、Ca2+、葡萄糖、蔗糖、柠檬酸、苯甲酸钠存在利于色素稳定;但Zn2+、Cu2+、Mg2+、Al3+、Fe3+、H2O2、Na2SO3影响色素稳定性。色素的不稳定是许多天然色素普遍存在的问题,如何提高天然色素的稳定性是研究者以后应努力的方向,除此之外还应在色素的化学成分、生理活性、毒理学等方面进行全面的研究。
[1]付莉,王丽颖,顾英.南瓜黄色素的提取工艺及其抗氧化性的研究[J].食品工业科技,2011,32(1):193-194,197.
[2]赵燕燕,崔承彬,蔡兵,等.洋紫荆中化学成分的分离与鉴定[J].中国药物化学杂志,2004,14(5):294-297.
[3]焦淑清,徐晶莹.微波萃取红花羊蹄甲花红色素的研究[J].食品研究与开发,2009,30(4):190-192.
[4]凌关庭.食品添加剂手册[M].北京:化学工业出版社,2003:1006.
[5]陈杰.紫甘薯色素提取、纯化及稳定性研究[D].无锡:江南大学,2011:23-29.
[6]凌文华,郭红辉.植物花色苷[M].北京:科学出版社,2009:57.
[7]张俊杰,王淑霞,周云,等.响应面分析法优化米团花黄色素提取工艺研究[J].食品工业科技,2010,31(6):259-210.
[8]宋晓秋,叶琳,杨晓波.紫甘蓝色素提取方法研究[J].食品科学,2011,32(8):74-77.
[9]孙希云,刘宁,孟宪军,等.蓝莓多糖超声波提取及脱蛋白方法[J].食品科学,2010,31(22):134-138.
[10]王凤洁,沈国良,李良,等.巴旦杏壳天然黄色素提取及其稳定性研究[J].南京林业大学学报:自然科学版,2013,37(1):105-110.
[11]Ankit P,Nigel P,Bruntona C,et al.Effect of thermal processing on anthocyanin stability in foods,mechanisms and kinetics of degradation[J].Trends in Food Science&Technology,2010,21(1):3-11.
[12]王桐,石丽花,陈惠.枣皮中食用色素的提取工艺及其稳定性研究[J].中国食品添加剂,2006(5):72-76.
[13]胡迎芬,黄震.女贞果红色素与金属离子效应的研究[J].青岛大学学报:自然科学版,2002,15(2):22-25.
